Índice
Preparación de derivados
Cuando se reemplaza el OH en un ácido carboxílico por otra función como X (Cl, Br), OR, NH2, etc., se obtienen compuestos denominados «derivados de ácidos carboxílicos«. Todos ellos tienen en común el grupo acilo (R-C=O).
Estos derivados se convierten, a su vez, en ácidos mediante hidrólisis, y también dan lugar a reacciones de interconversión entre ellos. Las reacciones de formación de derivados de ácidos carboxílicos transcurren mediante un mecanismo de adición nucleofílica-eliminación característico.
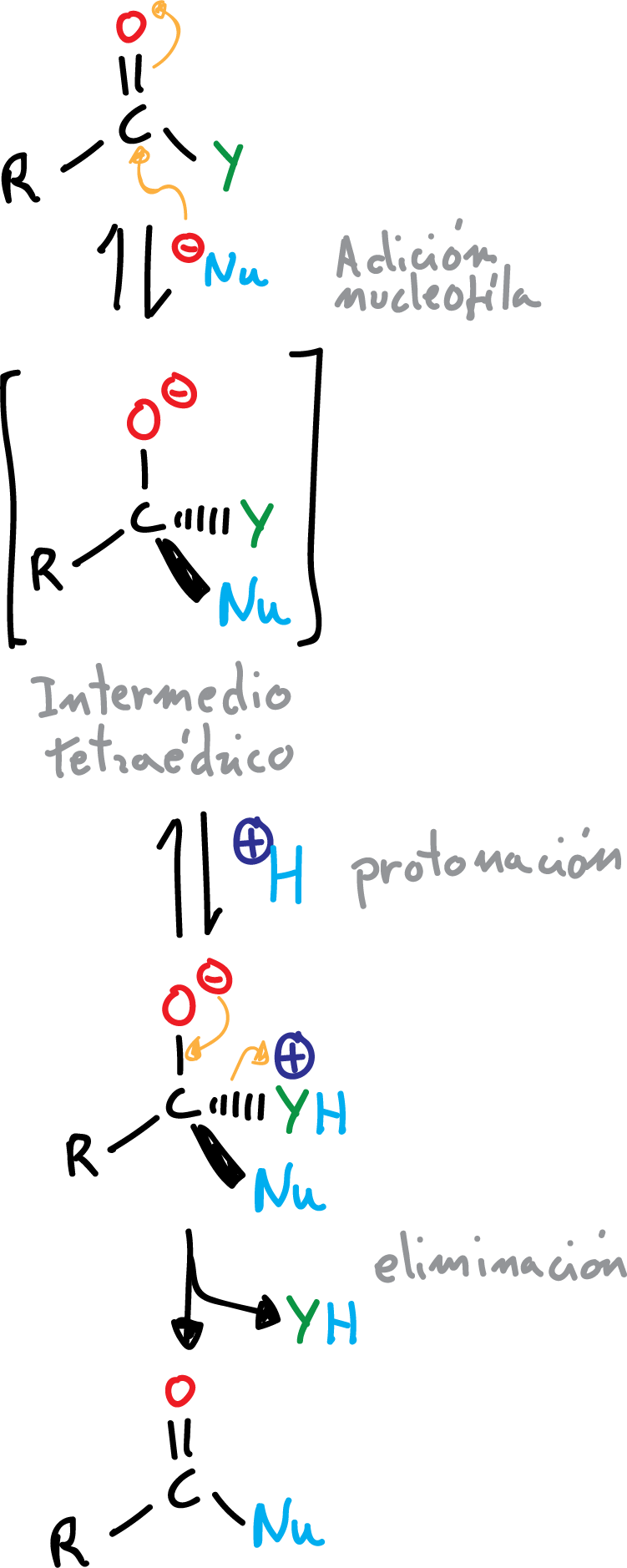
A diferencia de las reacciones de aldehídos y cetonas, donde en el intermedio tetraédrico el –O⊖ se protonaba, aquí se protona uno de los sustituyentes (convirtiéndolos en buenos grupos salientes) y se elimina para regenerar el doble enlace >C=O.
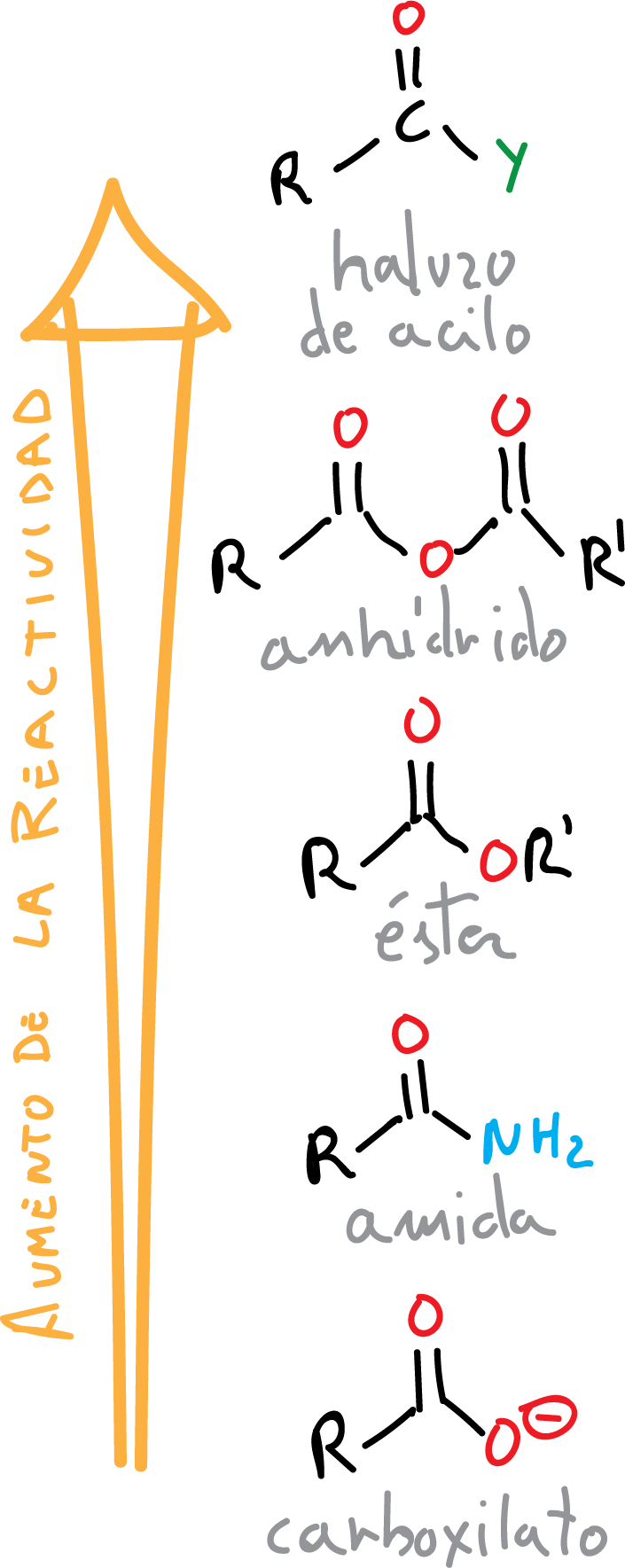
El orden de reactividad de los ácidos carboxílicos en los procesos de adición nucleófila-eliminación se explica según la basicidad del grupo saliente, siendo el más básico el anión X⊖ y el menos básico el H2N⊖, así como por la estabilización por resonancia de ciertos grupos:
Formación de haluro de acilo a partir de ácido carboxílico
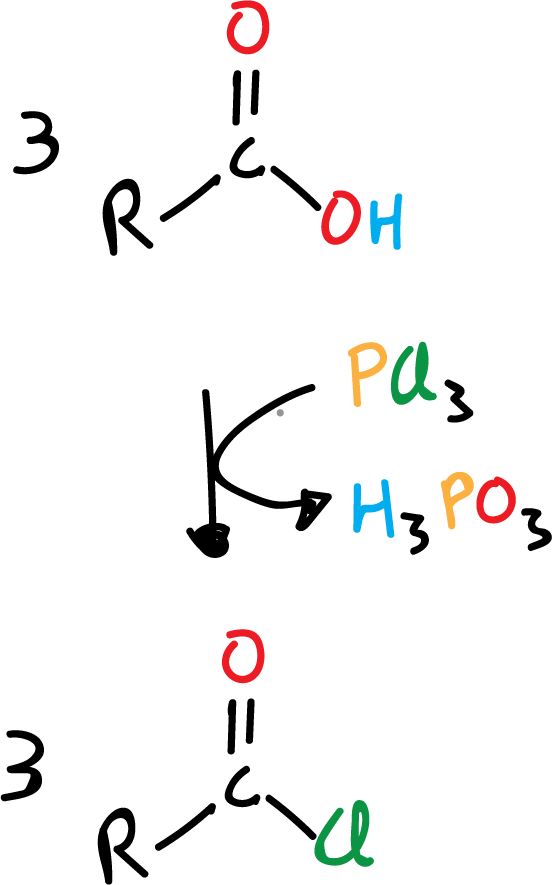
Una de las reacciones más útiles de los ácidos carboxílicos es su conversión a haluros de acilo, concretamente a cloruros de acilo, ya que como veremos más adelante estos cloruros son muy versátiles y pueden, a su vez, convertirse en otros derivados fácilmente. Frecuentemente, se emplea uno de los siguientes reactivos:
- cloruro de tionilo, SOCl2
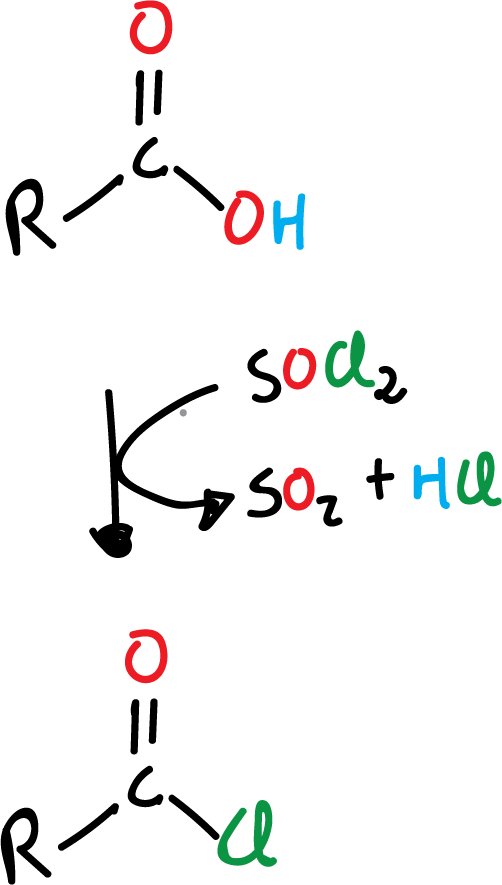
- tricloruro de fósforo, PCl3
- pentacloruro de fósforo, PCl5
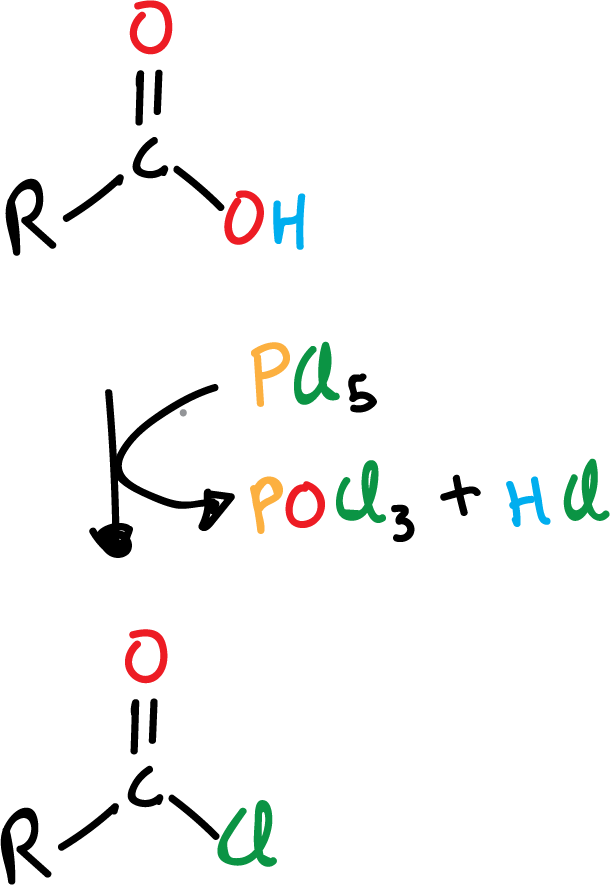
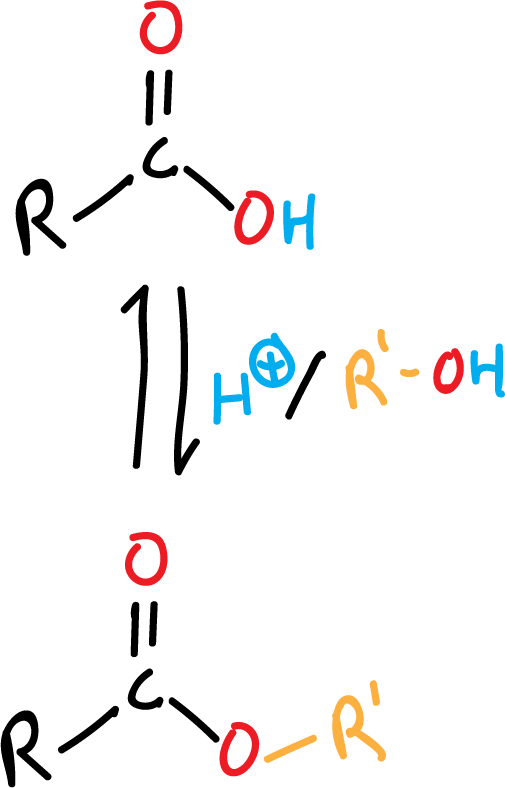
Formación de éster a partir de ácido carboxílico (esterificación de Fischer)
Los ésteres se pueden formar directamente a partir de sus correspondientes ácidos carboxílicos, calentándolos con alcohol, bajo catálisis ácida (generalmente H2SO4 concentrado o HCl seco).
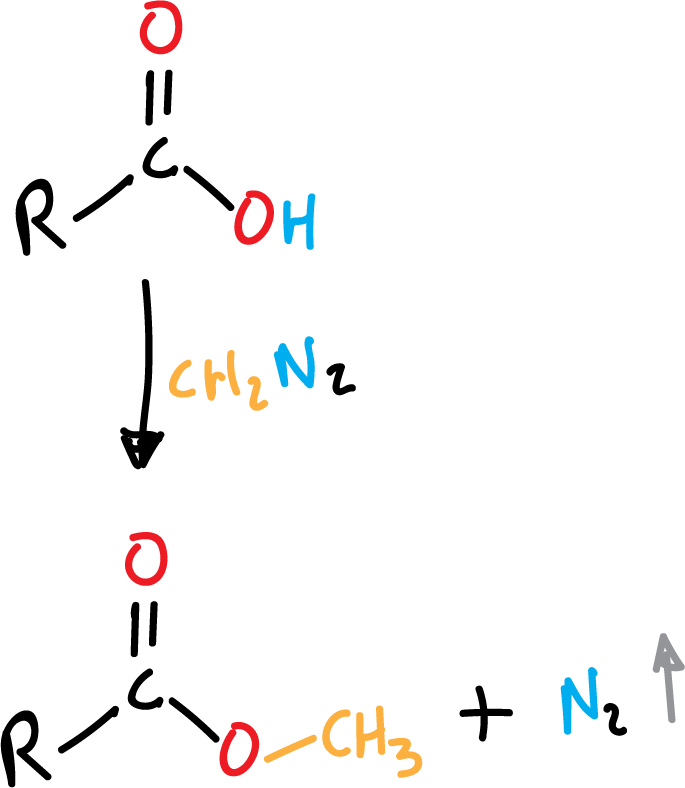
Formación de éster a partir de ácido carboxílico
Los ésteres metílicos se pueden obtener fácilmente a partir de diazometano (CH2N2) como se indica en el esquema, como subproducto de reacción se obtiene nitrógeno gaseoso (N2).
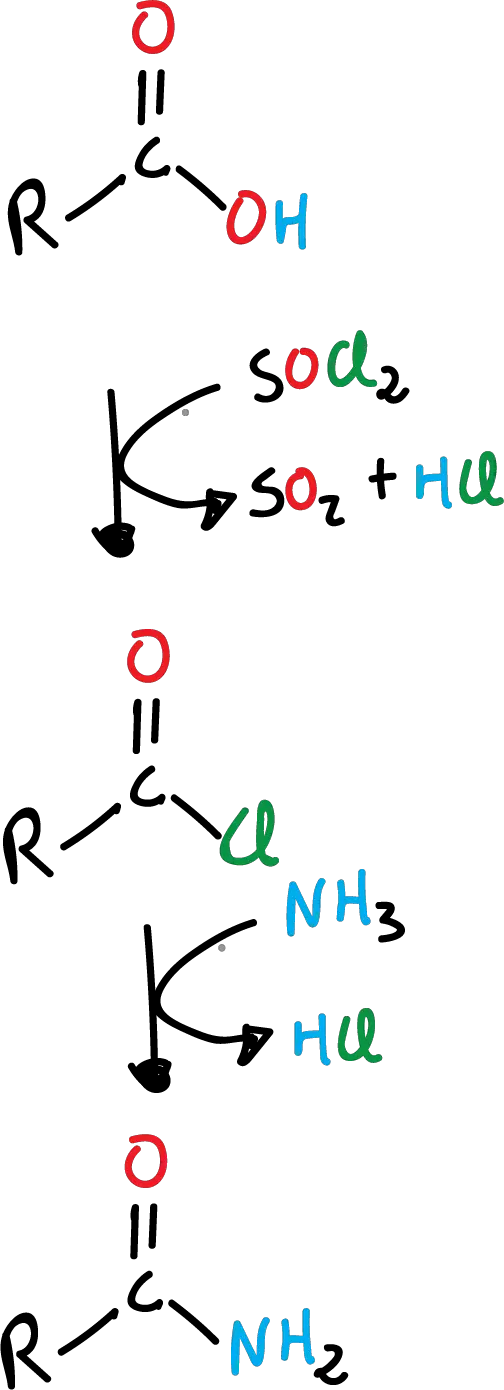
Formación de amida a partir de ácido carboxílico
Las amidas se obtienen por el reemplazo del –OH por el grupo –NH2, a partir de los ácidos carboxílicos. No se hace directamente, sino que se necesita de una reacción adicional de formación del cloruro de acilo correspondiente. Es un proceso en dos pasos, primero la formación del cloruro de acilo y posteriormente, la formación de la amida.
Con amoníaco, la reacción queda como se indica en el siguiente esquema:
Esta reacción se puede llevar a cabo, también, con aminas primarias (R’-NH2), como se muestra en el siguiente esquema:
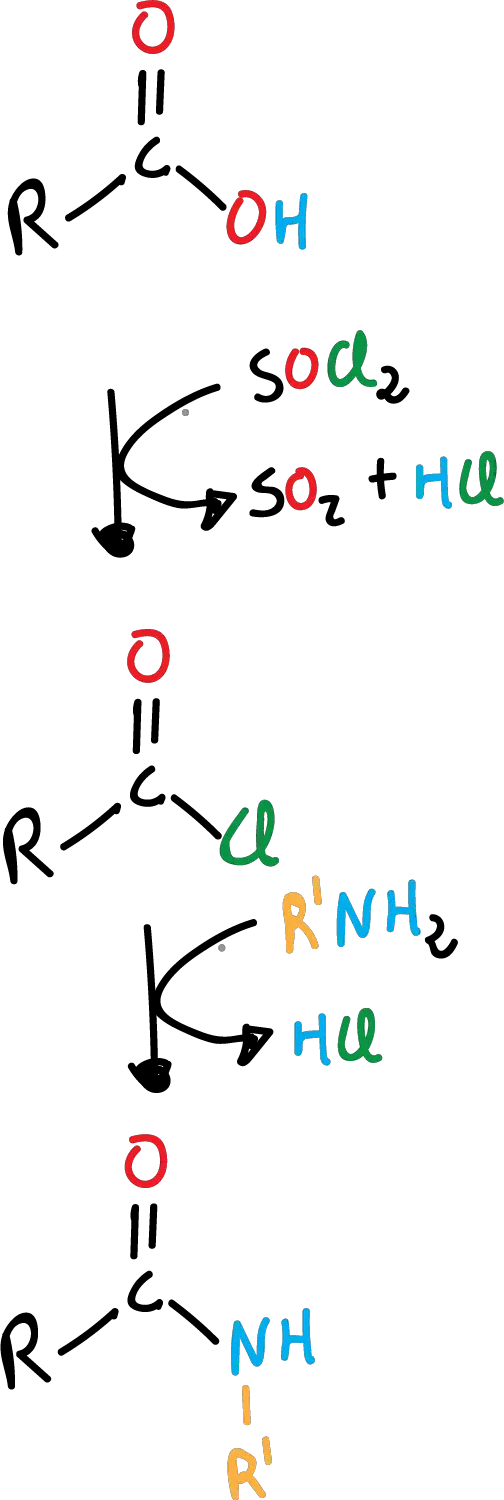
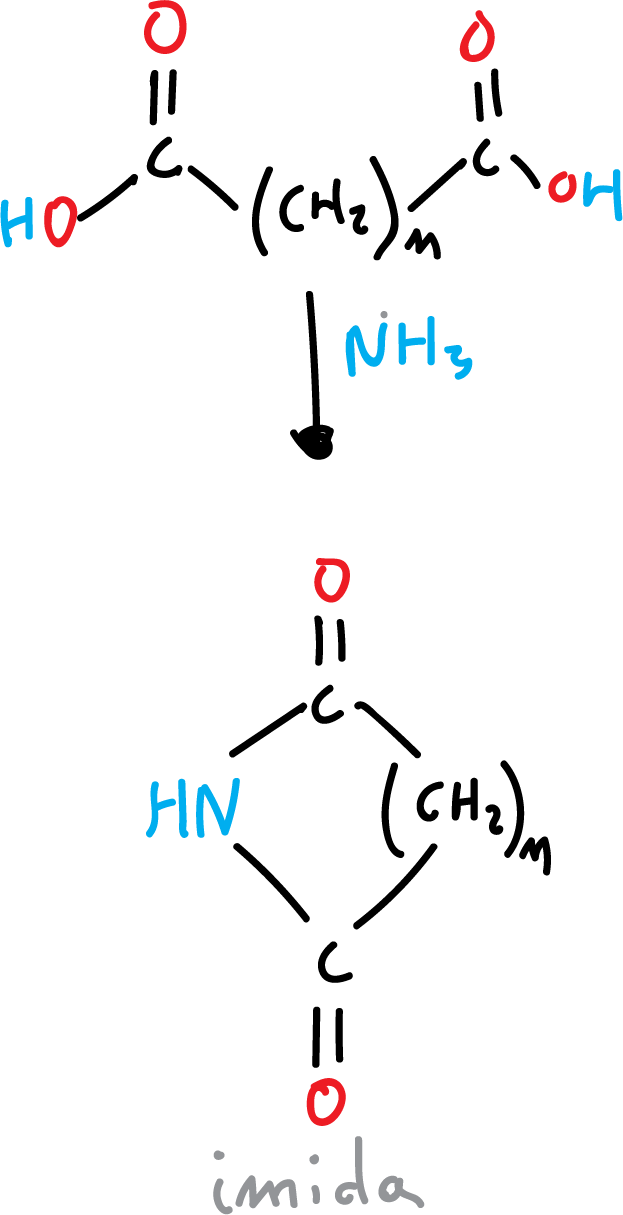
Formación de imida a partir de ácido dicarboxílico
Las imidas son los análogos nitrogenados de los anhídridos de ácido. Uno de las imidas más características es la ftalimida usada en la síntesis de Gabriel.
Reducción
Uno de los pocos reactivos que reduce el grupo carboxílico hasta alcohol es el LiAlH4. Se genera un alcóxido que posteriormente da el alcohol mediante hidrólisis.
Esta reacción es especialmente útil en la transformación de los ácidos carboxílicos de cadena larga que provienen de las grasas. Se suele utilizar THF como disolvente y la reacción se finaliza en medio acuoso ligeramente ácido.
fig9
Halogenación en posición α
Los ácidos carboxílicos alifáticos reaccionan en condiciones suaves con halógenos en el carbono-α, en presencia de pequeñas cantidades de fósforo (reacción de Hell-Volhard-Zelinsky).
fig10
Cloruros de acilo
Formación de anhídrido a partir de cloruro de acilo
Los cloruros de acilo son los derivados de ácido carboxílico más reactivos. Los anhídridos de ácido se obtienen por la reacción de cloruro de acilo con ácido carboxílico en presencia de una base no nucleofílica (por ejemplo, piridina), que se usa para neutralizar el exceso de HCl.
fig11
Formación de éster a partir de cloruro de acilo
Una forma muy útil de obtener un éster es a partir de la reacción de un cloruro de acilo con un alcohol. Se realiza en condiciones básicas, para neutralizar el exceso de HCl.
fig12
Reducción hasta aldehídos de cloruro de acilo (Reducción de Rosenmund)
La hidrogenación catalítica de cloruros de acilo permite la obtención de aldehídos. El catalizador debe ser envenenado con BaSO4y quinoleína.
fig13
Reducción hasta aldehído a partir de cloruro de acilo
Para conseguir la reducción parcial hasta aldehído necesitamos usar reactivos de transferencia de hidruro que presenten grupos alquilo voluminosos. Puesto que el LiAlH4 y el NaBH4 reaccionarían también con el aldehído obtenido, se utilizan reactivos modificados como el LiAl(t-BuO)3H (con un hidruro que reacciona sólo con el cloruro de acilo y no con el aldehído formado).
fig14
Reducción a alcohol primario a partir de cloruro de acilo
Con LiAlH4, los cloruros de acilo se reducen totalmente hasta alcohol primario.
fig15
Formación de alcohol terciario a partir de cloruro de acilo
Con nucleófilos de carbono como son los reactivos de Grignard (R’MgX), los cloruros de acilo se reducen directamente hasta alcohol terciario (no se obtiene la correspondiente cetona).
fig16
Formación de amida a partir de cloruro de acilo
El amoníaco, así como las aminas primarias y secundarias reaccionan con cloruros de acilo para dar amidas. Se usan, al igual que en la formación de éster, condiciones básicas para neutralizar el HCl formado.
fig17
Hidrólisis a ácido carboxílico a partir de cloruro de acilo
Los cloruros de acilo se hidrolizan a sus correspondientes ácidos carboxílicos mediante un mecanismo de adición-eliminación. Son tan reactivos que con solo añadir agua fría se hidrolizan. Los cloruros de acilo alifáticos reaccionan mucho más rápidamente (a veces violentamente) que sus homólogos aromáticos.
fig18
Formación de cetona a partir de cloruro de acilo
La transformación de un cloruro de acilo a cetona se podría realizar con reactivos organometálicos (RLi) y reactivos de Grignard (RMgX); sin embargo, debido a que éstos no son muy selectivos reaccionan con la cetona formada dando alcohol.
Por tanto, el mejor método de obtener cetonas a partir de cloruros de acilo es mediante compuestos organocupratos. Éstos son más selectivos que el RLi o el RMgX y no reaccionan con la cetona que se obtiene.
fig19
Formación de cetona a partir de cloruro de acilo (acilación Friedel-Crafts)
fig20
Anhídridos de ácido
Conversión a ácido carboxílico
Los anhídridos de ácido dan lugar a reacciones de sustitución análogas a las estudiadas de cloruros de acilo, pero de forma menos vigorosa. En este caso el grupo saliente es un ión carboxilato en lugar del cloruro.
Se utilizan condiciones básicas para eliminar el ácido carboxílico que se obtiene como subproducto en algunas de estas reacciones. Los anhídridos se hidrolizan para dar los correspondientes ácidos carboxílicos. Además, los anhídridos cíclicos dan lugar la rotura de anillo produciendo ácidos dicarboxílicos.
fig21
Formación de éster
Al calentar suavemente un anhídrido en presencia de un alcohol se obtiene un ester. Ademas, se generan como subproductos ácidos carboxílicos que pueden eliminar en medio básico. En el caso de anhídridos cíclicos se obtiene el siguiente derivado de ácido:
fig22
Formación de alcohol primario
Los anhídridos de ácido reaccionan con LiAlH4, reduciéndose totalmente hasta alcohol primario, mediante la adición de dos moles de hidruro.
fig23
Formación de amida
Los anhídridos reaccionan con amoníaco para dar una amida -CONH2 y la sal de amonio del correspondiente ácido. De la misma manera, también reaccionan con aminas primarias y secundarias para dar amidas N-sustituidas y N,N-disustituidas, respectivamente.
fig24
fig25
Formación de cetonas (acilación Friedel-Crafts)
(Véase reacciones de sustitución aromática en benceno y derivados)
Ésteres
Hidrólisis ácida o básica
La hidrólisis con agua es tan lenta que, alternativamente, se emplea calentamiento a reflujo con catálisis ácida (HCl o H2SO4 diluidos). Las reacciones son de equilibrio.
Una mejor alternativa a esta reacción se obtiene con una base diluida como catalizador (NaOH). La ventaja radica en que mediante catálisis básica la reacción no es de equilibrio y los productos son más fáciles de separar.
fig26
Formación de amida
La reacción con amoníaco convierte a los ésteres en amidas. Se puede generalizar para cualquier amina primaria 1ª o secundaria 2ª, dando lugar a amidas N-sustituidas y N,N-disustituidas, respectivamente.
fig27
Transesterificación
Los ésteres reaccionan con alcoholes para dar otros ésteres, donde el grupo alquilo procede del correspondiente alcohol. Esta reacción de interconversión de ésteres se denomina transesterificación.
fig29
Saponificación
Consiste en la hidrólisis básica de un éster para dar el correspondiente alcohol y la sal del ácido carboxílico. Se utiliza popularmente en la fabricación de jabón a partir de grasa o aceite, llevando a cabo la reacción con una base alcalina (NaOH o KOH).
fig29
Reducción a alcohol primario
Los ésteres se pueden reducir en alcoholes primarios usando reactivos de transferencia de hidruro (LiAlH4), o bien mediante hidrogenación con óxido de cobre como catalizador.
fig30
Transformación en alcohol terciario
Con reactivos de Grignard (R»MgX), los ésteres carboxílicos se transforman en alcoholes terciarios.
fig31
Condensación de Claisen
(Véase condensación de Claisen en reacciones de enolatos)
Amidas
Formación de aniones
Las amidas, prácticamente, no dan en reacciones de transferencia de acilo, ya que forman estructuras resonantes donde la carga positiva se sitúa sobre el nitrógeno en lugar del carbono carbonílico.
fig33
Formación de ácido
Las amidas pueden revertir a ácidos carboxílicos mediante hidrólisis ácida. Se rompe el enlace C-N, regenerándose el ácido carboxílico correspondiente. La reacción se lleva a cabo mediante el calentamiento de la amida usando catálisis ácida o básica.
Con la catálisis ácida el ácido carboxílico se obtiene en forma de sal de amonio, mientras que con la básica se forman iones carboxilato.
fig34
Formación de aminas (degradación de Hofmann)
Las amidas se pueden transformar en aminas mediante tratamiento con bromo en medio básico. La amina resultante descarboxila presentando un carbono menos.
fig40
Formación de aminas
A diferencia del caso anterior con LiAlH4, las amidas dan aminas conservando la misma longitud de cadena carbonada.
fig40
Nitrilos
Formación de ácido carboxílico
Los nitrilos, como los derivados de este apartado, se hidrolizan a ácidos carboxílicos.
fig40
Reducción
El uso de reactivos de transferencia de hidruro como LiAlH4, reduce a los nitrilos hasta sus correspondientes aminas.
fig40
Transformación en aldehídos
Esta reacción se lleva a cabo con reactivos de transferencia de hidruro como DIBAH (diisobutil aluminio hidruro)
fig40
Transformación en cetonas
Los nitrilos se convierten a las correspondientes cetonas con reactivos de Grignard (R’MgX), mediante un intermedio aniónico que sufre hidrólisis.
fig40
Volver a la página de Síntesis y Reactividad de Compuestos Orgánicos.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
