Written by J.A. Dobado | Last Updated on 1 año
Oxidación
Oxidación de aldehídos
Los aldehídos se oxidan más fácilmente que las cetonas. Frente a agentes oxidantes fuertes como el KMnO4 o el HNO3 en caliente, pierden el hidrógeno unido al carbonílico y dan el correspondiente ácido. Uno de los oxidantes más usados es el reactivo de Jones (CrO3 en H2SO4 acuoso), que tiene el inconveniente de necesitar condiciones ácidas, pudiendo reaccionar también con otros grupos funcionales presentes en la molécula.
Índice
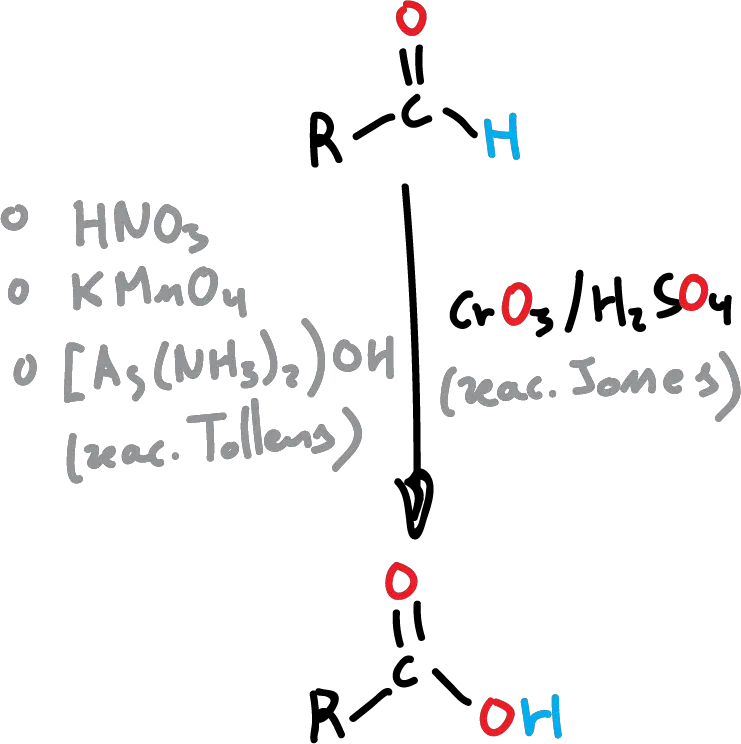
En estos casos, y para aldehídos, se utiliza comúnmente el reactivo de Tollens (Ag2O en NH3 acuoso), con la ventaja de que la reacción es quimioselectiva (sólo se oxida esta función en la molécula). Al contrario que los aldehídos, las cetonas sólo reaccionan con oxidantes fuertes rompiéndose los enlaces C-C para dar mezclas de ácidos carboxílicos.
Oxidación de Baeyer-Villiger
Las cetonas se pueden oxidar a ésteres en presencia de perácidos carboxílicos (R’CO3H). Entre los perácidos carboxílicos más usados está el ácido meta-cloroperbenzoico (MCPBA).
Las cetonas no simétricas producen mezclas de ésteres, puesto que el oxígeno se puede insertar a ambos lados del carbono carbonílico. Para predecir el compuesto mayoritario que se forma, hay que conocer la tendencia a migrar (aptitud migratoria) de los sustituyentes en la reacción de Baeyer-Villiger:
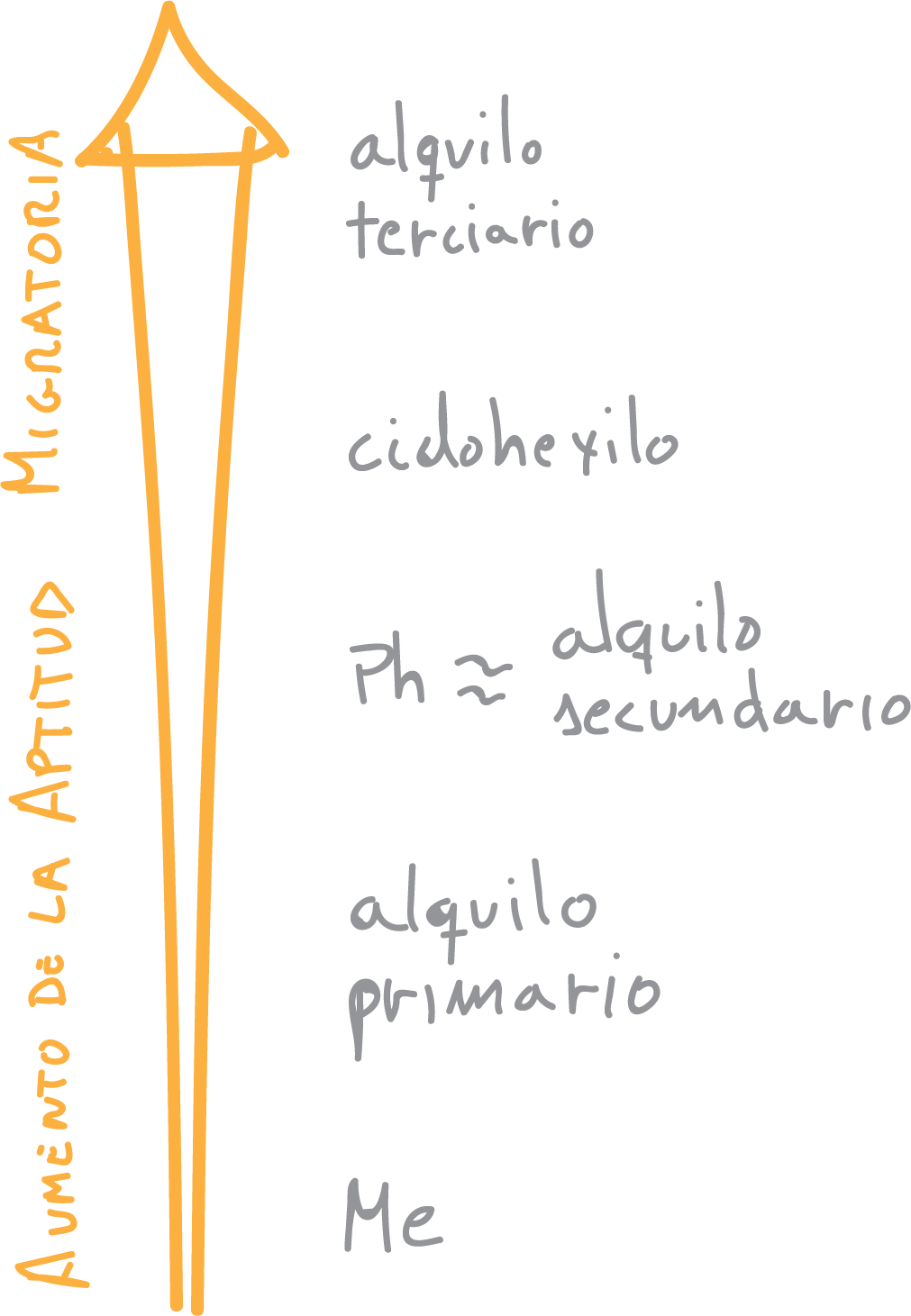 Hay que observar que algunos grupos presentan efectos de estabilización/desestabilización de carga del estado de transición, así como efectos estéricos que pueden alterar este orden de prioridad.
Hay que observar que algunos grupos presentan efectos de estabilización/desestabilización de carga del estado de transición, así como efectos estéricos que pueden alterar este orden de prioridad.
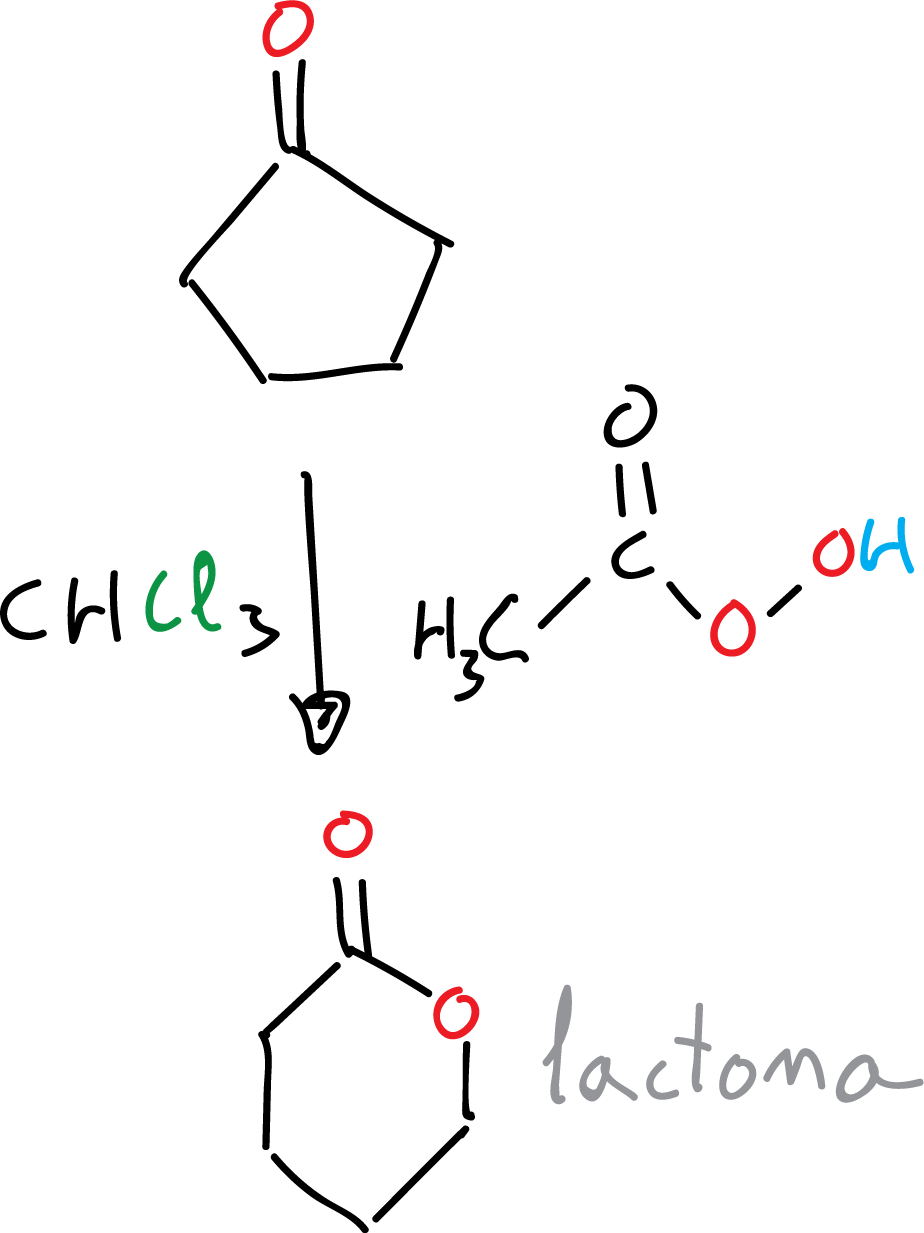
En general, la tendencia a migrar mejora al aumentar la sustitución. Por otro lado, las cetonas cíclicas dan lugar a ésteres cíclicos, llamados comúnmente lactonas:
Reducción
Reducción de Clemmensen hasta alcano
Se lleva a cabo en condiciones ácidas (HCl) con amalgama de zinc, Zn(Hg), que permiten reducir los aldehídos y cetonas hasta alcanos.
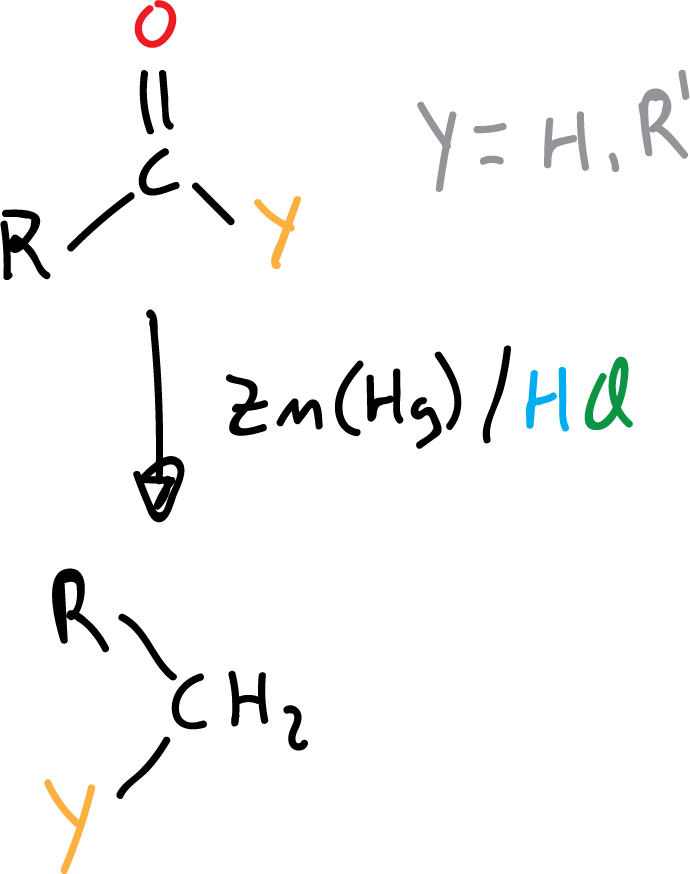
El aldehído o cetona de partida debe ser estable al medio ácido, si no es así deberemos utilizar la reducción Wolff-Kishner que transcurre en medio básico.
Reducción de Wolff-Kishner hasta alcano
La reacción de Wolff-Kishner, junto con la de Clemmensen, reducen el grupo carbonilo >C=O hasta metileno >CH2. Ambas reacciones no reducen los grupos funcionales >C=C<, -C≡C- y -CO2H, que puedan estar presentes en la molécula. La elección de una u otra reacción de reducción viene dada en función de la sensibilidad de otros grupos funcionales presentes en la molécula en condiciones ácidas o básicas.
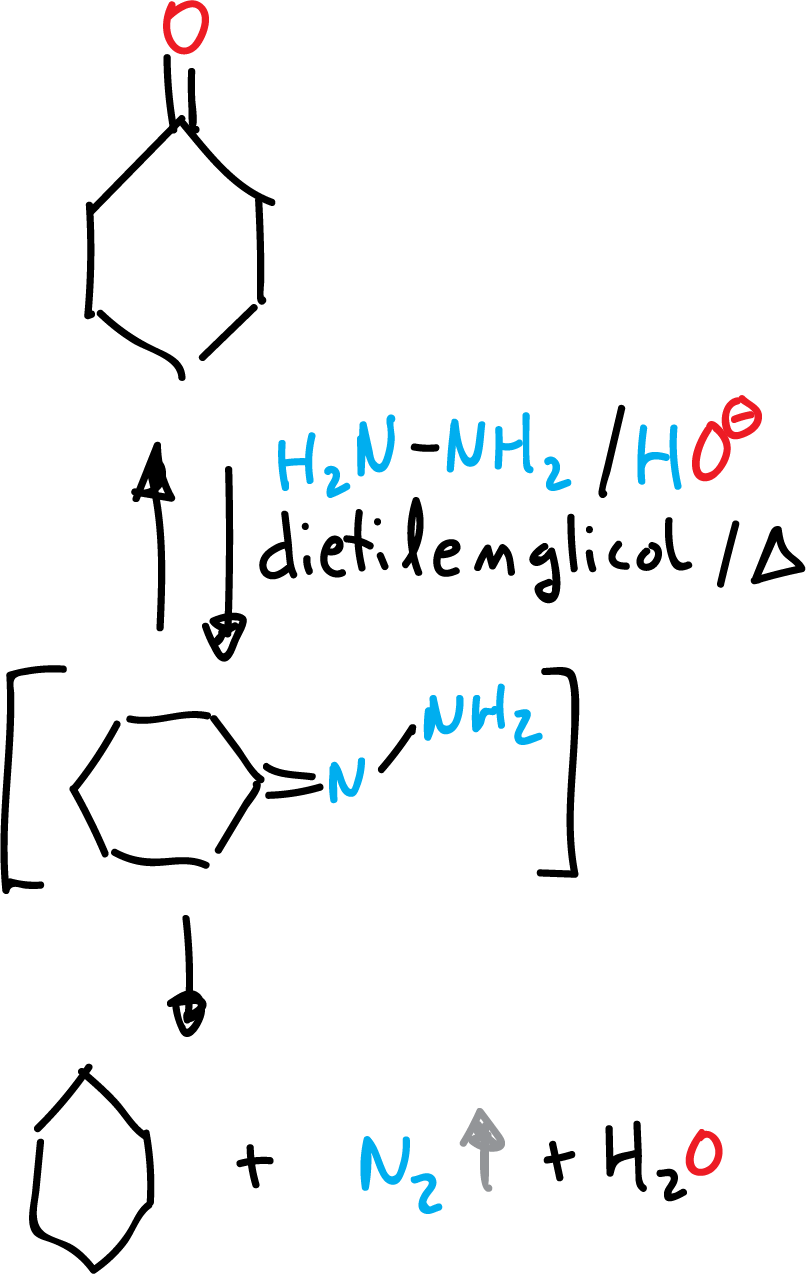
Se lleva a cabo en condiciones básicas (KOH), con exceso de hidrazina (NH2-NH2) y en disolventes de alto punto de ebullición (por ejemplo dietilenglicol presenta un punto de ebullición de 245 ºC, HOCH2-CH2-O-CH2-CH2OH).
Se forma agua que hay que eliminar para evitar que disminuya el punto de ebullición La etapa inicial es la formación de la correspondiente hidrazona, seguida de una migración de hidrógeno y descomposición de N2.
Reducción hasta alcohol con hidruros metálicos (NaBH4 o LiAlH4)
La mayoría de los aldehídos y cetonas reaccionan fácilmente con reactivos de transferencia de hidruro como son los hidruros metálicos. Los dos reactivos que se emplean comúnmente son LiAlH4 y NaBH4, como fuente de cuatro iones hidruro (H–).
Debido a su diferente estructura, los aldehídos generan alcoholes primarios y las cetonas, alcoholes secundarios. El proceso transcurre en dos pasos:
fig5
En primer lugar, el hidruro (nucleófilo) se adiciona al carbono carbonílico (electrófilo), la carga negativa se desplaza desde el carbono hasta el oxígeno formándose de un alcóxido.
Seguidamente, mediante protonación (H3O+) se forma el correspondiente alcohol. En cetonas con diferentes sustituyentes se origina en el alcohol un centro quiral y el producto es la mezcla racémica de los enantiómeros R y S.
Reducción hasta alcohol mediante hidrogenación catalítica
La hidrogenación, con catalizadores de metales de transición (Ni, Pd o Pt finamente dividido), es el método comúnmente empleado para reducir aldehídos y cetonas a escala industrial.
Los aldehídos dan lugar a alcoholes primarios y las cetonas, secundarios. Si la cetona presenta distintos sustituyentes, se origina un centro quiral y el producto será una mezcla de los enantiómeros R y S.
fig6
Adición
Adición de agua (formación de diol geminal)
Los aldehídos y cetonas reaccionan con agua para dar dioles 1,1-geminales denominados hidratos. En general, estos hidratos no son estables, ya que la reacción es reversible formándose los reactivos de partida. Esta reacción transcurre mediante catálisis ácida o básica.
fig7
Adición de alcohol (formación de acetal)
Los aldehídos y cetonas reaccionan con 2 moles de alcohol para dar diéteres 1,1-geminales, comúnmente conocidos como acetales. Se usa indistintamente el término acetal para describir los derivados de aldehídos (acetales) y los de cetonas (cetales).
Se suele realizar en las siguientes condiciones: exceso de alcohol (ROH) disolvente (benceno) y ácido p-toluensulfónico (p-Ts-OH), como catalizador. Tienen utilidad como grupo protector y además, se pueden usar 1,2- o 1,3-dioles para obtener acetales cíclicos. Estos pueden convertirse de nuevo en aldehídos y cetonas por hidrólisis en medio ácido o bien por yodo en metanol.
fig8
fig9
Adición de tiol (formación de tiocetal)
Los tiocetales son los análogos a los acetales, pero con azufre. Se obtienen de la misma manera que los acetales, pero haciendo reaccionar el compuesto carbonílico en lugar de con alcohol con tiol. El compuesto carbonílico se regenera por tratamiento con sales mercúricas.
fig10
Adición de cianuro de hidrógeno (formación de cianohidrina)
El ácido cianhídrico (HCN) es un ácido débil (pero muy tóxico), que se hidroliza fácilmente dando el anión cianuro (base conjugada fuerte y buen nucleófilo).
fig11
Dicho ácido se genera in situ a partir de NaCN o KCN con HCl. El anión cianuro ataca al carbonilo dando las cianohidrinas.
fig12
Las cetonas están más impedidas estéricamente que los aldehídos y el equilibrio se desplaza hacia los reactivos (bajo rendimiento). Es una reacción que puede tener interés sintético porque el grupo ciano puede convertirse posteriormente en otros grupos funcionales útiles como -CO2H o -CH2NH2.
fig13
Adición de iluro (reacción de Wittig)
Es una reacción muy usada en síntesis para formar alquenos a partir de un compuesto carbonílico con un iluro (carbanión estabilizado por fósforo). Los iluros son moléculas neutras, pero con una separación de carga.
Se obtienen (en 2 pasos) por reacción de una trialquil (o aril) fosfina con un haloalcano y posterior reacción ácido-base de la sal de fosfonio con una base fuerte como un alquil litio que genera el iluro.
fig14
El iluro se puede describir mediante la contribución de dos estructuras resonantes (una con un enlace doble P=C y otra con separación de cargas), estando esta última favorecida (por lo que el carbono resulta nucleófilo frente al carbonilo).
fig15
En la reacción de Wittig, al reaccionar el iluro de fósforo con el grupo carbonilo, se forma una estructura denominada betaína, que posteriormente cicla a un anillo de cuatro miembros (oxafosfetano).
Dicho anillo se rompe para generar un enlace C=C (alqueno) y otro P=O, siendo la estabilidad de este último la fuerza impulsora de la reacción. Además, permite introducir el doble enlace sin los problemas de las reacciones de eliminación.
fig16
Adición de compuestos organometálicos
Son reacciones de formación de enlaces C-C muy útiles en síntesis orgánica. Se usan principalmente reactivos de Grignard (R-MgX) y organolíticos (RLi).
Estos reactivos actúan como nucleófilos y se adicionan al carbono del grupo carbonílico formando un alcóxido, que por protonación dan el correspondiente alcohol. Se utilizan éteres (Et2O o THF) como disolventes apróticos.
Los sustituyentes del aldehído o cetona condicionan el tipo de alcohol obtenido (el formaldehído da alcoholes primarios, los aldehídos dan alcoholes secundarios, y las cetonas alcoholes terciarios).
La reacción finaliza con una etapa donde el medio ácido (H3O+) protona la sal del alcóxido metálico.
fig17
Adición de amina y compuestos relacionados
El amoníaco (NH3) y las aminas primarias (R”-NH2) reaccionan con el grupo carbonilo para dar carbinolaminas, que posteriormente se deshidratan obteniéndose iminas (bases de Schiff).
Estas reacciones siguen siendo adiciones nucleófilas al carbonilo, aunque normalmente se engloban dentro de un gran grupo llamado condensaciones (dos o más moléculas se unen, desprendiendo agua u otra molécula más pequeña).
fig18
Las aminas secundarias (R”R-NH) también reaccionan con aldehídos y cetonas para dar carbinolaminas. A diferencia de las aminas primarias, al no tener disponible el protón del nitrógeno, en el paso posterior de deshidratación se forma una enamina(C=C) en lugar de una imina (C=N). Las enaminas son reactivos útiles en síntesis.
También condensan los aldehídos y cetonas con derivados de aminas de fórmula general Z-NH2 como hidroxilaminas, hidrazinas, fenilhidrazina, semicarbazida, dando oximas, hidrazonas, fenilhidrazonas y semicarbazonas, respectivamente. Estas reacciones se usan para la identificación de aldehídos y cetonas.
Reacciones en el carbono-α
Halogenación en el carbono-α
La halogenación de compuestos carbonílicos transcurre mediante halógeno molecular en medio básico y da como producto la sustitución de uno o varios hidrógenos-α.
Normalmente, se obtienen los productos de la halogenación múltiple debido a que los compuestos clorados son más reactivos (el halógeno retira carga y estabiliza el anión enolato).
En las halogenaciones, la base no actúa como catalizador, por lo que aquí se usa estequiométricamente. Dependiendo de los sustituyentes del aldehído o cetona se pueden formar racémicos.
fig19
Reacción del haloformo
Cuando una metilcetona reacciona con halógeno molecular en presencia de una base, se forma haloformo (HCX3) como uno de los productos de la reacción.
fig20
En medio ácido la reacción se produce de forma controlada, dando sólo el producto de la monohalogenación.
fig21
Al contrario que las cetonas, los aldehídos no dan buenos rendimientos en α-halogenación debido a que se oxidan con facilidad a ácidos carboxílicos.
fig22
Otras reacciones
Aminación reductiva
Conlleva la transformación de un aldehído o cetona en una amina. Se realiza por tratamiento del grupo carbonilo con una amina primaria que genera una imina, la cual se reduce hasta amina.
fig23
Reacción de Cannizzaro
La reacción de Cannizzaro consiste en la autooxidación y reducción simultanea del aldehído, inducida en medio básico, de un aldehído sin hidrógenos en posición α, produciendo un alcohol y un ácido carboxílico (en forma de la correspondiente sal).

