Written by José | Last Updated on 2 meses
Formación de enolatos
Una de las características principales del grupo carbonilo es que los hidrógenos adyacentes al carbono carbonílico tienen carácter ácido, pudiendo reaccionar con determinadas bases. Si esto ocurre, el aldehído o la cetona se convierte en un anión enolato (nucleófilo), susceptible de reaccionar con una gran variedad de electrófilos.
Índice
Además, como el ión enolato es el resultado de dos estructuras resonantes, con la carga negativa sobre el oxígeno o carbono, la reactividad con electrófilos puede deberse a cada uno de éstos, dependiendo de las condiciones de reacción y de la naturaleza del enolato y nucleófilo (C- y O-alquilación).
fig1
Además, en medio ácido, en lugar de formarse el ión enolato se obtiene un enol, cuyo carbono con carga negativa es susceptible de atacar a un carbonilo protonado.
fig2
Condensación aldólica
Uno de los electrófilos que puede reaccionar con el anión enolato es el propio grupo carbonilo de los reactivos, ya que tiene una carga parcial positiva. Con esta reacción se obtiene un compuesto llamado genéricamente aldol (β-hidroxicarbonílico).
La condensación aldólica consiste en esta reacción seguida de un paso irreversible de deshidratación del aldol que genera un compuesto carbonílico α,β-insaturado.
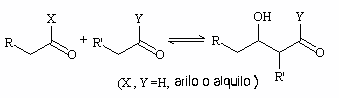
Se puede dar en medio ácido (mediante enol) o básico (a través de un ión enolato).
fig3
El paso de deshidratación puede ocurrir en medio ácido o básico, la diferencia es que en medio ácido transcurre de manera concertada en una sola etapa (debido a que el H2O es mejor grupo saliente que el –OH).
fig4
En medio básico transcurre en dos etapas (pérdida del protón y eliminación de HO⊖).
fig5
Condensación aldólica cruzada
La condensación aldólica con acetona que hemos visto da sólo un producto (α,β-insaturado) de reacción, porque sólo se formaba un enolato.
Esto se puede complicar si ponemos a reaccionar dos compuestos carbonílicos diferentes que generen cada uno un enolato distinto y que reaccionen, a su vez, con los dos reactivos.
De esta manera se obtendrán cuatro aldoles distintos, los cuales, a su vez pueden dar diferentes compuestos carbonílicos α,β-insaturados con el paso posterior de deshidratación.
fig6
Desde el punto de vista sintético, no es muy útil porque se producen mezclas de productos.
Condensación Claisen-Schmidt
El inconveniente de la mezcla de productos que se obtienen en las reacciones aldólicas cruzadas, puede resolverse si se diseña esta reacción para que sólo uno de los reactivos forme el anión enolato y el otro reactivo sea más electrófilo que el que genera el enolato.
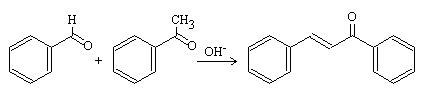
Este es el caso de la condensación Claisen-Schmidt:
fig7
El benzaldehído es muy utilizado para este tipo de reacciones puesto que no tiene hidrógenos-α y por consiguiente, no puede generar iones enolatos.
Además, el grupo carbonilo del benzaldehído es mucho más electrófilo que el del acetaldehído debido a que está unido a un anillo aromático que retira carga. Se cumplen los dos requisitos y se obtiene un único compuesto α,β-insaturado (cinamaldehído).
Condensación aldólica intramolecular
Es una reacción aldólica que transcurre entre dos grupos carbonilos presentes en la misma molécula para dar un compuesto cíclico. Están favorecidos los anillos de 5 y 6 miembros sobre otro tipo de tamaño de anillo.
fig8
Condensación de Claisen
Es una condensación donde los dos reactivos son ésteres, dando lugar a un β-cetoéster. Como los hidrógenos-α del éster son menos ácidos (pKa = 23-25) que los de un aldehído o cetona (pKa = 19-20), se necesita una base más fuerte para formar el enolato (alcóxidos).
fig9
El éster de enolato reacciona con otra molécula de éster para dar un β-cetoéster como se indica.
fig10
Cuando el éster posee un solo hidrógeno-α no se observa producto de condensación de Claisen. Al igual que en el caso de la condensación aldólica cruzada, la condensación de Claisen puede tener lugar entre dos ésteres distintos, siendo selectiva cuando uno de ellos carece de hidrógenos-α; las cetonas también pueden participar en la condensación de Claisen:
esquema1
Ciclación de Dieckmann
Es una condensación de Claisen intramolecular con la que se obtiene un β-cetoéster, con la cetona cíclica y el grupo éster como cadena lateral del anillo.
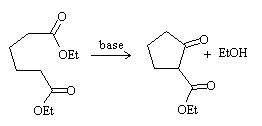
Al igual que en el caso de la condensación aldólica intramolecular, se favorece la formación de anillos de 5 y 6 miembros.
fig11
Síntesis acetoacética y malónica
Una vez considerada la preparación de compuestos β-cetocarbonílicos, veamos dos ejemplos de su utilidad sintética. Como los hidrógenos-α de los compuestos β-cetocarbonílicos son más ácidos (pKa = 9-13) que los de los aldehídos, cetonas y ésteres, una base como los alcóxidos permite capturar un protón de dicha posición dando lugar a la formación de un enolato de modo casi cuantitativo. Dicho enolato (que es nucleófilo) puede alquilarse con un haloalcano para dar derivados sustituidos.
esquema2
La hidrólisis de un β-cetoéster, proporciona 3-cetoácidos los cuales descarboxilan con facilidad, en condiciones suaves, dando cetonas. La hidrólisis de β-diésteres, de igual manera, también descarboxila dando ácidos carboxílicos:
esquema2
La combinación de la alquilación, hidrólisis y descarboxilación que acabamos de describir permiten las dos estrategias conocidas como:
Síntesis acetoacética (cuando partimos de un β-cetoéster) la secuencia nos conduce a metilcetonas sustituidas y la síntesis malónica (cuando partimos de un β-diéster) la secuencia produce ácidos carboxílicos sustituidos.
esquema3
Adición de Michael
Es una reacción de adición 1,4- donde un enolato se adiciona a grupos carbonilos conjugados para dar un compuesto carbonílico α,β-insaturado.
fig12
Reacción de formación de anillos de Robinson[2]
Es un caso particular de adición de Michael, seguida de una condensación aldólica intramolecular, para dar un compuesto cíclico.
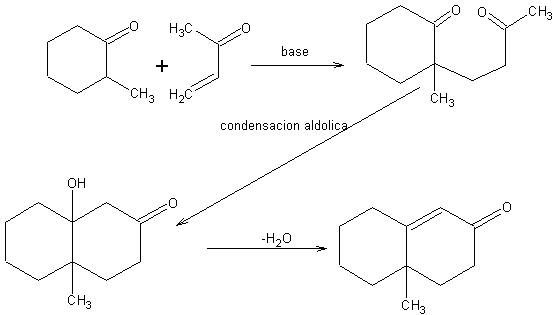
Cuando una adición de Michael se produce en condiciones muy ácidas o muy básicas, no se detiene en el producto 1,5-dicarbonílico, sino que continúa para dar una condensación aldólica intramolecular entre los dos grupos carbonilo.
fig13
Alquilación
El carbono de un haluro de alquilo tiene naturaleza electrófila y puede reaccionar con el enolato para generar productos de alquilación (formación de enlaces C-C). Estas reacciones tienen como inconveniente que no, se pueden usar ni HO⊖ ni RO⊖ como bases, ya que no enolizan completamente a las cetonas y se produciría la mezcla de productos comentada anteriormente.
Además, al ser nucleófilas reaccionarían con los haluros de alquilo. En consecuencia, se usan bases como LDA, que son fuertes (convierten completamente a las cetonas en enolatos) y al ser muy voluminosas, son muy poco nucleófilas.
fig14
Video de Reacciones de Enoles y Enolatos
Referencias y notas
[2] a) E.C. du Feu, F. J. McQuillin, R. Robinson, J. Chem. Soc. 1937, 53. b) A.L. Wilds, C. H. Shunk, J. Am. Chem. Soc. 65, 469 (1943).
Volver a la página de Síntesis y Reactividad de Compuestos Orgánicos.

