Written by J.A. Dobado | Last Updated on 1 año
Halogenación radicalaria
La halogenación de alcanos consiste en la sustitución de uno o más hidrógenos de un hidrocarburo saturado por un átomo o átomos de halógeno.
Índice
Es una reacción radicalaria con rotura homolítica del halógeno iniciada mediante radiación adecuada (hν) o por la presencia de iniciadores de radicales (por ejemplo, peróxidos -O-O-).
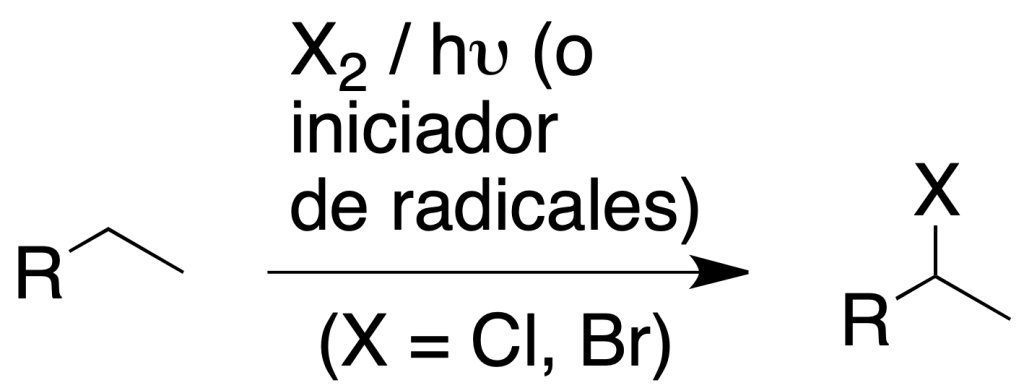
Sólo tienen interés sintético la cloración y la bromación, siendo ambas reacciones exotérmicas. La fluoración es incontrolable (proceso explosivo), mientras que la yodación presenta una reactividad muy baja.
Al ser la halogenación una reacción radicalaria, es muy difícil de controlar y suele conducir a mezclas de productos con el halógeno en las distintas posiciones del alcano. La halogenación radicalaria de alcanos y cicloalcanos depende de:
- La naturaleza del hidrocarburo: la reactividad de los diferentes tipos de hidrógenos de un alcano no es la misma. La rotura homolítica de un enlace C-H puede producir radicales primarios secundarios o terciarios que tienen distinta estabilidad, por lo que no se forman con la misma facilidad. El orden de estabilidad de los diferentes tipos de radicales carbonados es el siguiente: terciarios > secundarios > primarios.
- El número de hidrógenos de una misma clase (primario, secundario y terciario): también condiciona el resultado final (factor estadístico).
- El halógeno empleado: la reacción con cloro no es muy selectiva. Por el contrario, la bromación presenta una alta selectividad.
Esta reacción resulta especialmente útil desde el punto de vista sintético cuando todos los hidrógenos de la molécula son equivalentes (metano, ciclohexano, neopentano, etc.), porque da un solo producto de reacción (sin mezclas).
A pesar de ello, es posible estimar o predecir la proporción de los distintos productos de monohalogenación, considerando las reactividades relativas aproximadas de los distintos tipos de radicales:
Para el cloro: terciarios /secundarios / primarios es 5,1/3,6/1
Para el bromo: terciarios /secundarios / primarios es 990/99/1
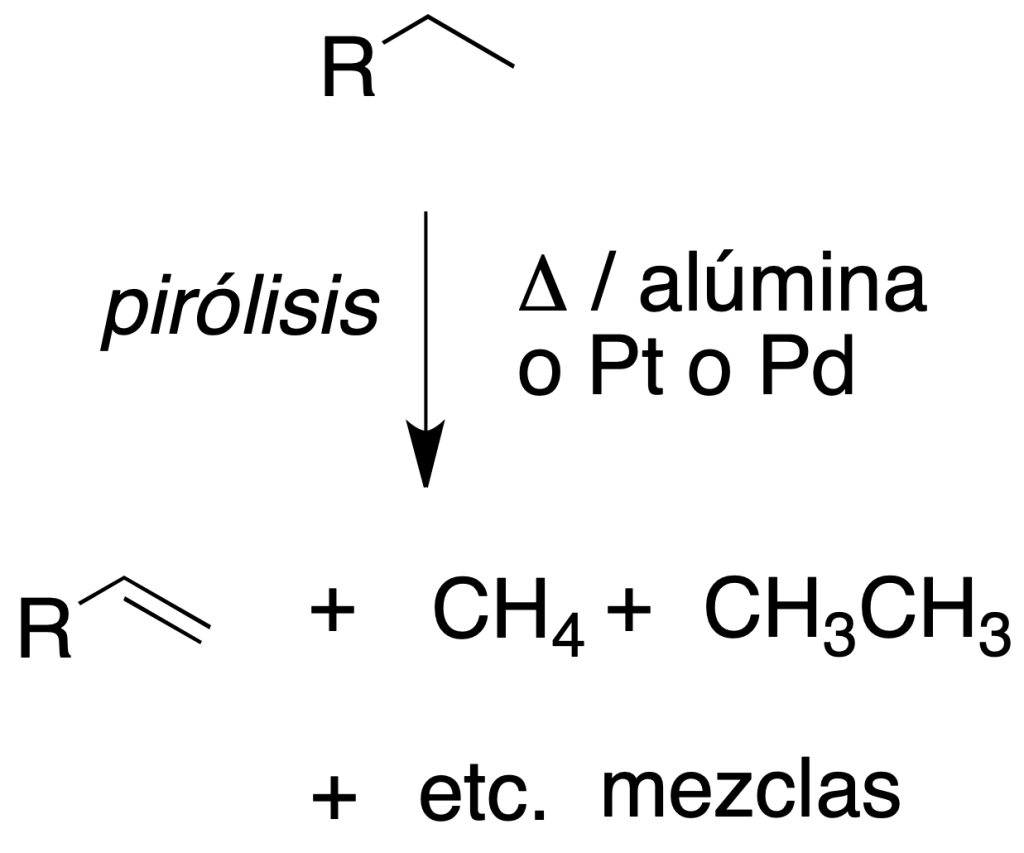
Pirólisis
La pirólisis o craqueo consiste en la obtención de hidrocarburos de menor masa molecular a partir de otros de mayor tamaño (normalmente, por destilado del petróleo).
La reacción se realiza calentando los hidrocarburos en ausencia de oxígeno (pirólisis térmica) o bien mediante el calentamiento sobre catalizadores de sílice o alúmina (pirólisis catalítica).
Este último procedimiento es el más empleado en la actualidad, dado que requiere una menor temperatura.
Los alcanos se fragmentan por rotura de enlaces C-C y C-H de forma aleatoria, y se producen radicales libres con un menor número de carbonos que los hidrocarburos de partida.
Se suelen obtener alcanos más pequeños (con mantenimiento o no del esqueleto carbonado de partida) y alquenos.
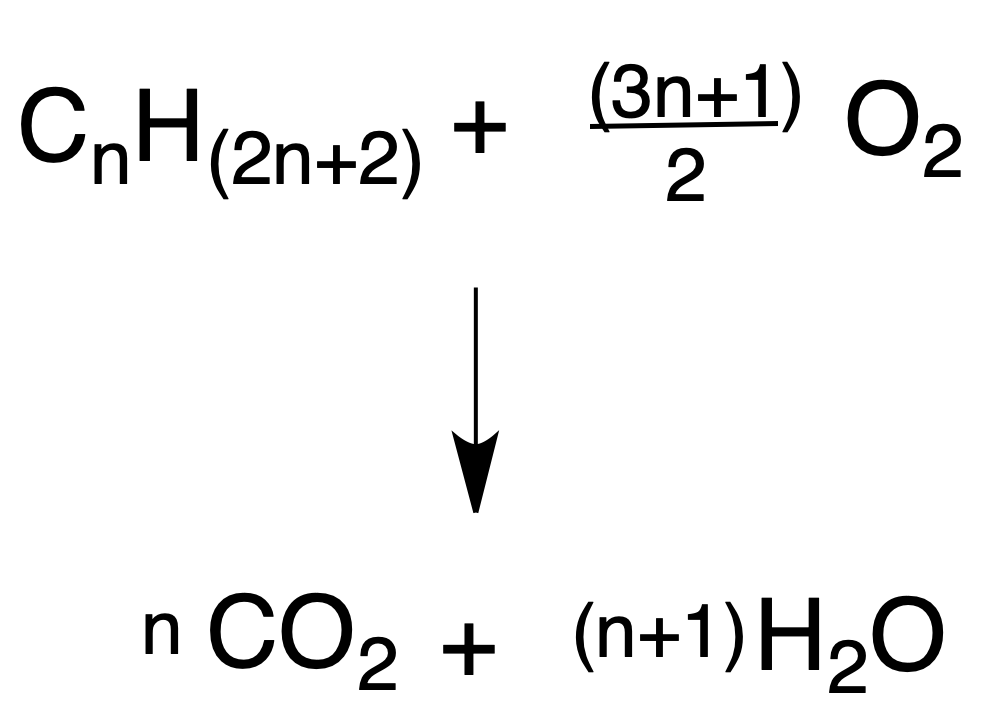
Combustión
El interés de esta transformación radica en la gran cantidad de energía que se libera, y ésta es la base de su empleo como combustibles.
Un aspecto importante de la reacción es la estequiometría, ya que si no hay suficiente oxígeno, se genera monóxido de carbono (CO), altamente tóxico. Por ejemplo:
CH3CH2CH3 + 4O2 → CO2 + 2CO + 4H2O
Se pueden formar productos intermedios de la oxidación (aldehídos y ácidos carboxílicos principalmente) cuando la cantidad de oxígeno es baja y/o la temperatura de reacción no es lo suficientemente elevada.
Ésta es una de las causas principales de contaminación que generan los motores de explosión en las ciudades.
Volver a la página de Síntesis y Reactividad de Compuestos Orgánicos.
