Índice
¿Qué son los dienos?
Los dienos son compuestos que poseen dos dobles enlaces (>C=C<).
Según la disposición relativa de dichos dobles enlaces poseen unas características distintas. Así podemos tener:
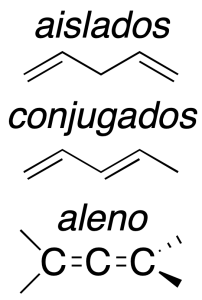
Dienos aislados
Los dos doblen enlaces se encuentran separados, como mínimo por un átomo de carbono. Se comportan como alquenos convencionales, por lo que su reactividad es similar a la estudiada anteriormente.
Dienos conjugados
Los dobles enlaces se unen a través de un enlace sencillo. Esta disposición le confiere al sistema una estabilidad extra y unas propiedades químicas particulares, fruto de la influencia mutua.
Dienos acumulados
Se denominan alenos (también cumulenos) y tienen un carbono en común con hibridación sp. Su reactividad es más parecida a alquinos que a olefinas, debido al tipo de hibridación del carbono común a los dos doble enlaces. Son los más inestables del grupo.
Adición electrofílica a dienos conjugados
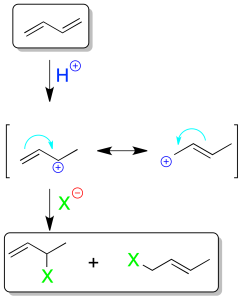
En dienos conjugados la adición electrofílica, por ejemplo, de 1 mol de XH presenta unas características especiales. El resultado de la reacción depende de la temperatura. Tal como se indica en el esquema, la causa de dicho comportamiento es la resonancia del catión propenilo (alilo) producido tras la adición del electrófilo.
A bajas temperaturas es mayoritario el producto de adición 1,2 (se adiciona el H⊕ sobre el carbono menos sustituido y el nucleófilo X⊖ sobre el más sustituido según la regla de Markovnikov).
La formación de este compuesto es más rápida (control cinético) que la del producto de adición 1,4. A mayor temperatura aumenta la proporción del producto de adición 1,4, y se obtiene el producto termodinámicamente más estable (control termodinámico).
En cuanto que las velocidades con las que se dan ambos procesos no presentan grandes diferencias, normalmente se obtienen mezclas de ambos productos.
De igual manera la bromación o cloración de 1,3-dienos puede dar una mezcla del producto de adición 1,2 y 1,4, como en la reacción anterior. Igualmente se aplica, en este caso, el concepto de control cinético y control termodinámico.
Reacción de Diels-Alder
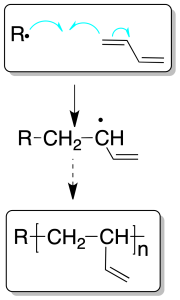
Polimerización de dienos
Los dienos pueden dar polímeros por procesos de polimerización en los que interviene un solo doble enlace, como si de un alqueno convencional se tratara o bien por la intervención de ambos dobles enlaces.
En el primer caso se denominan procesos de propagación 1,2 y dan lugar a cadenas ramificadas.
En el segundo caso, se le llama de propagación 1,4, y daría lugar a cadenas lineales.

Si bien el procedimiento de polimerización, como en el caso de los alquenos sencillos, puede ser catiónico, radicalario o aniónico, a escala industrial se emplea el procedimiento mediante un mecanismo radicalario.
Volver a la página de Síntesis y Reactividad de Compuestos Orgánicos.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.