Written by José | Last Updated on 3 meses
Ir a la página con el listado de problemas.
Reacciones de Sustitución Aromática en Benceno y Derivados – soluciones a los problemas
Solución 1:
Suponiendo que todas las estructuras que se muestran son planas, cíclicas y conjugadas, la siguiente condición a cumplir para que sean aromáticas es la regla de Hückel (4n+2) es decir deben presentar 2,6,10,14,18, etc.. electrones π en el sistema conjugado para que sean aromáticos y (4n) 4, 8, 12, 16, etc.. para ser antiaromáticos. Por tanto, las estructuras II (catión cicloheptatrienilo), III(azuleno), IV (catión ciclopropenilo), VI (trans-15,16-dihidropireno), VII ([18]anuleno), VIII (antraceno), IX (dianión del ciclooctatetraeno), X (dicatión del [16]anuleno), XI (piridina) y XII (pirrol) serán aromáticos. Serán antiaromáticas, las estructuras I ([16]anuleno) y V (S-indaceno).
Solución 2:
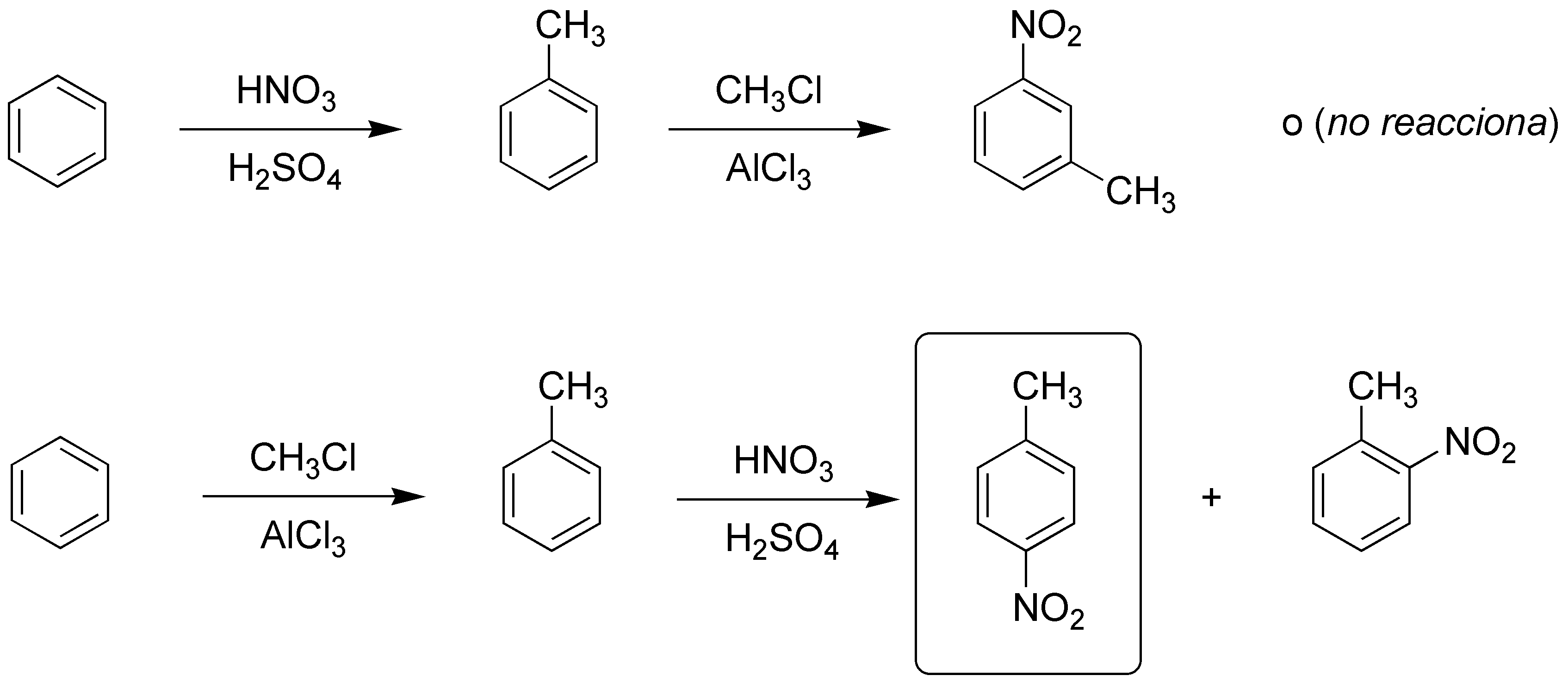
a) Se prepara mediante una alquilación Friedel-Crafts convencional. Además, no hay posibilidad de transposiciones debido a que el cloruro de etilo de partida sólo genera un carbocatión.
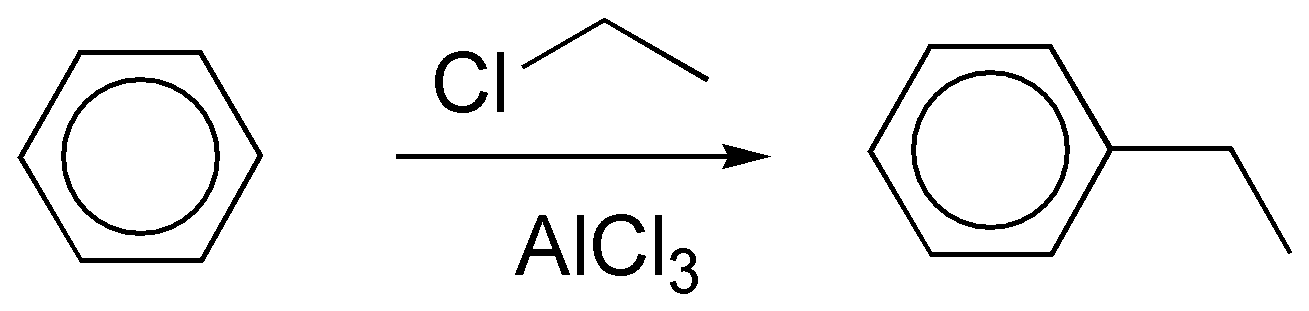
b) Se puede preparar a partir de propeno con catálisis ácida para generar un carbocatión secundario, que actúa como nucleófilo o bien a partir del haluro de alquilo secundario.
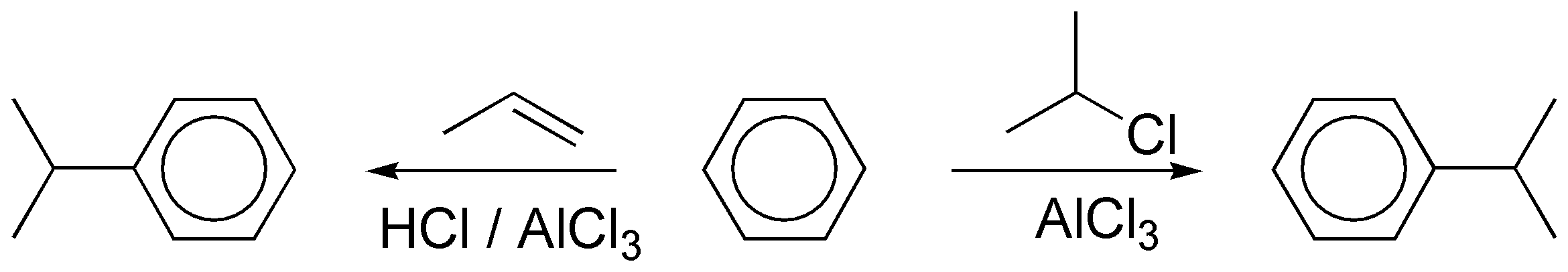
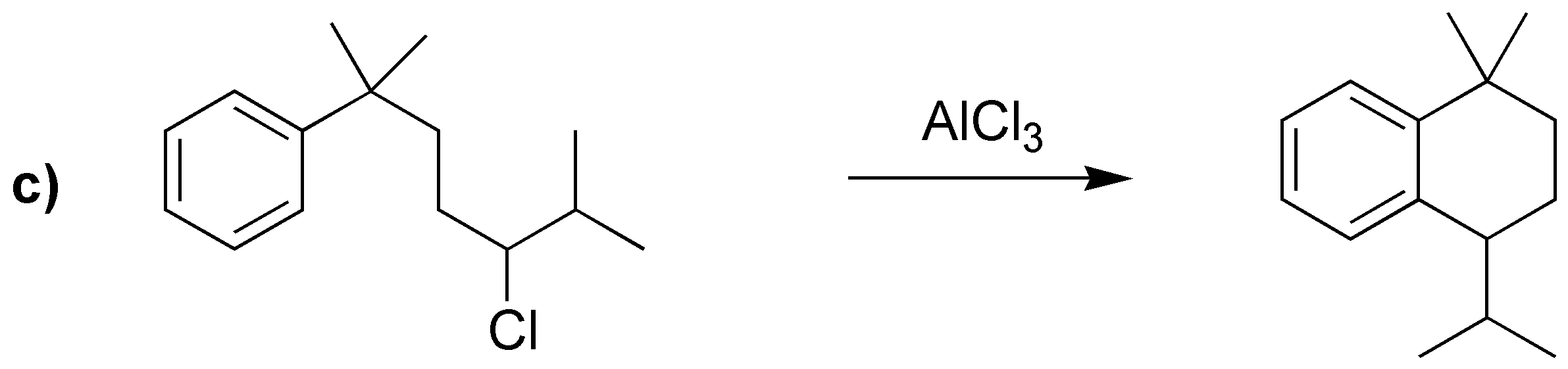
c) La alquilación de un areno con un haluro de alquilo primario con más de dos átomos de carbono en presencia de un catalizador no conduce a la formación del producto esperado, ya que se producen mezclas, como consecuencia de la transposición del carbocatión primario intermedio que se postula en la reacción. En este caso hay que proceder a la acilación con un cloruro de acilo cuyo esqueleto carbonado coincida con el del radical que se va a introducir, para dar una cetona, que posteriormente se puede reducir.
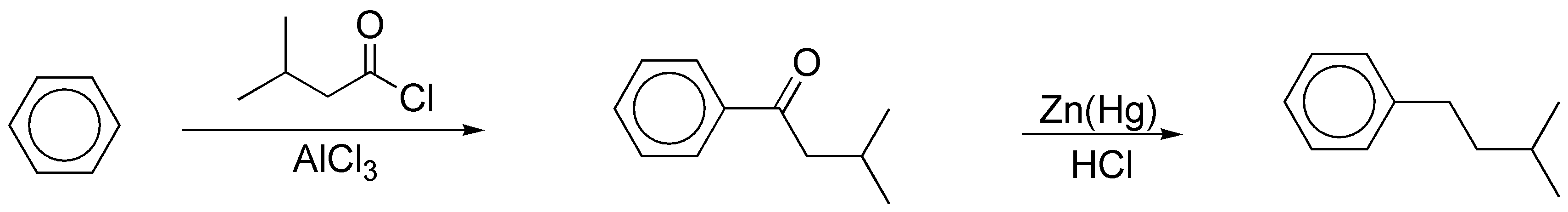
La reducción que se describe es la aplicación de la reacción de Clemmensen, aunque también podría haberse usado la de Wolff-Kishner (NH2NH2 / KOH / etilénglicol), ya que en el sustrato no hay grupos incompatibles con el medio ácido de la reacción de Clemmensen ni con la base empleada en la reacción de Wolff-Kishner.
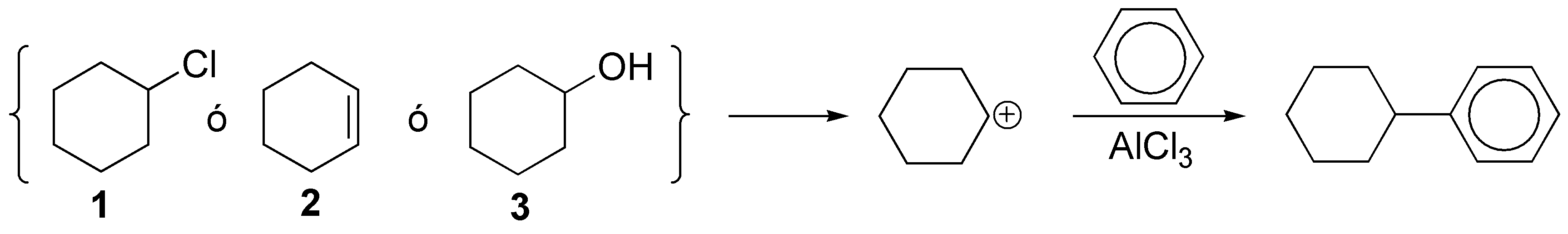
d) El producto propuesto se puede obtener por tres procedimientos:
- A partir de cloruro de ciclohexilo con una ácido de Lewis.
- A partir de ciclohexeno con catálisis de un ácido mineral.
- A partir de ciclohexanol con catálisis de un ácido mineral.
En los tres casos se forma un carbocatión secundario que actúa como electrófilo.
Solución 3:
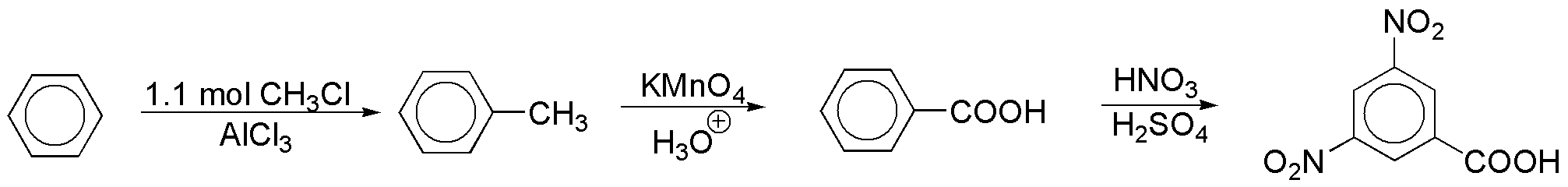
a) Por alquilación Friedel-Crafts con bromuro de bencilo se puede preparar el compuesto según el esquema:
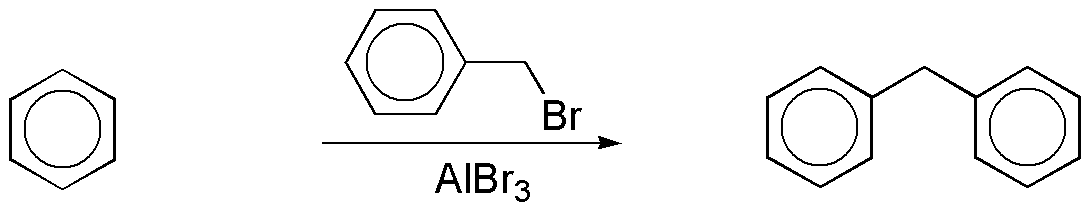
A su vez, el bromuro de bencilo se puede obtener a partir de benceno en dos pasos:
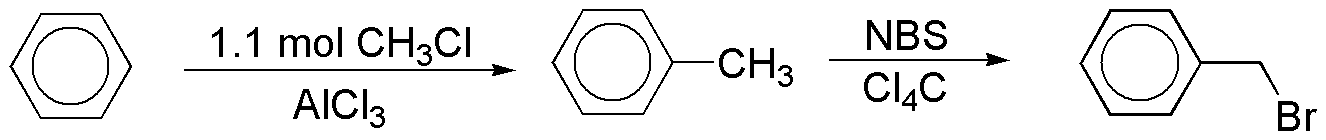
Obsérvese que se ha usado un ligero exceso (1.1 mol) para evitar la formación de productos polisustituidos, ya que el anillo aromático del tolueno es más rico en electrones que el propio benceno, dado el carácter activante del grupo metilo.
b) La síntesis del compuesto bicíclico que se propone, se puede realizar de forma directa mediante una acilación Friedel-Craftssobre el benceno.
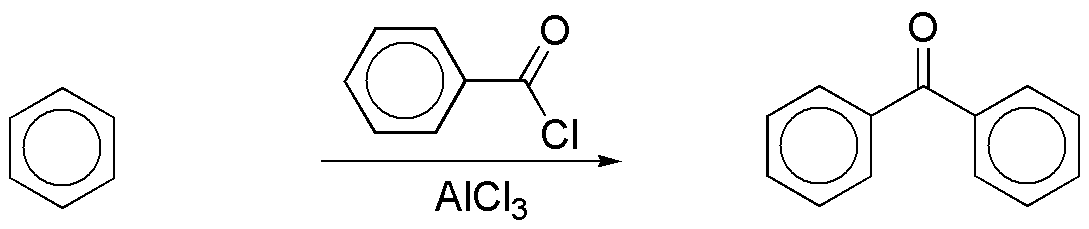
Para la obtención del cloruro de benzoílo, utilizado en la reacción se puede seguir la siguiente secuencia de reacciones:
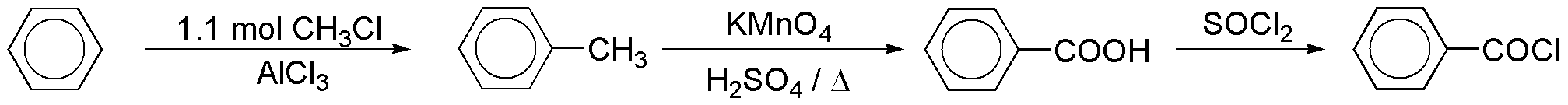
El benceno se transforma en tolueno, y éste en ácido benzoíco por oxidación con permanganato en medio ácido. El cloruro de benzoílo se prepara por reacción del ácido con cloruro de tionilo.
c) En el bifenilo se establece una unión C-C directa entre dos anillos de benceno. Una posible síntesis del bifenilo se puede realizar a partir de bromobenceno.
El bromobenceno se convierte en el magnesiano que reacciona con otra molécula de bromobenceno, para dar el bifenilo.
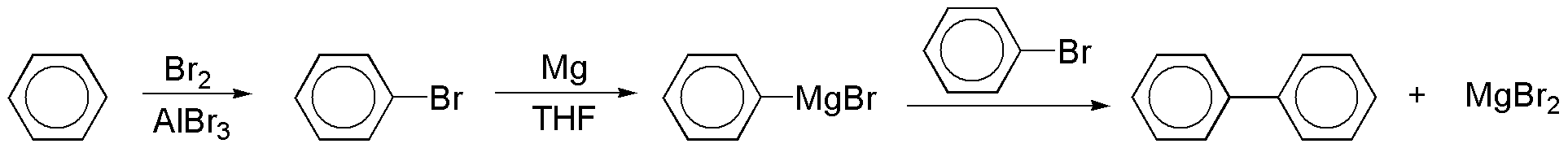
Solución 4:
La velocidad de reacción de sustitución aromática electrofílica depende de si el grupo aumenta o disminuye la densidad electrónica sobre el anillo aromático. Se toma como referencia la velocidad de reacción del benceno. Podemos clasificar los compuestos en:
I: activante moderado, II: desactivante débil, III: desactivante fuerte, IV: activante moderado, V: desactivante débil, VI: desactivante fuerte, VII: desactivante moderado y VIII: desactivante fuerte
y el orden de velocidad de reacción será el que se indica en la figura:
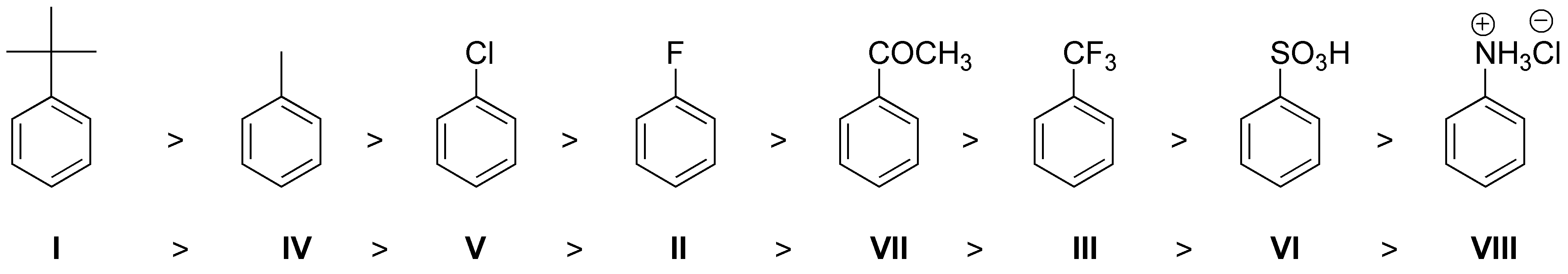
La velocidad de reacción de I debe ser mayor que la de IV, dado que el grupo terc-butilo es más rico en electrones que el metilo y presenta mayor efecto inductivo +I. Además, el flúor al ser más electronegativo, es más desactivante que el cloro, por eso V tiene mayor velocidad de reacción que II.
Solución 5:
La anilina no se puede nitrar directamente, ya que el ácido nítrico oxida al grupo amino, por lo que es necesario proteger el grupo amino formando un derivado, que posteriormente permita regenerar el -NH2 con relativa facilidad. Para ello, se procede a tratar la anilina con anhídrido acético para obtener la acetanilida, la cual se nitra en condiciones convencionales. Posteriormente, se lleva a cabo la eliminación del grupo protector mediante una hidrólisis ácida, con lo que se obtiene el producto deseado.

Observa que en la reacción de nitración se obtiene el derivado monosustituido en para- como mayoritario.
Este resultado se justifica por dos razones:
- El grupo acetamido amortigua el carácter activante del -NH2, por lo que se minimiza la polisustitución.
- Apenas se obtiene una cantidad significativa del producto en orto-, ya que esta posición desde el punto de vista estérico está menos favorecida por el volumen del grupo acetamido.
Solución 6:
a) Para introducir en el anillo de benceno un grupo nitro y un átomo de bromo deberemos realizar dos reacciones consecutivas de sustitución aromática electrofílica. La secuencia de reacciones es clave, ya que el grupo nitro es meta- dirigente y el bromo orto- y para- dirigente. Si se procede en primer lugar a la nitración el segundo sustituyente entrará inevitablemente en meta-, mientras que si se produce la halogenación. Las dos opciones posibles son:
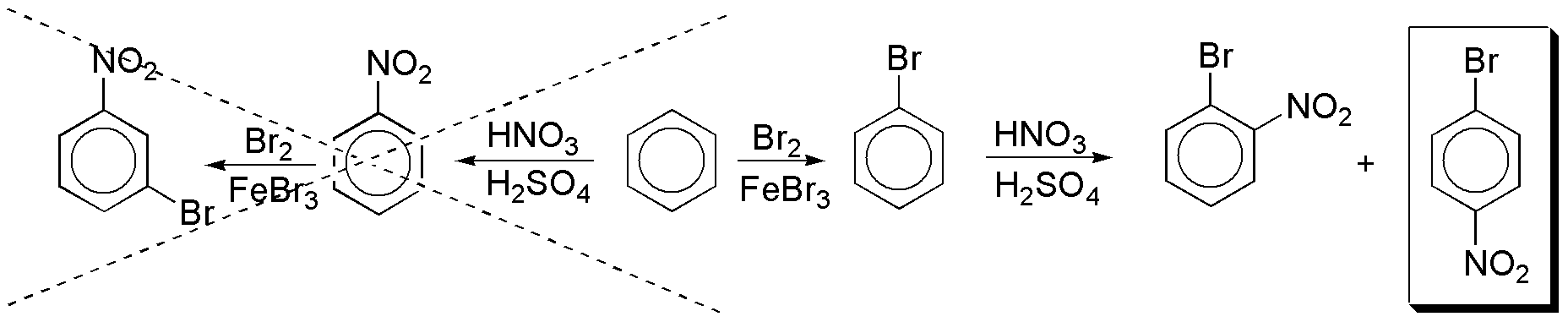
En la secuencia de reacciones correcta, el producto deseado se obtiene acompañado del isómero orto-, por lo que si se quiere obtener puro, habrá que proceder a separarlos.
b) Todos los grupos son meta-dirigentes. Sin embargo el grupo COOH es menos desactivante que el grupo nitro, por lo que debería introducirse antes para facilitar en lo posible, la formación del producto deseado. Como es sabido el grupo COOH, se puede obtener a partir de un alquilbenceno por oxidación con KMnO4 o K2Cr2O7 en medio ácido.
c) La reacción de bromación del fenol conduce a la formación de productos de polisustitución, debido a que el grupo OH es fuertemente activante.
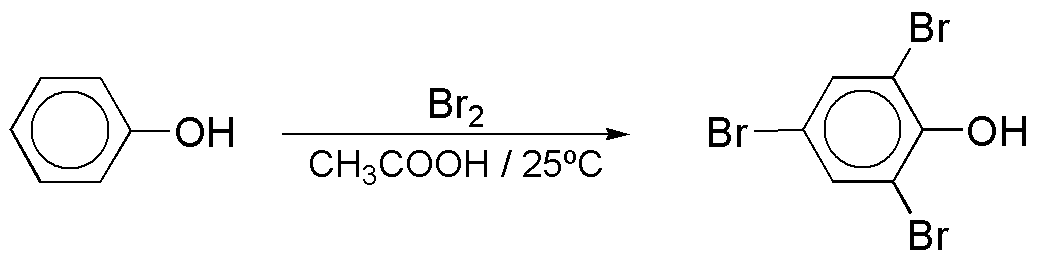
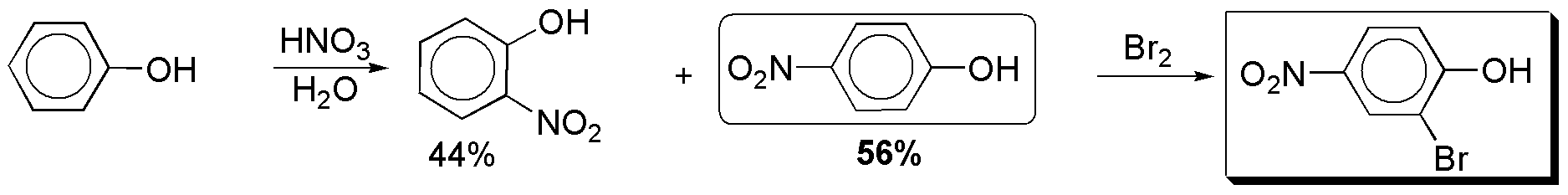
d) La nitración del fenol origina una mezcla de isómeros, siendo ligeramente superior la proporción del compuesto 1,4- sobre el 1,2-. A partir del p-nitrofenol se obtiene el producto deseado, ya que la posición 2 del anillo de benceno está especialmente activada.
Solución 7:
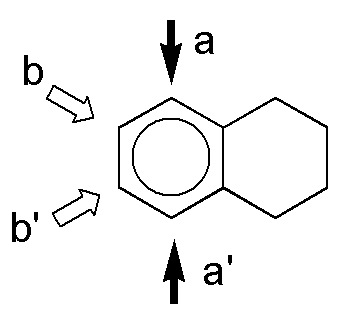
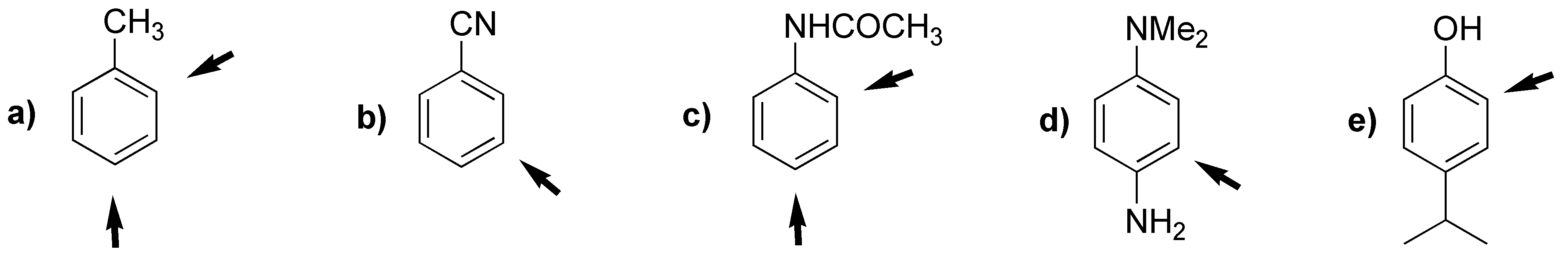
a) Las posiciones que se encuentran activadas son las orto- y para- con respecto a los sustituyentes, marcadas con una flecha. Las posiciones a y a’ y b y b’ son equivalentes. El producto mayoritario se obtiene por sustitución en b o b’, por una cuestión estérica. Al ser los dos sustituyentes moderadamente activantes, la reacción estará más favorecida que en el caso del benceno.
b) El grupo metilo y terc-butilo son orto- y para-dirigentes. Por efectos estéricos predomina la sustitución en la posición orto- con respecto al metilo. El anillo es más rico en electrones que el benceno por lo que la sustitución electrofílica está favorecida.
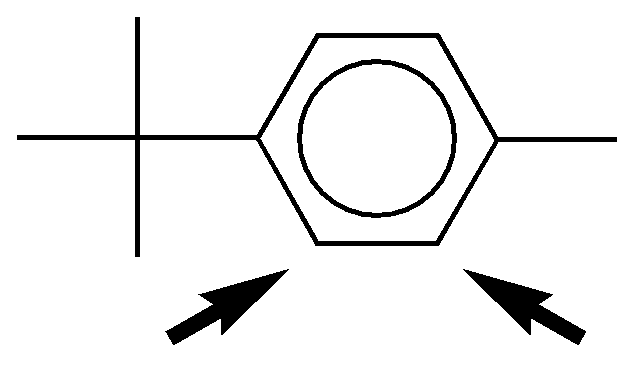
c) El grupo amino, NH2, es fuertemente activante mientras que el grupo metilo, CH3, es activante débil. Está doblemente favorecida una de las posiciones orto- con respecto al grupo amino (marcada con una flecha), ya que en este caso se produce un efecto cooperativo. La velocidad de reacción será mayor que la del benceno.
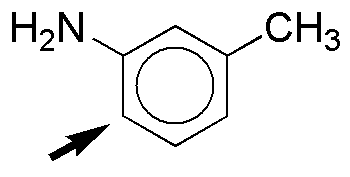
d) Los dos sustituyentes tienen efecto activante sobre el anillo aromático. La velocidad de reacción será mayor que en el propio benceno. El producto mayoritario de la sustitución se dará en la posición para- con respecto al grupo OH, ya que prevalece el efecto de este grupo por ser fuertemente activante y estar menos impedida estéricamente la posición marcada.
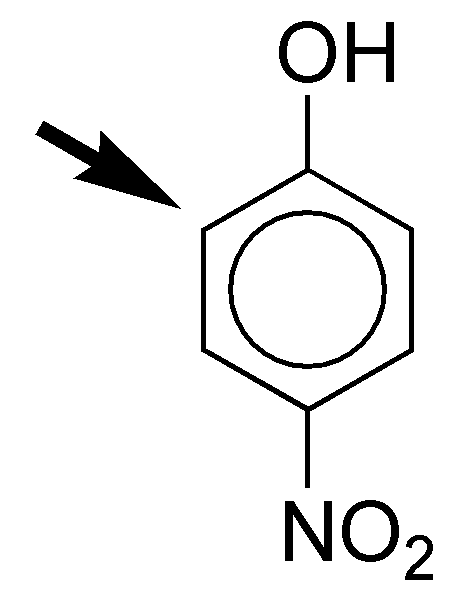
e) El grupo acetamido es moderadamente activante y el carboxilo moderadamente desactivante. La velocidad de sustitución aromática electrofílica será semejante a la del benceno. En cuanto a la orientación, los grupos presentan un efecto cooperativo, dado que la posición marcada con la flecha está doblemente activada por el efecto para-dirigente del acetamido y meta-dirigente del grupo COOH.
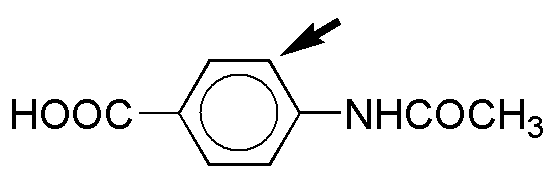
f) Ambos grupos son activantes, por lo que la reacción de sustitución será mucho más rápida que en el caso del benceno, sin embargo, se obtendrá una mezcla de productos, ya que ninguno de los grupos propicia especialmente el ataque en una de las posiciones libres (efecto antagonista), en todo caso con un mayor porcentaje de producto de sustitución orto- con respecto al grupo NH2, ya que es fuertemente activante, mientras que el grupo OCH3, es moderadamente activante.
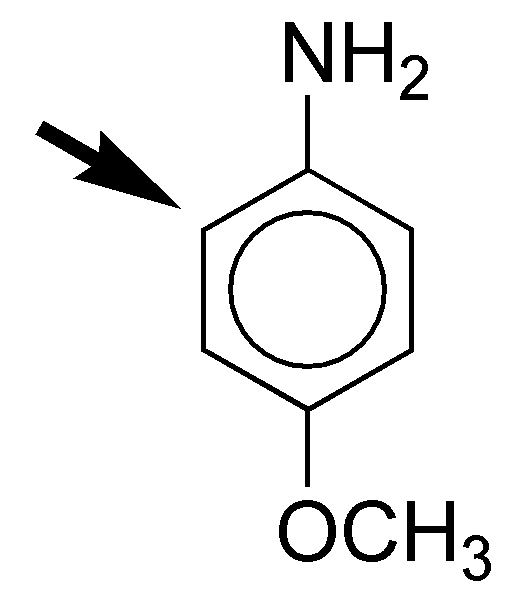
g) Una sal de amonio es fuertemente desactivante, ya que disminuye la densidad electrónica del anillo aromático. Por el contrario el grupo OCH3 es moderadamente activante. La velocidad de reacción de sustitución debe ser algo menor que para el caso del benceno. La posición orto-, con respecto al grupo activante la más favorecida en la reacción de sustitución.
Solución 8:
a) La hidrogenación con Pd(C) produce la adición de hidrógeno sobre el doble enlace de la cadena, mientras que el anillo de benceno permanece inalterado. Para poder hidrogenar un anillo aromático se requieren presiones de hidrógeno elevadas y altas temperaturas, por ello el resultado de la reacción es el que se describe.
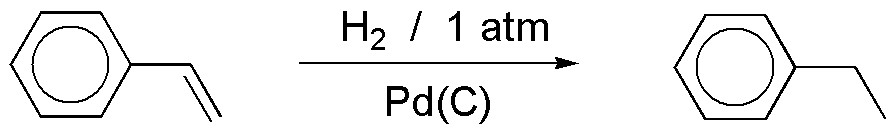
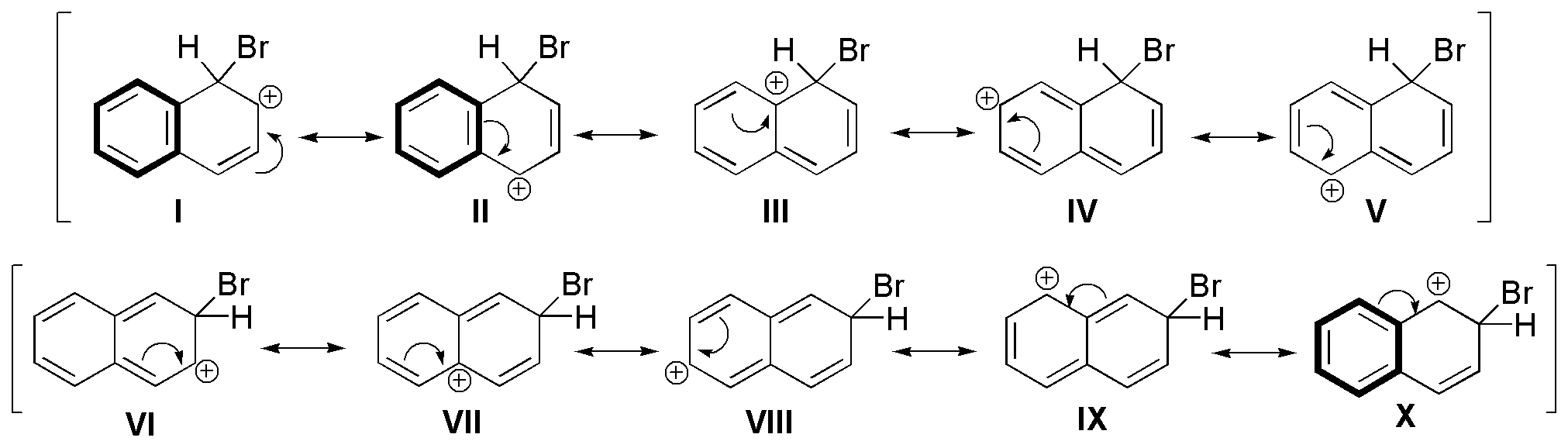
b) La halogenación del naftaleno puede dar, en principio dos tipos de productos, con sustitución en C1 y en C2.

El producto que se obtiene mayoritariamente es el 1-bromonaftaleno. La mayor reactividad de la posición 1 se debe a la diferencia entre los dos intermedios de reacción que se postulan para cada uno de los ataques.
En ambos casos podemos encontrar cinco estructuras resonantes, pero con distintas energías, ya que para el ataque en posición C1 se mantienen dos estructuras que conservan la aromaticidad del segundo anillo (marcadas en trazo grueso), mientras que para el ataque en posición C2, sólo una. Puesto que las estructuras en las que se conserva la aromaticidad contribuyen en mayor grado al híbrido por resonancia, el ataque en C1 está más favorecido que en C2.
c) El tratamiento de un 1,2-difenol (pirocatecol) y sus derivados con óxido de plata en éter o THF conduce a la formación de 1,2-quinonas, por lo que el producto obtenido será:
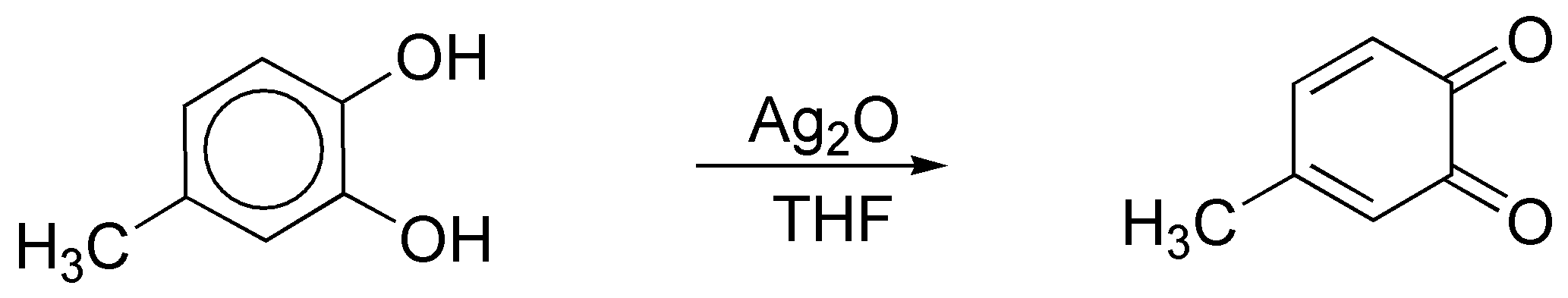
d) El sodio en amoníaco es un agente reductor que transforma los anillos de benceno en ciclohexa-1,4-dienos. Este procedimiento es compatible con sustituyentes en el anillo como -COOH, -COOR, -CN, grupos alquilo, -OR o -NH2 entre otros.
En bencenos monosustituidos, como el del problema, hay dos posibilidades en cuanto a la formación del producto final (I y II).
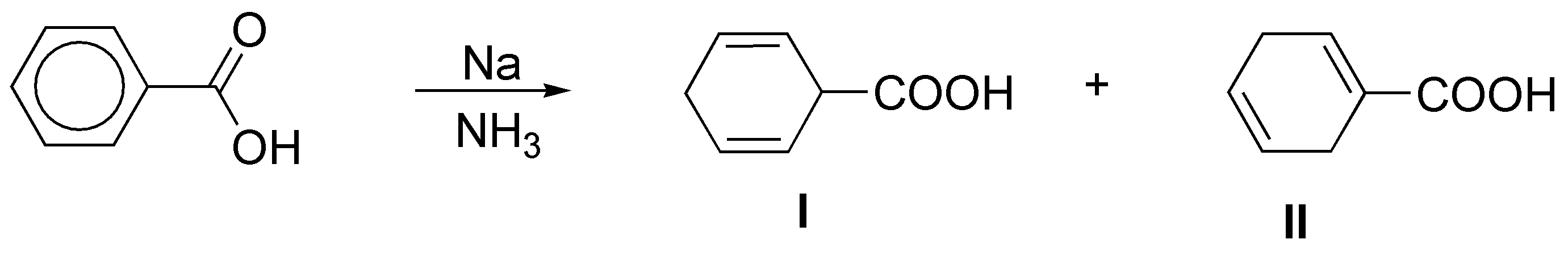
Se puede predecir el producto obtenido, considerando el mecanismo que justifica el que la reacción sea regioselectiva, ya que los sustituyentes con efecto atrayente de electrones (efecto -M) estabilizan la carga en la posición marcada con una flecha, mientras que los grupos electrón donante (efecto +I) la desestabilizan. Este hecho condiciona las posiciones en las que quedan los dobles enlaces.
e) El ión bicarbonato descompone térmicamente para dar CO32- y CO2 según la ecuación:
![]()
Los fenoles dan derivados del ácido salicílico por reacción de Kolbe-Schmitt. En este caso el producto obtenido será:
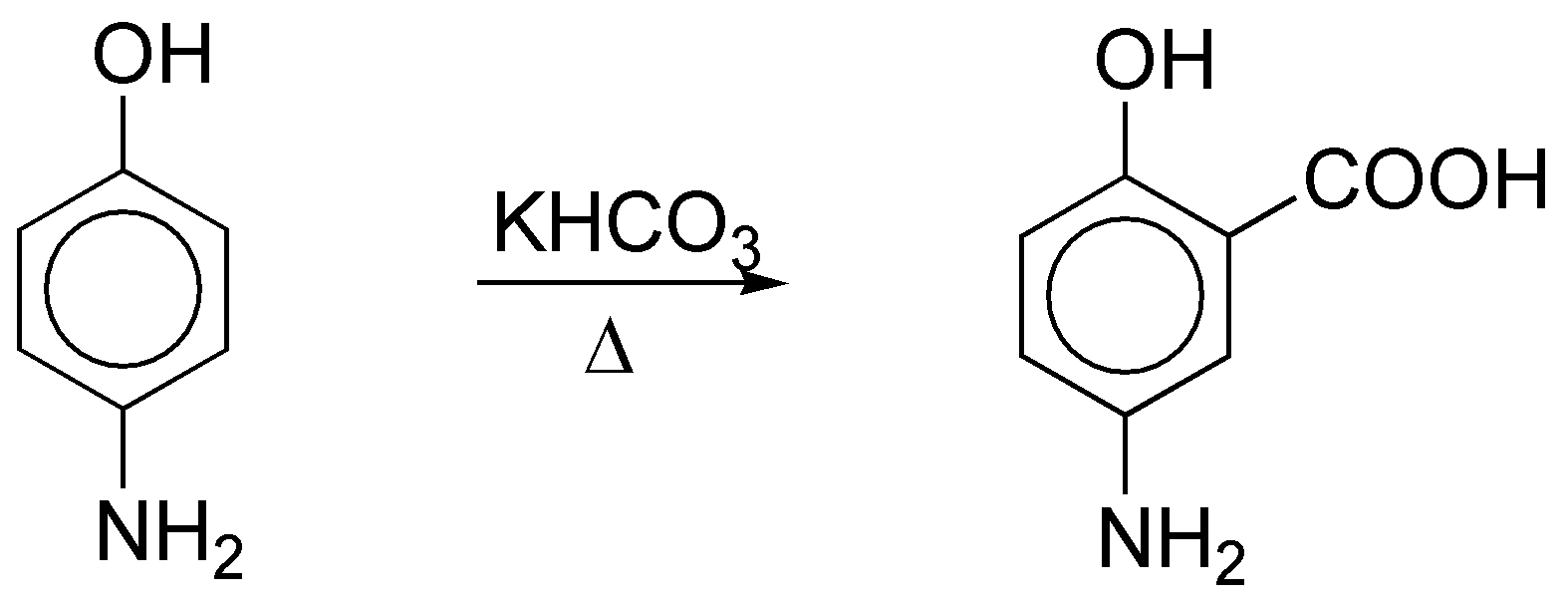
f) En casos como éste se debe considerar los dos anillos por separado. El anillo A es menos reactivo que el B frente a una reacción de sustitución aromática electrofílica, ya que presenta un sustituyente moderadamente desactivante y el B tiene ese mismo grupo y otro moderadamente activante como el isopropilo, que es el que condiciona la sustitución. Las dos posiciones más reactivas son la orto- y para- con respecto a este grupo. Dado que la posición para- se encuentra ocupada, el producto de bromación será el orto-que se indica:
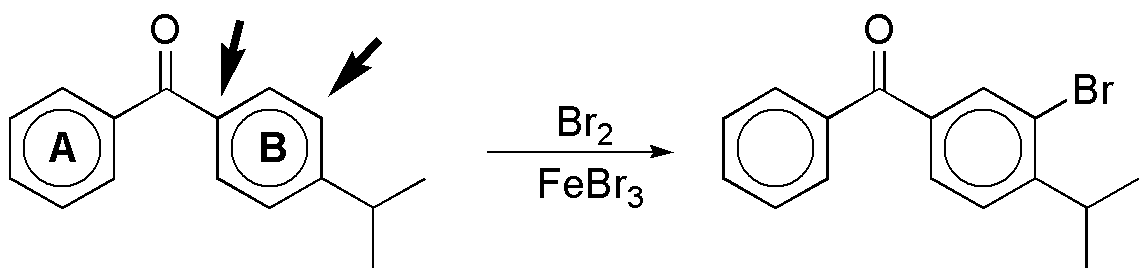
Solución 9:
En el mecanismo de sustitución aromática nucleofílica mediante un proceso de adición-eliminación se produce un aumento de la densidad electrónica en las posiciones orto- y para- con respecto al grupo que se sustituye. Cuanto mayor sea el número de agrupaciones capaces de estabilizar la carga.
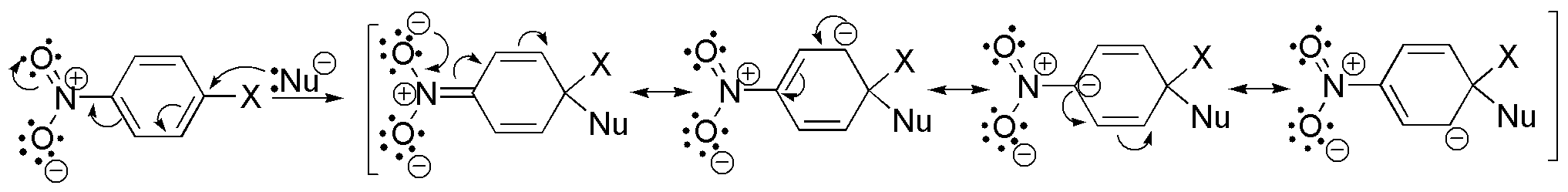
Por otro lado, la velocidad de reacción es función del grupo saliente según el orden F > Cl > Br > I. Teniendo en cuenta estos factores el orden será:
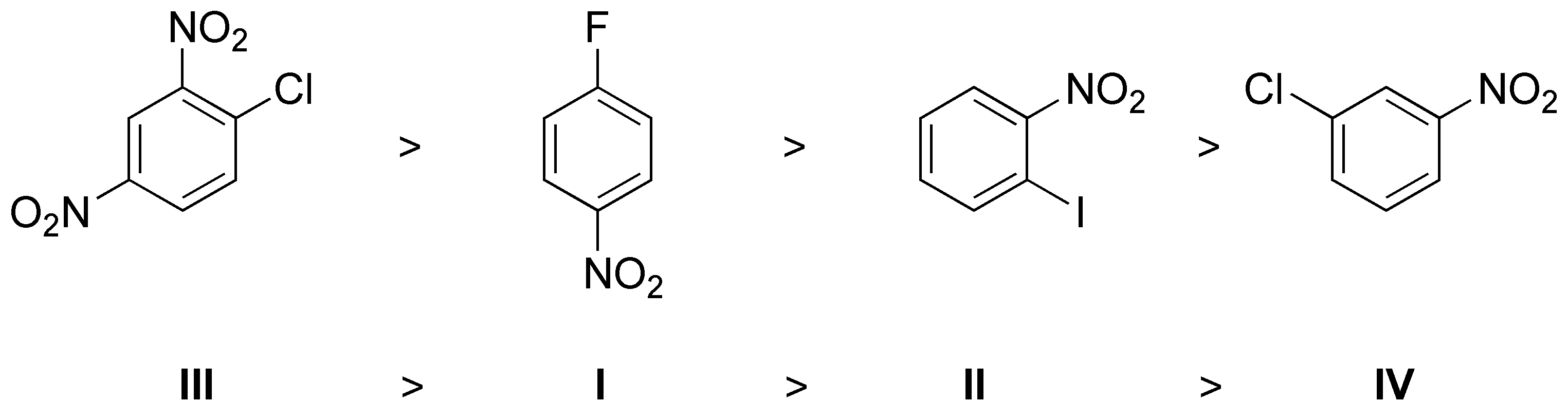
Solución 10:
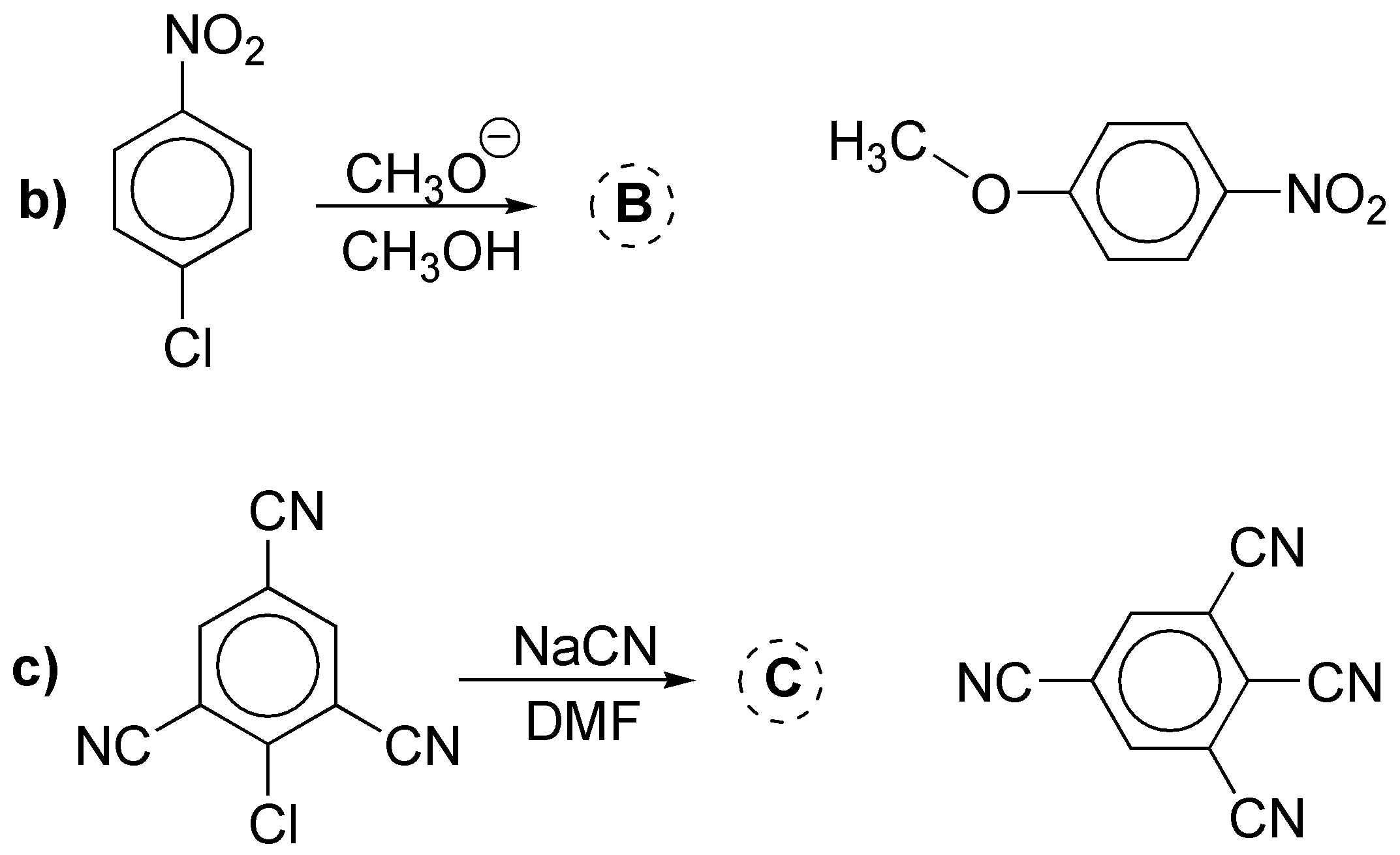
a) El producto final será el resultado de una reacción sustitución aromática nucleofílica a través de bencino, es decir, mediante un mecanismo de eliminación-adición. El amiduro, actúa como base y nucleófilo. Dado que se parte de un sustrato con un sustituyente, se obtiene una mezcla de productos.
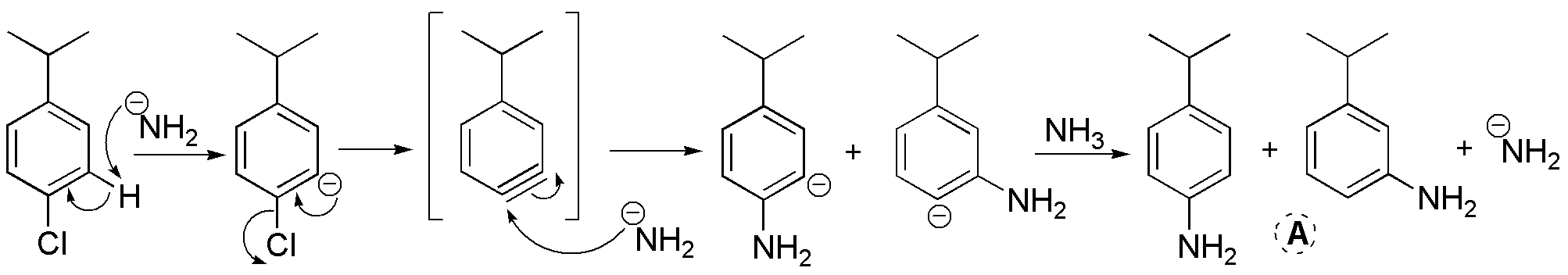
b) y c) son reacciones de sustitución aromática nucleofílica con mecanismos del tipo adición-eliminación. Ambos sustratos son compatibles con esta clase de reacciones, ya que presentan grupos electrón-atrayente en las posiciones orto- y/o para- con respecto al grupo saliente. Los productos obtenidos serán:
Solución 11:
La velocidad de la reacción dependerá de lo activado que esté el anillo bencénico. En vista de los grupos presentes la reactividad será:
Solución 12:
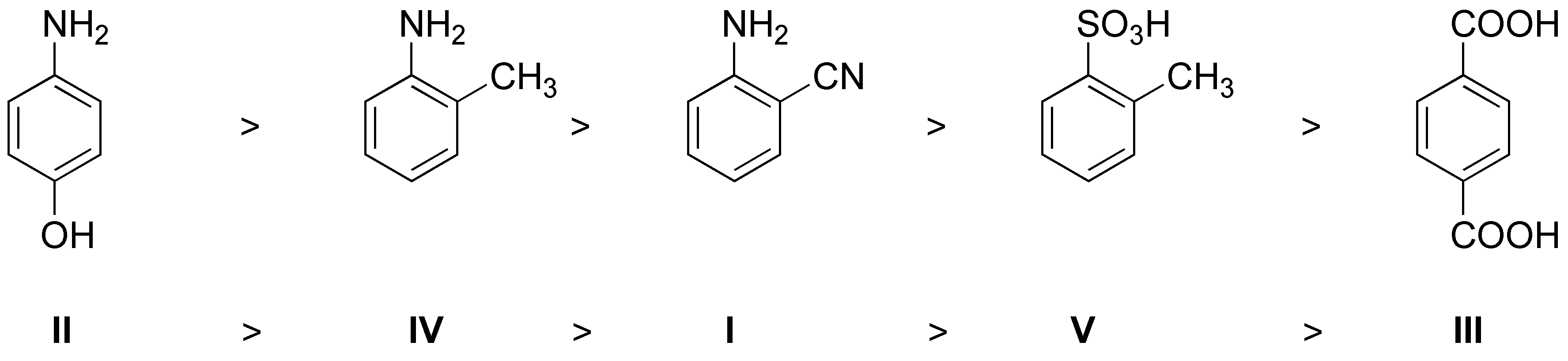
Serán meta-dirigentes aquellos grupos que sean electrón-atrayentes o posean una carga positiva (neta o parcial) sobre el átomo unido al anillo aromático (la excepción es el grupo NO (nitroso)) en este caso serán los grupos: b) CH2Cl, c) COOH, d) SO3H y e) CONH2; los demás serán orientadores orto– y para-.
Solución 13:
La bromación de la anilina y acetanilida dan 2,4,6-tribromoanilina y 4-bromoacetanilida, respectivamente.
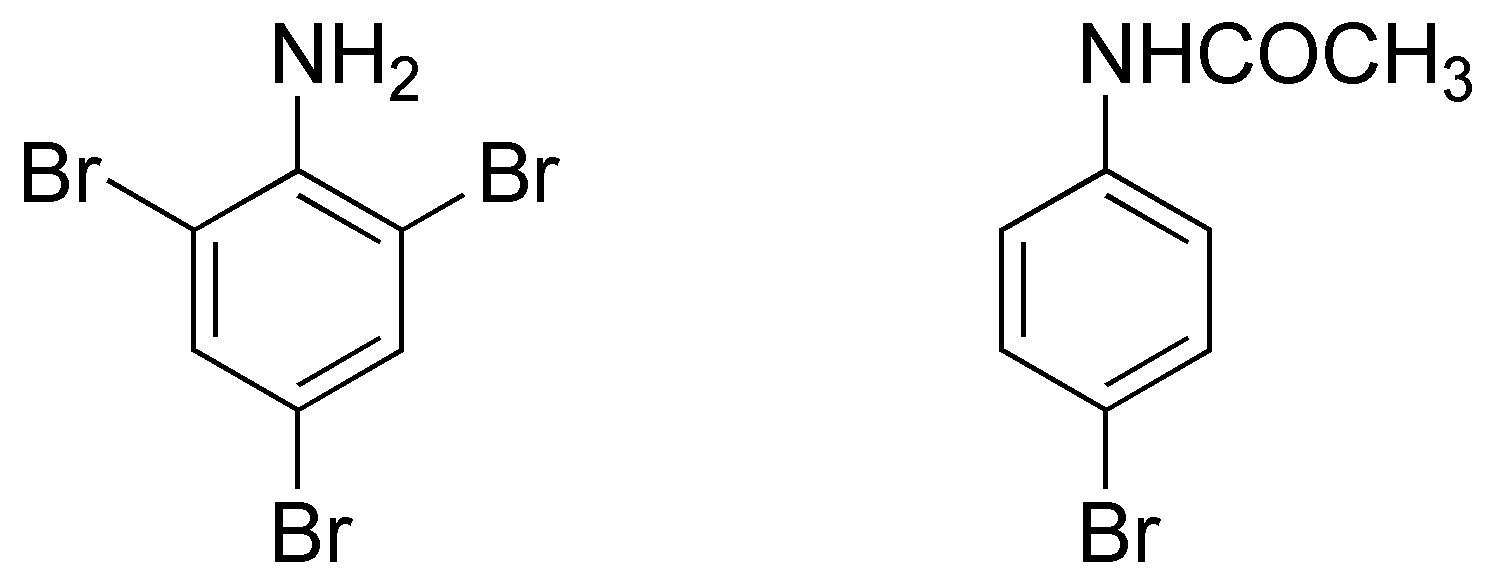
La causa de este comportamiento es que el grupo amino es un activante tan fuerte que la reacción no se detiene en el derivado monobromado, sino que produce la bromación en todas las posiciones activadas. Por contra la acetanilida posee un activante más suave y produce, mayoritariamente, el monoderivado en para debido al impedimento estérico.
Solución 14:
Las flechas en b) indican dos posiciones idénticas.
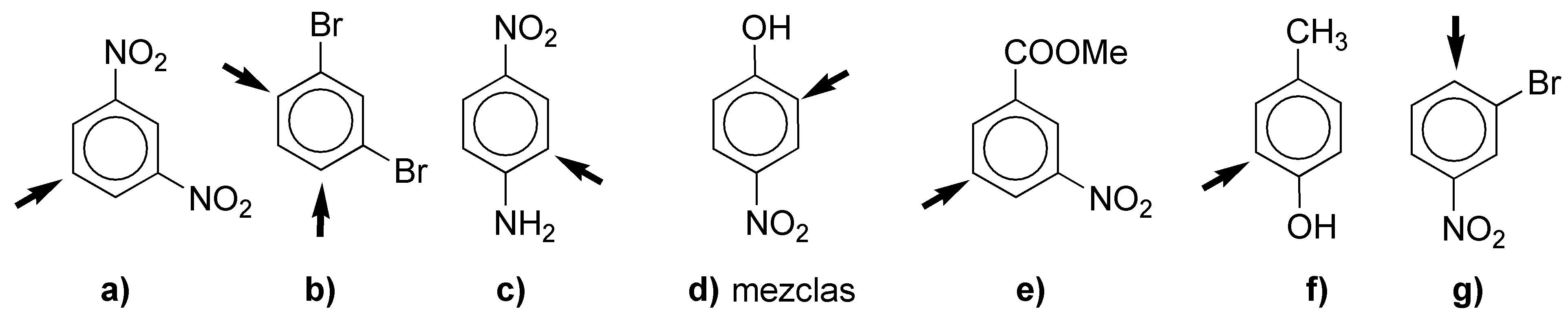
Solución 15:
Se dan dos factores opuestos para el grupo nitro (NO2) y nitroso (NO). Por un lado, el carbocatión intermedio que se forma en la etapa de adición está desestabilizado en el caso del grupo nitro en las posiciones orto- y para-, debido a que presenta dos cargas positivas adyacentes. Por otro lado, el ataque en orto- y para- está especialmente estabilizado en el caso del grupo nitroso, ya que el nitrógeno puede ceder un par de electrones al carbono adyacente, para formar otra estructura resonante estabilizada. Esto no se da con el grupo nitroso en meta- ya que el carbono adyacente al nitrógeno no presenta carga positiva. La suma de ambos efectos hace que el grupo nitro dirija el ataque en meta- mientras que el grupo nitroso lo haga en orto- y para-.
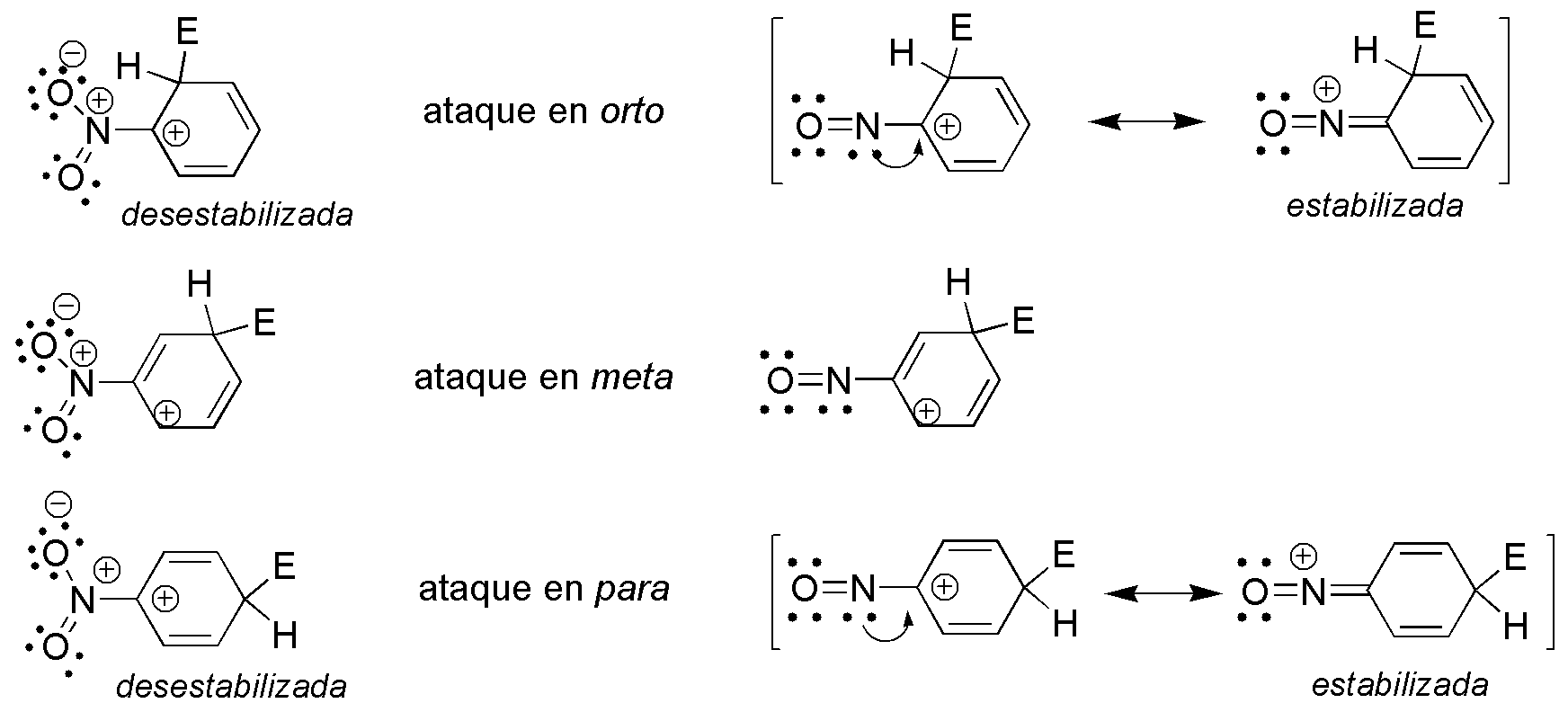
Solución 16:
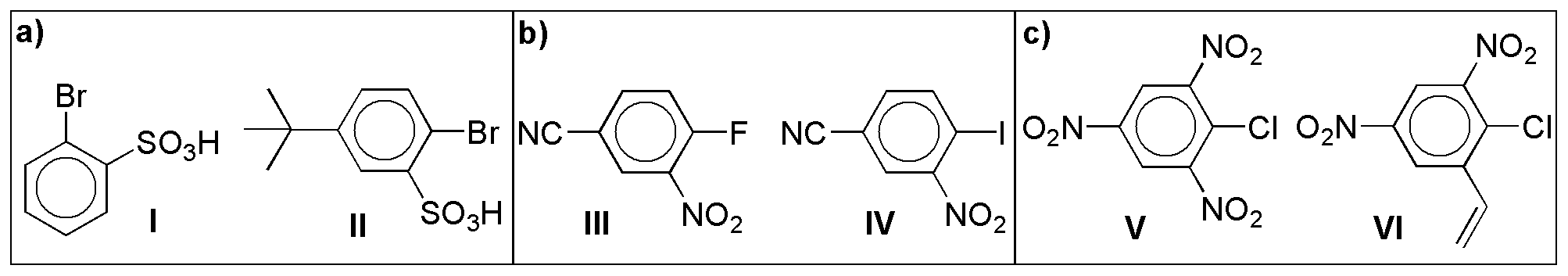
Reaccionará más rápidamente el anillo menos desactivado, es decir el que menos grupos desactivantes posea, por lo tanto la solución será:
I > II
IV > III
VI > V
Solución 17:
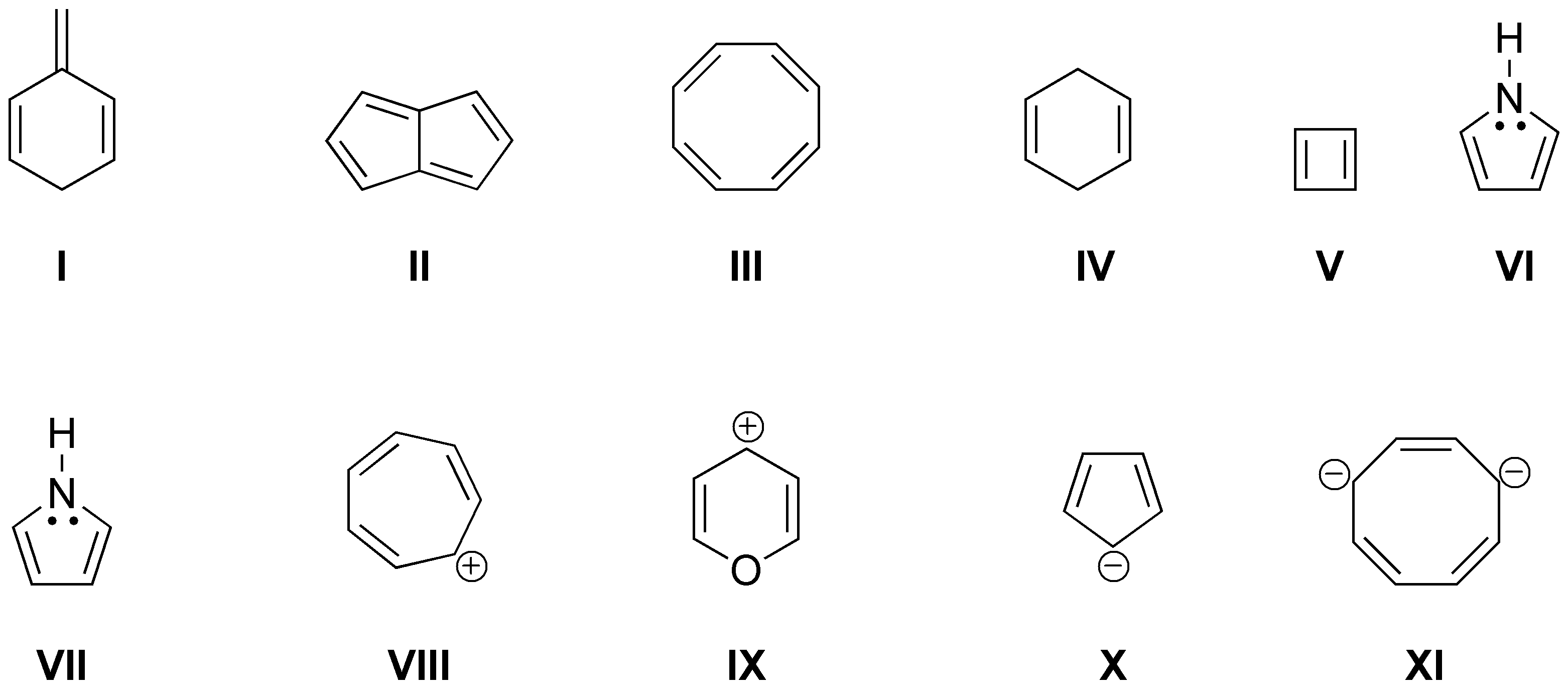
Serán no aromáticos los productos I, III y IV, por no estar conjugados o no ser planos, antiaromáticos los productos II, V, VII, por no cumplir la regla de Hückel y aromáticos los restantes: VI, VIII, IX, X y XI, pues si la cumplen.
Solución 18:
Las reacciones a) y b) conducen a los productos de sustitución en la posición meta- por poseer grupos electrón-atrayentes (desactivantes). El producto obtenido en c) posee un grupo activante (ciclohexil) y por impedimento estérico producirá mayoritariamente el derivado en para-.
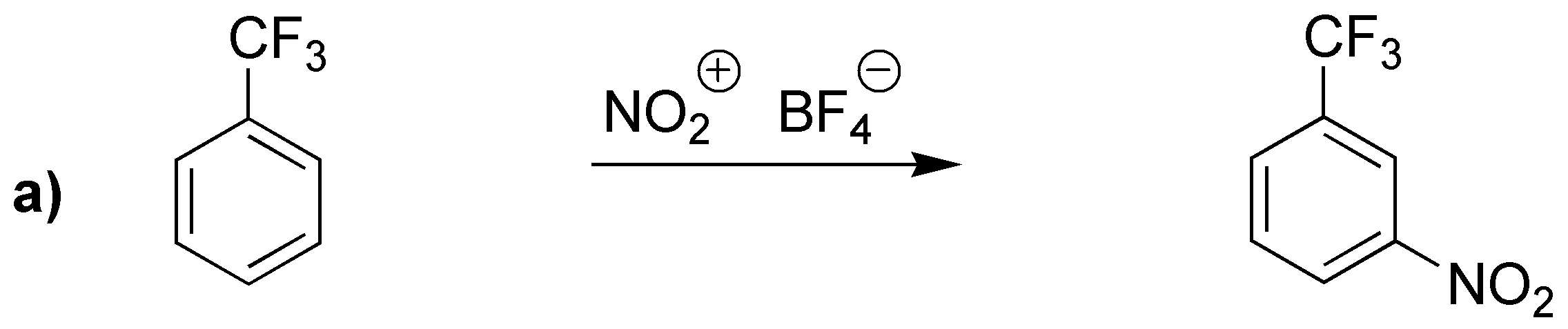
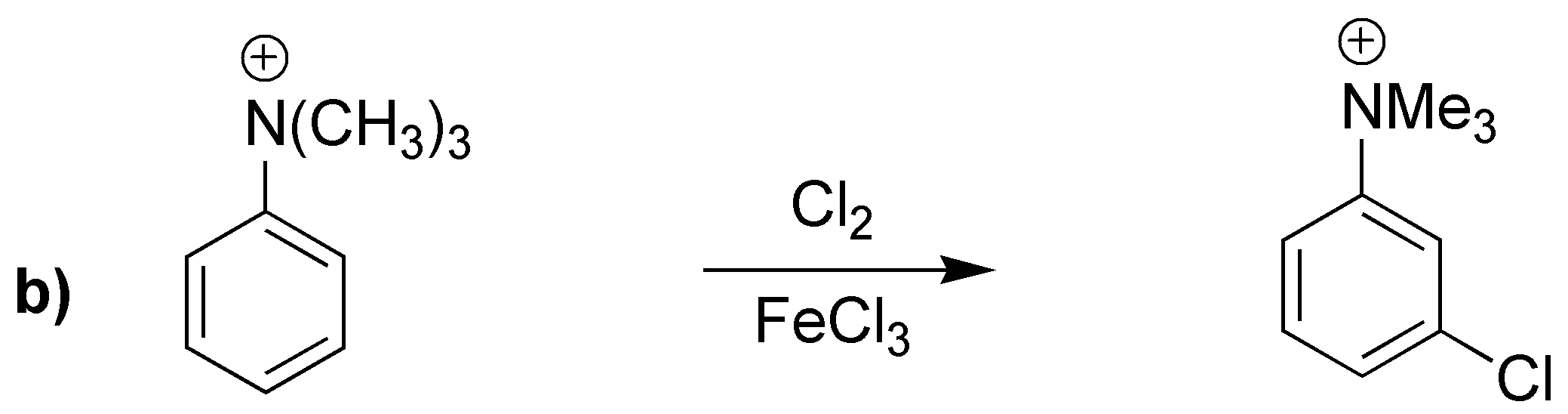
![]()
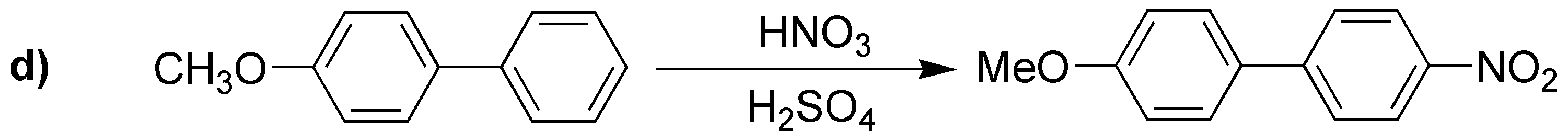
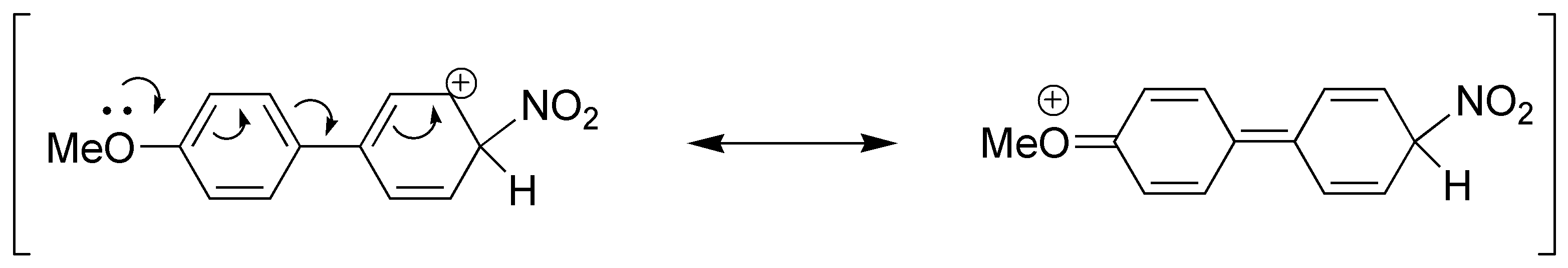
El producto obtenido en d) será el indicado pues posee el intermedio que se muestra y que es muy estable.
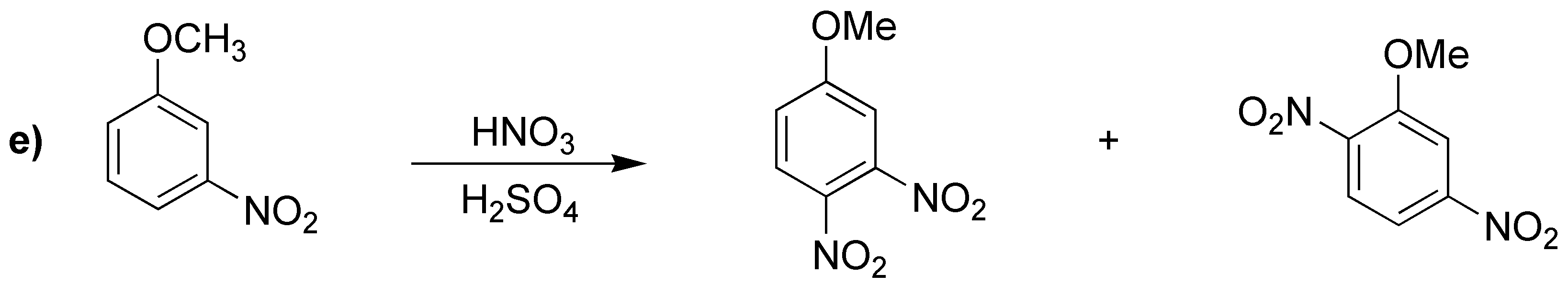
En la reacción e), se producirá una mezcla de productos teniendo en cuenta que será el grupo metoxilo el que controle la orientación al ser activante.
Solución 19:
La orientación de la sustitución vendrá determinada por el carácter de los sustituyentes. El más activante determina la posición de la sustitución.
Solución 20:
Las reacciones a), b) y c) corresponden a tres alquilaciones de Friedel-Craft. mientras que la d) es una acilación.
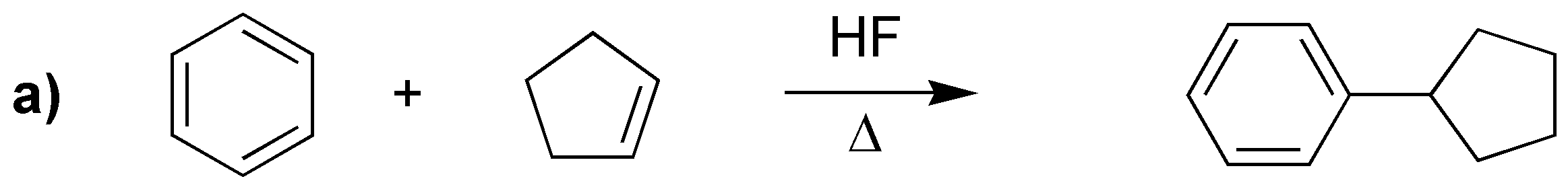
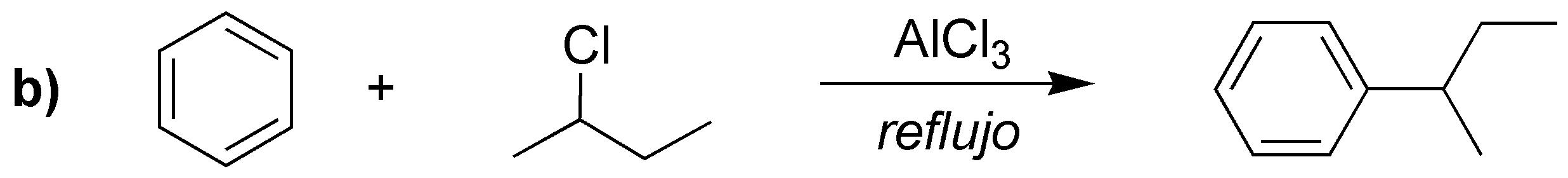
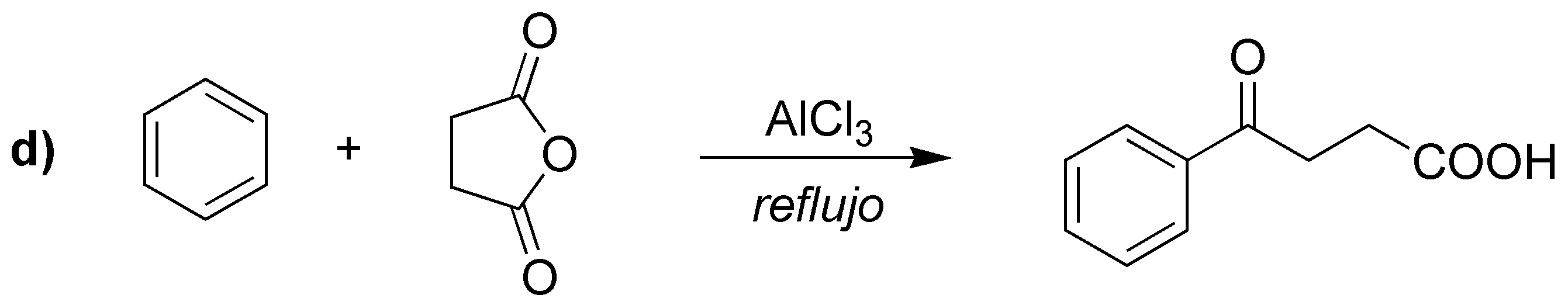
Solución 21:
Al producir un solo derivado, el producto A debe ser el para-xileno. El producto B que produce dos derivados será el orto-xileno. Mientras que el C será el meta-xileno, como se muestra en la figura:
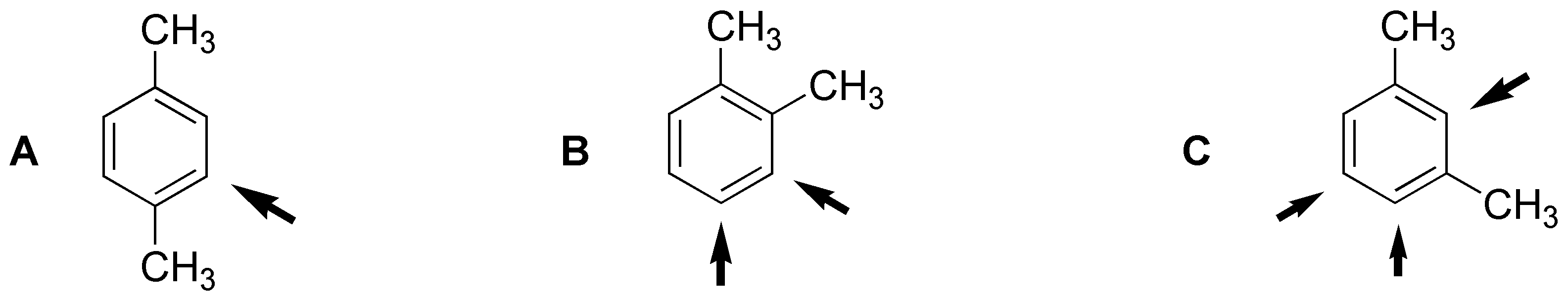
Solución 22:
El tolueno reaccionará más rápidamente que el benceno pues posee un grupo metilo que es un activante (como todos los grupos alquílicos), ello se traduce en una mayor velocidad, en una menor temperatura necesaria para que se produzca la reacción o en unas condiciones más suaves de la misma.
Solución 23:
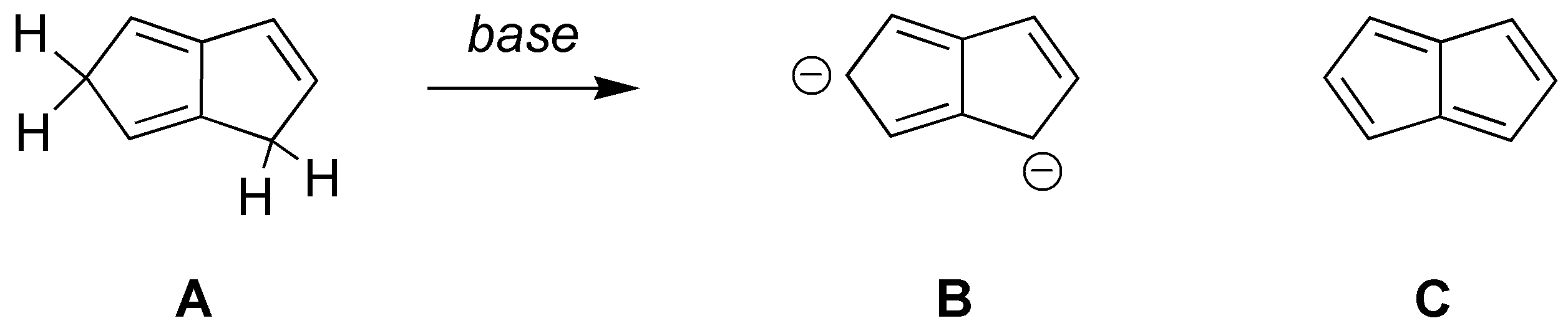
El dianión B producido en la reacción es estable pues es aromático al cumplir la regla de Hückel. El tetraeno C por contra no la cumple, es antiaromático y por tanto no es estable.
Solución 24:
La reducción de Birch producirá los dienos indicados:
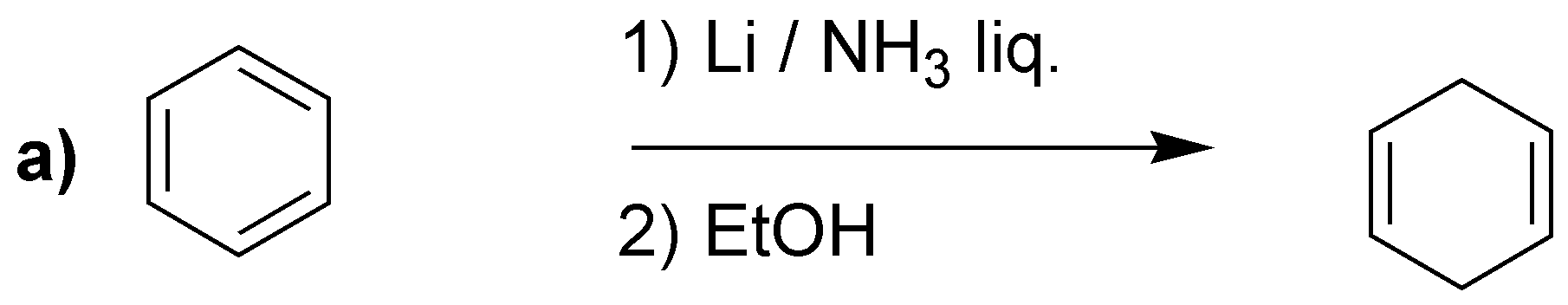
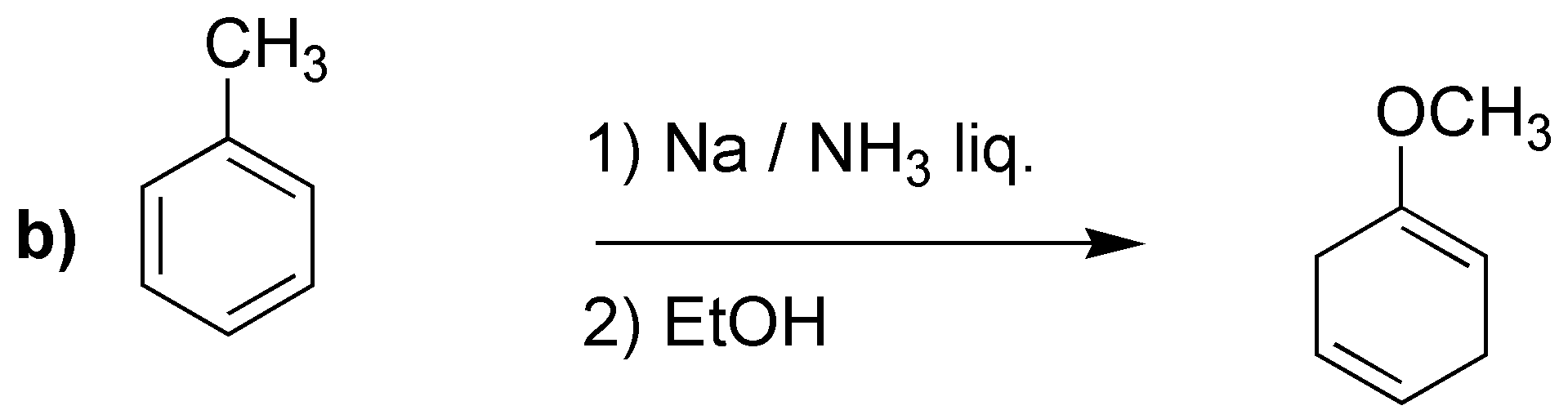
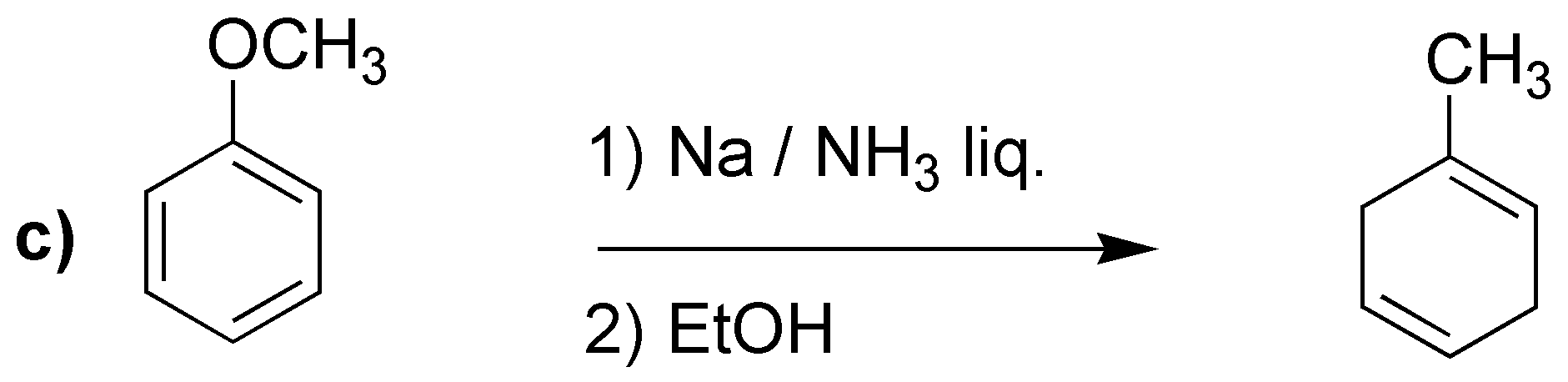
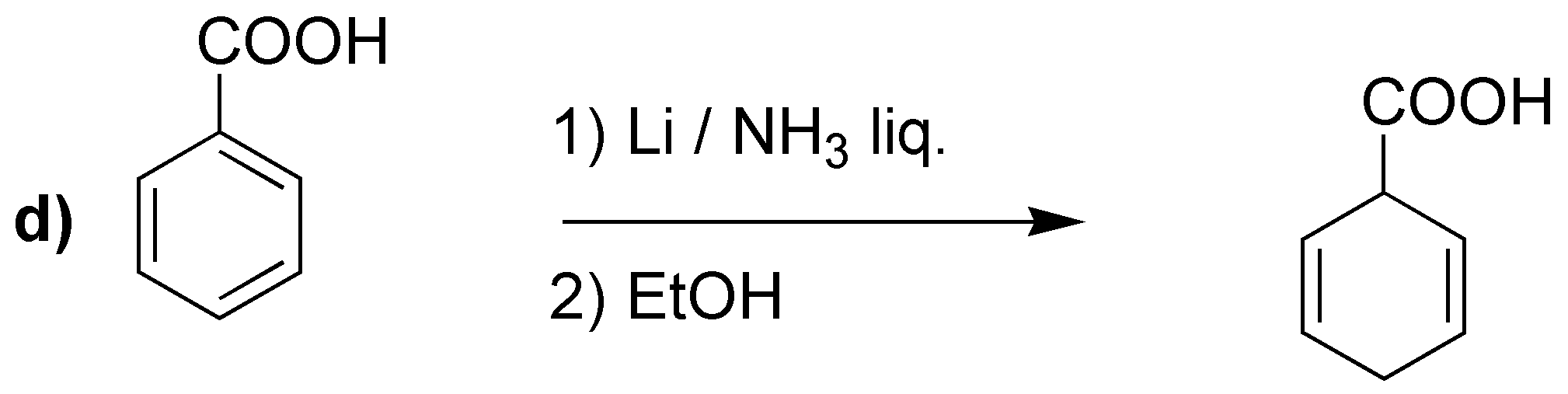
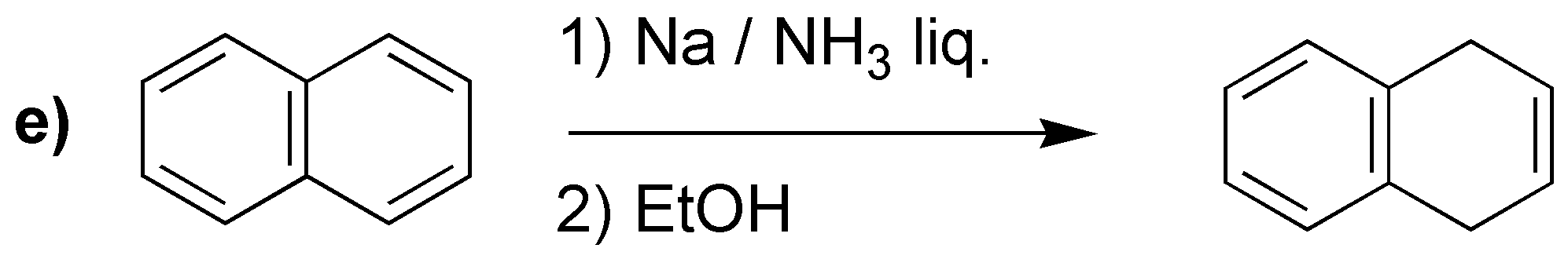
Merece la pena llamar la atención en el caso d), en el que a diferencia de los casos anteriores, no se obtiene el doble enlace más sustituido. Se han propuesto como explicación que los grupos electrón atrayentes serían los responsables, como en este caso -COOH.
Solución 25:
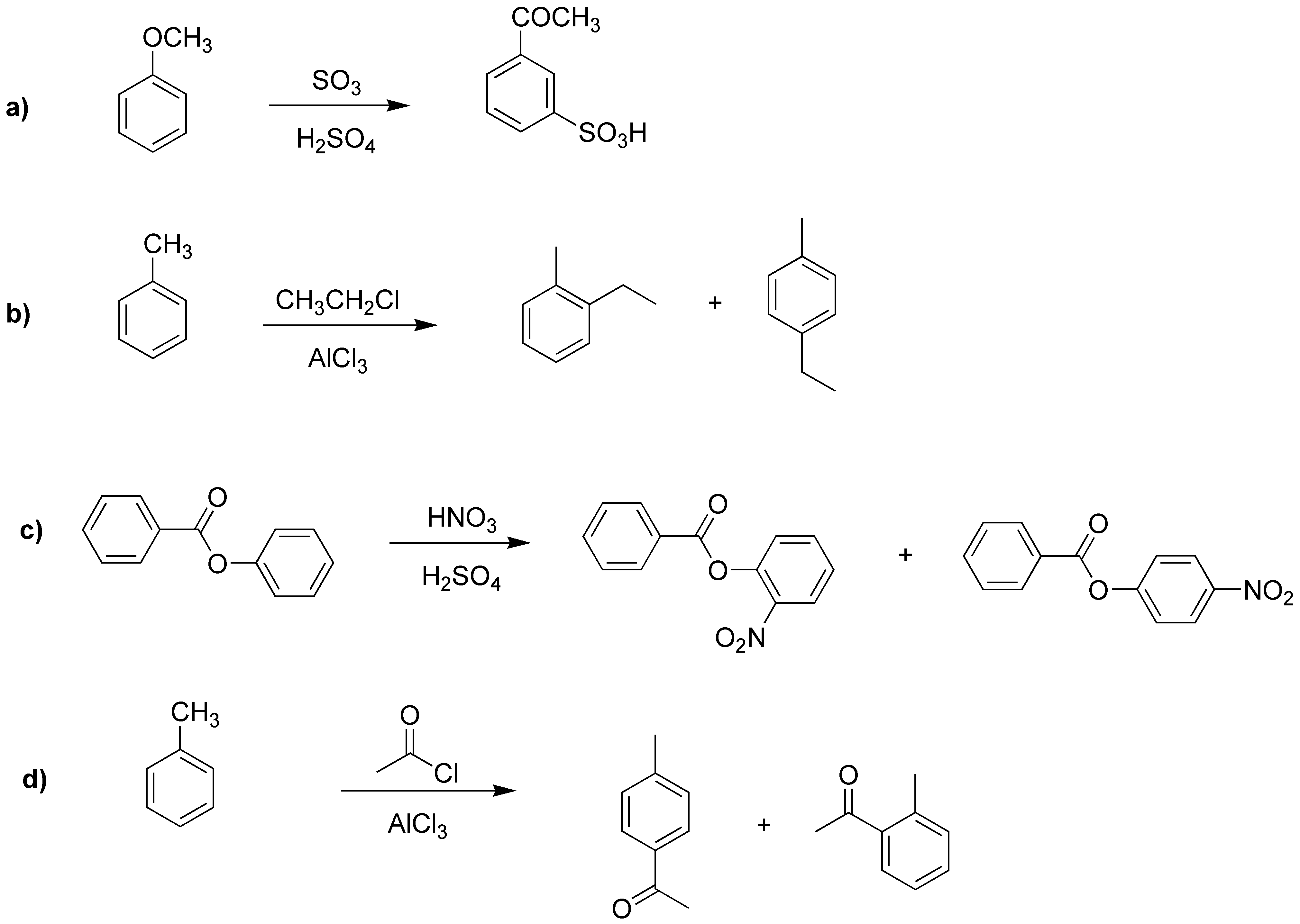
El proceso a) corresponde a una sulfonación y da como producto un ácido sulfónico; el b) es una alquilación del tolueno que producirá la mezcla de los dos isómeros posibles. En el caso c) la reacción se producirá sobre el segundo anillo bencénico pues esta activado mientras que el primero está desactivado, resultando en una mezcla de nitro compuestos. En el caso d), la acilación producirá una mezcla de compuestos donde el mayoritario será el producto para-.
Solución 26:
Como el producto final tiene una disposición para de los sustituyentes será necesario introducir primero el grupo metilo que es orto y para dirigente. La posterior nitración del mismo producirá una mezcla de ambos isómeros en la que el para será mayoritario por impedimento estérico. Si las reacciones invirtieran el orden el producto producido sería el meta-nitrotolueno , si es que se pudiese dar dicho proceso.