Written by J.A. Dobado | Last Updated on 1 año
¿Qué es la descarboxilación de Krapcho?
El descarboxilación de Krapcho es un proceso bien estudiado que fue explorado por primera vez por Krapcho en 1967. Esta reacción es una reacción de descarboxilación que ocurre en presencia de un haluro de alquilo y ésteres activos como ésteres β-ceto, β-diesters y α-ciano ésteres en solventes polares o dipolares aproticos como DMF, DMSO y HMPA.
El descarboxilación de Krapcho también se conoce como la reacción de Krapcho o condición de Krapcho. La descarboxilación de Krapcho también puede ocurrir en ésteres de metilo, conocida como descarbometoxilación de Krapcho, y en ésteres de etilo, referida como la descarboetoxilación de Krapcho.
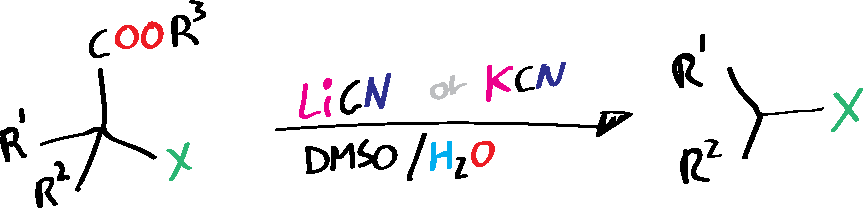
- R1, R2 = H, alquilo, arilo
- R3 = Me, Et, etc. (ver lista de acrónimos)
- X = CN, C(O)R, CO2R
Se han utilizado varios sistemas para la descarbalkoxilación, incluyendo NaCN/DMSO, LiCl/HMPA/H2O, LiCl/DMSO/H2O, LiBr/HMPA/H2O, LiI/NaCN/DMF/H2O, NaCl/DMF/H2O y acetato de tetrametilamonio (Me4NAc). Entre las sales de haluro, NaCl, NaBr, KCl y Me4NBr en solventes como DMSO y HMPT se han utilizado para la descarboxilación alquilativa interna, mientras que LiCl en HMPT se ha utilizado para la descarboxilación alquilativa externa. Los ésteres β-ceto con un α-hidrógeno experimentan una descarboxilación rápida en DMSO húmedo.
Mientras que los ioduros se utilizan comúnmente en la decarboxilación de Krapcho debido a su aplicación previa para la ruptura de ésteres metílicos, el acetato de tetrametilamonio puede evitar la pérdida de la estereohomogeneidad del doble enlace. Entre los cloruros alcalinos, el LiCl funciona mejor que el NaCl debido a la diferencia en su solubilidad en DMSO. Sin embargo, el LiF es ineficaz, presumiblemente porque existe como un par iónico de contacto en la solución. Además, el LiCl o el KCN es la sal más efectiva para eliminar el éster etílico en DMSO húmedo. La reacción va acompañada de la formación de carbonato de litio (Li2CO3) cuando se utiliza LiCl, y la velocidad de reacción no es de cinética de primer orden en términos de la concentración de LiCl. El mayor aumento de velocidad se observa en presencia de LiCl, y una mejora mucho menor de la velocidad es notable después. MgCl2, Na3PO4·12H2O y acetato de litio (LiAc) también son algo efectivos para la decarboxilación alquilativa, y la efectividad de Na3PO4·12H2O se debe a su alto pH en solución acuosa.
Se ha encontrado que los sustituyentes retiradores de electrones facilitan la decarboxilación alquilativa, mientras que la obstrucción estérica puede retardar la reacción. Por ejemplo, los malonatos disustituidos con dietilo y dimetilo no experimentan decarboxilación cuando se calientan en DMSO/H2O.
Referencias
- The decarbethoxylation of geminal dicarbethoxy compounds
A. Paul Krapcho, Gary A. Glynn, Brian J. Grenon, Tetrahedron Letters, 1967, 8 (3) 215-217
DOI: 10.1016/S0040-4039(00)90519-7 - Decarbalkoxylations of geminal diesters, β-keto esters and α-cyano esters effected by sodium chloride in dimethyl sulpoxide
A. Paul Krapcho, Allen J. Lovey, Tetrahedron Letters, 1973, 14 (12) 957-960
DOI: 10.1016/S0040-4039(00)72461-0 - Decarbalkoxylations of geminal diesters and β-keto esters in wet dimethyl sulfoxide. Effect of added sodium chloride on the decarbalkoxylation rates of mono- and di-substituted Malonate esters
A.Paul Krapcho, E.G.E. Jahngen, A.J. Lovey, Franklin W. Short, Tetrahedron Letters, 1974, 15 (13) 1091-1094
DOI: 10.1016/S0040-4039(01)82414-X - Synthetic applications and mechanism studies of the decarbalkoxylations of geminal diesters and related systems effected in dimethyl sulfoxide by water and/or by water with added salts
A. Paul Krapcho, J. F. Weimaster, J. M. Eldridge, E. G. E. Jahngen Jr., A. J. Lovey, and W. P. Stephens
The Journal of Organic Chemistry 1978 43 (1), 138-147
DOI: 10.1021/jo00395a032
