Índice
Written by José | Last Updated on 2 meses
Objetivo
Extraer los pigmentos fotosintéticos y separarlos mediante una técnica sencilla de cromatografía en columna (CC) y cromatografía en capa fina (CCF).
Antecedentes
Las hojas de las espinacas contienen una serie de productos naturales como carotenos, clorofilas, xantofilas, vitaminas hidrosolubles, etc.
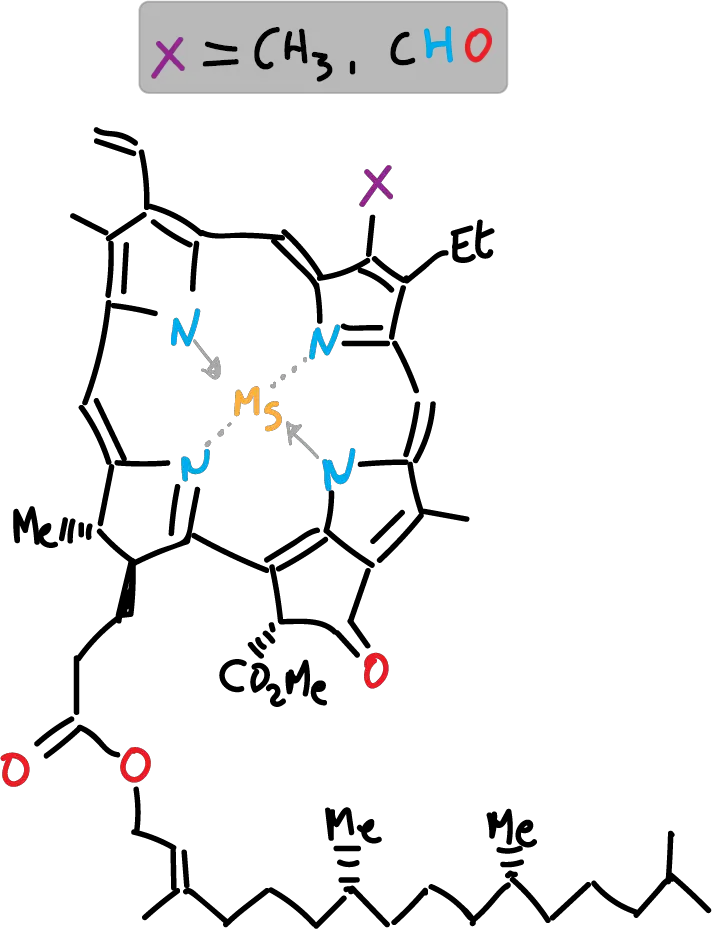
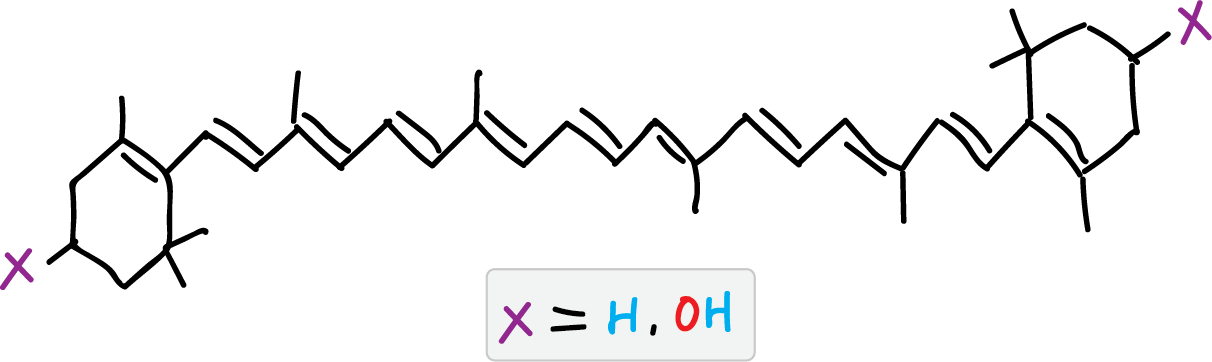
Las hojas de espinaca posee β-caroteno y clorofila como principales componentes responsables del color de las mismas y cantidades menores de xantofilas. El β-caroteno tiene color amarillo, mientras que la clorofila tiene coloración verde, presentado dos variedades la a y la b que difieren en que la tiene un grupo metilo la b un grupo formilo en el anillo de porfirina. La pérdida del ion Mg++ en las clorofilas conduce a la formación de feofitina (a y b). Por otro lado, las xantofilas son una familia de compuestos, derivados de los carotenos con átomos de oxígeno en la estructura y que en la hoja de espinaca se encuentran en menor proporción que β-carotenos y clorofila.
En este experimento, se procede a la extracción de los pigmentos de la hoja de espinaca y a su análisis y separación por cromatografía en capa fina (CCF) y en columna (CC).
La cromatografía es una técnica que permite la separación de las sustancias de una mezcla basándose en la distinta afinidad que tienen estos productos por la fase estacionaria (gel de sílice) y una móvil (eluyente).
Procedimiento experimental
A) Preparación de la muestra
Pesar aprox. 2 g de hojas de espinaca.[1] Lavar las hojas con agua, retirar los nervios, trocearlas con ayuda de unas tijeras y ponerlas en un mortero, junto a 22 ml de acetona y 3 ml de hexano y añadir una pequeña cantidad de carbonato cálcico (CaCO3) con ayuda de una espátula (evita la degradación de los pigmentos fotosintéticos). Triturar la mezcla hasta que las hojas se decoloren y el disolvente adquiera un color verde intenso.
Transferir únicamente el líquido obtenido a un embudo de decantación (evitar que se transfieran sólidos), y añadir 20 ml de hexano y 20 ml de disolución acuosa de NaCl al 10 %. Agitar la mezcla y dejar decantar. La fase acuosa (inferior) se desecha y la orgánica (superior) se lava con 5 ml de agua desionizada. Se vuelve a decantar, y la fase orgánica se transfiere a un Erlemeyer de 50 ml. La disolución se seca sobre sulfato sódico anhidro y se elimina el desecante por filtración por gravedad.
La muestra se divide en dos partes. Se toma 1 ml de la disolución y se reserva en un tubo de ensayo para realizar el análisis de la muestra por cromatografía en capa fina CCF y con el resto se realiza la separación cromatográfica en columna CC.
B) Análisis por cromatografía en capa fina CCF de los pigmentos de la espinaca
- Preparar un rectángulo de papel de filtro de altura y perímetro inferiores a los de la cubeta de cromatografía y colocarlo adosado a la pared de la parte interior de ésta, procurando que a lo largo del experimento nos permita la visión perfecta del cromatofolio.
- Preparar una disolución 7:3 de hexano:acetona.
- Introducir el eluyente en el interior de la cubeta (solo será necesario un volumen que permita una altura de disolvente en el interior de la cubeta de unos 5 mm) y tapar esta herméticamente, para permitir que, al impregnar el papel de filtro, los vapores de disolvente saturen todo el volumen de la cubeta.
- Con un lápiz (no usar ni bolígrafos ni rotuladores, solo lápices de grafito) y una regla trazar una línea horizontal a unos 5 mm de la base de un cromatofolio (Al TLC 5 x 7.5 cm silica gel 60F).[2]
- Con la ayuda del capilar de vidrio colocar una gota del líquido filtrado sobre la línea trazada en el cromatofolio.
- Introducir rápidamente el cromatofolio en la cubeta, en posición vertical, ligeramente inclinada y de forma que desde el exterior tengamos visión del nivel del disolvente en el cromatofolio en todo momento.
- Cuando el nivel de disolvente se sitúe a unos pocos milímetros de la parte superior del cromatofolio, extraer este y dejarlo secar al aire. (Se observará la aparición de manchas coloreadas a lo largo de la placa).
- Marcar con un lápiz el nivel que ha alcanzado el disolvente.
- Tapar rápidamente la cubeta para que su atmósfera se mantenga saturada de disolvente.
- Se observará la aparición de manchas coloreadas a lo largo de la placa, de forma que avanzarán más rápidamente los carotenos y en menor grado la clorofila.
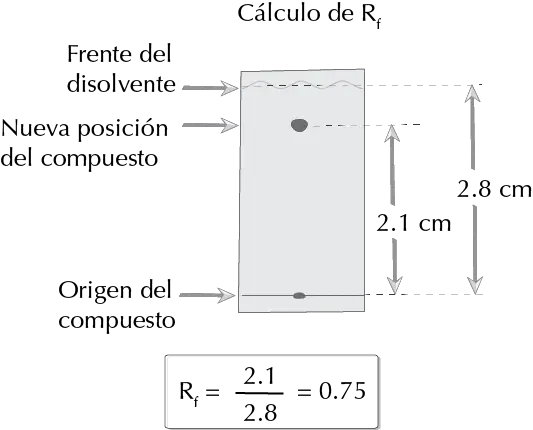
- Determinar el valor del Rf.
| Pigmento | Color | Rf |
| Caroteno | Amarillo–Naranja | 0.93 |
| Feofitina a | Gris | 0.55 |
| Feofitina b | Gris (puede no ser visible) | 0.47-0.54 |
| Clorofila a | Azul-Verde | 0.46 |
| Clorofila b | Verde | 0.42 |
| Xantofilas | Amarillo | 0.41, 0.31, 0.17 |
Para el cálculo de Rf véase el siguiente enlace.
C) Separación cromatográfica de los pigmentos mediante cromatografía en columna CC
- Poner un poco de algodón o lana de vidrio en el fondo de la columna.
- Introducir en la columna 10 ml de eluyente (hexano:acetona, 7:3).
- Pesar 20 g de gel de sílice 40 en un Erlenmeyer de 50 ml y adicionar unos ml de eluyente, agitando con una varilla de vidrio o una espátula, hasta formar una papilla.
- Llenar la columna con la papilla abriendo la llave de la columna, hasta que el líquido quede en el límite justo de la fase estacionaria (es muy importante que la columna nunca se quede seca, total o parcialmente y que no se formen burbujas de aire), recogiendo el disolvente en recipiente para reutilizarlo.
- Se puede añadir arena a la gel de sílice hasta formar una capa de 1 o 2 centímetros de espesor sobre el límite de la fase estacionaria.
- Tomar con una pipeta, 10 ml de la muestra preparada a partir de la hojas de espinaca y añadirlas a la columna.
- Añadir eluyente abriendo la llave de la columna y recogiendo el mismo en un Erlenmeyer.
- Cuando se acerque una banda de coloración amarilla (β-caroteno) recoger el líquido en un tubos de ensayo.
- Cambiar de tubo de ensayo cuando el tubo empiece a llenarse o cambie de color el contenido del mismo.
Propiedades fisico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| Acetona | 58.08 | -94 | 56 | 0.791 |
| Hexano | 86.18 | -95 | 69 | 0.659 |
| CaCO3 | 100.09 | 800 | - | 2.93 |
| Clorofila a | 893.49 | 150-153 | - | - |
| Clorofila b | 907.47 | 183-185 | - | - |
| β-Caroteno | 536.87 | 176-184 | - | 1.000 |
| NaCl | 58.44 | 801 | 1,413 | 2.165 |
| Na2SO4 | 142.04 | 884 | - | 2.630 |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| Acetona |   |
| Hexano |     |
| CaCO3 | No peligroso |
| Clorofila a | No peligroso |
| Clorofila b | No peligroso |
| β-Caroteno | No peligroso |
| NaCl | No peligroso |
| Na2SO4 | No peligroso |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| Acetona | CSCPPACGZOOCGX-UHFFFAOYSA-N |
| Hexano | VLKZOEOYAKHREP-UHFFFAOYSA-N |
| CaCO3 | VTYYLEPIZMXCLO-UHFFFAOYSA-L |
| Clorofila a | ATNHDLDRLWWWCB-AENOIHSZSA-M |
| Clorofila b | NSMUHPMZFPKNMZ-VBYMZDBQSA-M |
| β-Caroteno | OENHQHLEOONYIE-JLTXGRSLSA-N |
| NaCl | FAPWRFPIFSIZLT-UHFFFAOYSA-M |
| Na2SO4 | PMZURENOXWZQFD-UHFFFAOYSA-L |
Referencias y notas
- [1] Esta experiencia puede realizarse con otras hojas verdes si no se dispone de espinacas. Es interesante realizar también esta experiencia con otras sustancias como tinta china
- [2] La línea deberá quedar por encima del nivel de disolvente cuando el cromatofolio se introduzca en la cubeta.
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
- M. H. Anwar, Separation of plant pigments by thin layer chromatography, Journal of Chemical Education 40 (1963), no. 1, 29, DOI 10.1021/ed040p29