Written by José | Last Updated on 2 meses
Objetivo
Familiarizar al alumno con la preparación de reactivos de Grignard y su reacción con compuestos carbonílicos para formar alcoholes, en concreto la síntesis de trifenilmetanol (un alcohol) a partir de bromobenceno.
Índice
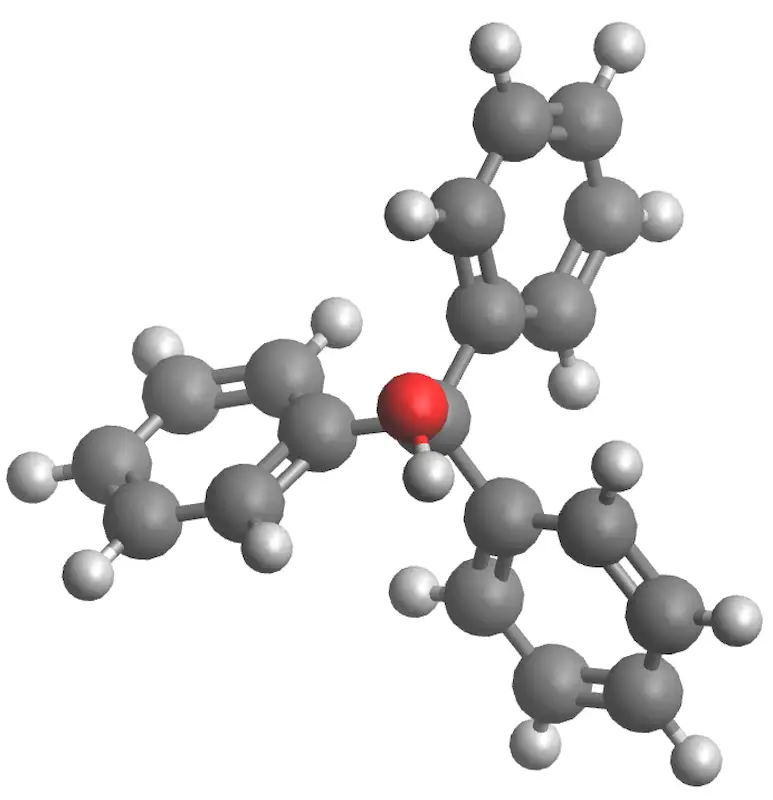 |
| Estructura 3D |
Antecedentes
Uno de los métodos más populares para formar enlaces C-C en síntesis orgánica es mediante el uso de reactivos de Grignard (Nobel de Química en 1912).
La formación de estos implica la reacción de un haluro de alquilo, vinilo o arilo con magnesio e implica un cambio en la naturaleza electrónica del átomo de carbono, que cambia de electrófilo en el haluro a fuertemente nucleófilo en compuestos de organomagnesio.
Los compuestos de Grignard son altamente reactivos, reaccionan con agua, oxígeno, CO2, etc. Por lo tanto, estos compuestos deben prepararse en condiciones anhidras utilizando una atmósfera inerte. Tienen un carácter fuertemente nucleofílico (y básico) y producen adiciones a los grupos carbonilo, con la formación de un nuevo enlace C-C, dando lugar a alcoholes cuya naturaleza depende del tipo de compuesto carbonílico de partida utilizado.
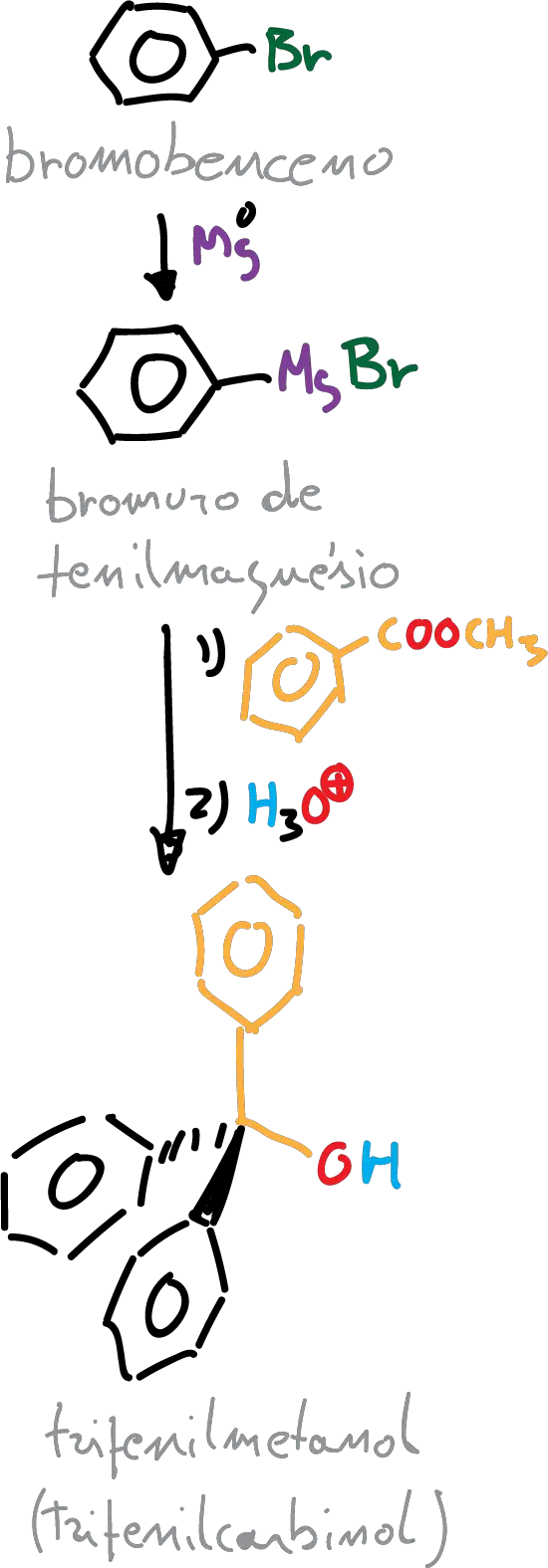
En este experimento, el reactivo elegido es un éster (benzoato de metilo), por lo que el producto formado es un alcohol terciario, en este caso particular el trifenilmetanol (trifenilcarbinol).
Mecanismo de reacción
El mecanismo de reacción comienza con una primera etapa donde el reactivo de Grignard se disocia para formar un carbanión (carga negativa) que ataca al carbono carbonílico con carga parcial positiva.
La adición nucleofílica del reactivo de Grignard al benzoato de metilo provoca que el metóxido sea el grupo saliente del intermedio y se forme benzofenona.
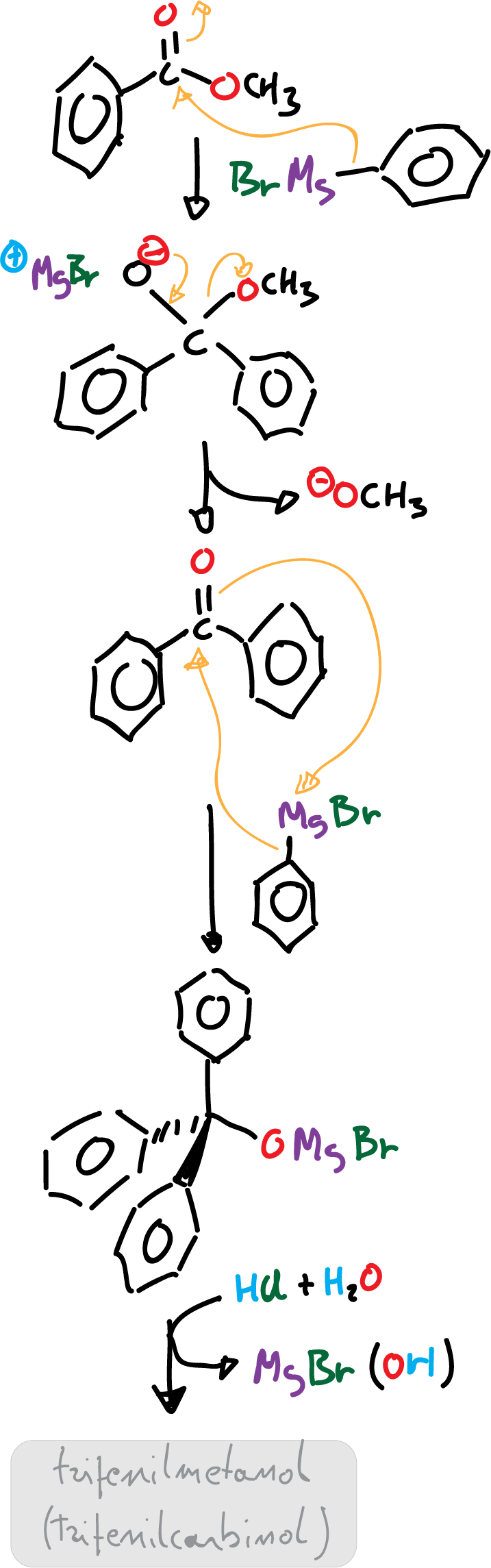
Dado que la benzofenona consta también de un carbono carbonílico más reactivo (porque está unido a dos grupos fenilo), favorece el segundo ataque nucleofílico del reactivo de Grignard y se produce el anión (Ph)3CO- con tres anillos de fenilo. El medio ácido de la reacción protona el anión (Ph)3CO- para generar el trifenilmetanol, (Ph)3C-OH como producto.
Procedimiento experimental
A) Preparación de bromuro de fenilmagnesio:
Coloque 2 g de virutas de magnesio y 15 ml de éter anhidro en un matraz de fondo redondo seco. Se le acoplan al matraz los elementos necesarios para un montaje de reflujo bajo condiciones anhidras y con adición de reactivos.
Se prepara una disolución de 9 g de bromobenceno en 10 ml de éter anhídro y se coloca en el embudo de adición. Entonces, se prepara una atmósfera inerte dejando pasar argón a través del sistema durante unos minutos y colocando un globo lleno de argón sobre un septum. Añada aproximadamente 2 ml de disolución de bromobenceno sobre el magnesio y agitar vigorosamente la reacción. Después de unos minutos, aparecerán burbujas y una turbidez (también ocurre calentamiento). Entonces, continuamos añadiendo bromobenceno gota a gota durante 30 min con el embudo de adición.
Una vez terminada la adición, lavamos el embudo con unos mililitros de éter. Mantenga el reflujo durante aproximadamente 15-20 min más, calentando suavemente si es necesario.
Se forma un crudo de reacción blanquecina, que no debe contener magnesio. Deje enfriar a temperatura ambiente. y usar sin aislamiento en el siguiente paso.
B) Síntesis de trifenilmetanol
Se utiliza el mismo montaje que en el paso anterior. Se prepara una disolución de 5 g de benzoato de metilo en 15 ml de éter anhidro y se transfiere esta disolución al embudo de adición. Comience a agregar esta disolución gota a gota al compuesto organomagnésico.
Cuando finalice la adición, refluir durante otros 30 min. Luego, verter el crudo de reacción en un vaso de precipitados con 50 ml de H2SO4 (10 %) y aproximadamente 25 g de hielo. Arrastre los restos del matraz con pequeñas porciones de una solución fría de H2SO4. Revuelva la mezcla, y cuando todo el hielo esté derretido, transfiéralo a un embudo y decante (agregue una pequeña cantidad de éter si hay una disminución significativa de volumen).
Vuelva a extraer la capa acuosa con éter (15 ml). Combinar los extractos etéreos y secar sobre sulfato sódico anhidro; luego filtrar y decantar a un matraz con 25 ml de hexano. La mezcla se transfiere a un rotavapor para producir un sólido. Filtrar, lavar con hexano, secar y pesar el sólido.
Propiedades físico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| Ácido acético | 60.05 | 16.2 | 118 | 1.049 |
| Ácido benzoico | 122.12 | 125 | 249 | 1.08 |
| Bután-1-ol | 74.12 | -90 | 116-118 | 0.810 |
| Acetato de butilo | 116.16 | -78 | 124-126 | 0.880 |
| Benzoato de butilo | 178.23 | - | 249 | 1.010 |
| Éter dietílico | 74.12 | -116 | 34.6 | 0.71 |
| EtOH | 46.07 | -114.1 | 78.5 | 0.790 |
| Benzoato de etilo | 150.17 | -34 | 212 | 1.045 |
| H2SO4 | 98.08 | 3 | - | 1.80-1.84 |
| Salicilato isoamílico | 208.25 | - | 277-278 | 1.05 |
| Acetato de isopentilo | 130.18 | -78 | 142 | 0.876 |
| Benzoato isopropílico | 164.20 | - | - | - |
| Na2SO4 | 142.04 | 884 | - | 2.630 |
| NaHCO3 | 84.01 | 300 | - | 2.160 |
| Octan-1-ol | 130.23 | -15 | 196 | 0.824 |
| Acetato de octilo | 176.26 | - | 211 | 0.867 |
| Acetato de fenetilo | 164.20 | - | 238-239 | 1.032 |
| Alcohol fenetílico | 122.16 | -27 | 219-221 | - |
| Salicilato de fenilo | 242.27 | 39-41 | 370 | 1.154 |
| Propano-2-ol | 60.10 | -89.50 | 82 | - |
| Ácido salicílico | 138.12 | 158-161 | 211 | 1.440 |
| 3-metil-butan-1-ol | 88.15 | -117 | 131-132 | - |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| Ácido acético |   |
| Ácido benzoico |   |
| Bután-1-ol |    |
| Acetato de butilo |   |
| Benzoato de butilo |  |
| Éter dietílico |   |
| EtOH |  |
| Benzoato de etilo | No peligroso |
| H2SO4 |  |
| Salicilato isoamílico | No peligroso |
| Acetato de isopentilo |   |
| Benzoato isopropílico |  |
| Na2SO4 | No peligroso |
| NaHCO3 | No peligroso |
| Octan-1-ol |  |
| Acetato de octilo | No peligroso |
| Acetato de fenetilo | No peligroso |
| Alcohol fenetílico |   |
| Salicilato de fenilo |  |
| Propano-2-ol |   |
| Ácido salicílico |   |
| 3-metil-butan-1-ol |   |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| Ácido acético | QTBSBXVTEAMEQO-UHFFFAOYSA-N |
| Ácido benzoico | WPYMKLBDIGXBTP-UHFFFAOYSA-N |
| Bután-1-ol | LRHPLDYGYMQRHN-UHFFFAOYSA-N |
| Acetato de butilo | DKPFZGUDAPQIHT-UHFFFAOYSA-N |
| Benzoato de butilo | XSIFPSYPOVKYCO-UHFFFAOYSA-N |
| Éter dietílico | RTZKZFJDLAIYFH-UHFFFAOYSA-N |
| EtOH | LFQSCWFLJHTTHZ-UHFFFAOYSA-N |
| Benzoato de etilo | MTZQAGJQAFMTAQ-UHFFFAOYSA-N |
| H2SO4 | QAOWNCQODCNURD-UHFFFAOYSA-N |
| Salicilato isoamílico | PMGCQNGBLMMXEW-UHFFFAOYSA-N |
| Acetato de isopentilo | MLFHJEHSLIIPHL-UHFFFAOYSA-N |
| Benzoato isopropílico | FEXQDZTYJVXMOS-UHFFFAOYSA-N |
| Na2SO4 | PMZURENOXWZQFD-UHFFFAOYSA-L |
| NaHCO3 | UIIMBOGNXHQVGW-UHFFFAOYSA-M |
| Octan-1-ol | KBPLFHHGFOOTCA-UHFFFAOYSA-N |
| Acetato de octilo | YLYBTZIQSIBWLI-UHFFFAOYSA-N |
| Acetato de fenetilo | MDHYEMXUFSJLGV-UHFFFAOYSA-N |
| Alcohol fenetílico | WRMNZCZEMHIOCP-UHFFFAOYSA-N |
| Salicilato de fenilo | YNMSDIQQNIRGDP-UHFFFAOYSA-N |
| Propano-2-ol | KFZMGEQAYNKOFK-UHFFFAOYSA-N |
| Ácido salicílico | YGSDEFSMJLZEOE-UHFFFAOYSA-N |
| 3-metil-butan-1-ol | PHTQWCKDNZKARW-UHFFFAOYSA-N |
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
- R. D. Pointer and M. A. G. Berg, Using a premade Grignard reagent to synthesize tertiary alcohols in a convenient investigative organic laboratory experiment, Journal of Chemical Education 84 (2007), no. 3, 483, DOI: 10.1021/ed084p483
Volver a la página de prácticas de Síntesis Orgánica Avanzada.

