Written by J.A. Dobado | Last Updated on 1 año
Objetivo
El propósito de la práctica es familiarizarse con los métodos de síntesis de colorantes del tipo de las ftaleínas. La síntesis se realiza por condensación de anhídrido ftálico con fenol, y conlleva una reacción (catalizada por ácido) de sustitución electrofílica aromática SEAr.
Índice
La fenolftaleina se purifica por recristalización del producto final. Una vez recristalizada, se observará el comportamiento de la fenolftaleina, como indicador, en medio ácido y en medio básico.
Antecedentes
La fenolftaleína (C20H14O4) es un indicador de pH. En disoluciones ácidas permanece incoloro, pero en presencia de disoluciones básicas toma un color rosado con un punto de viraje entre pH = 8.0 (incoloro) a pH = 9.8 (magenta o rosado).
Sin embargo, a pH extremos (muy ácidos o básicos) presenta otros virajes en la coloración: a pH fuertemente básicos se torna incoloro, mientras que a pH fuertemente ácidos cambia a naranja.
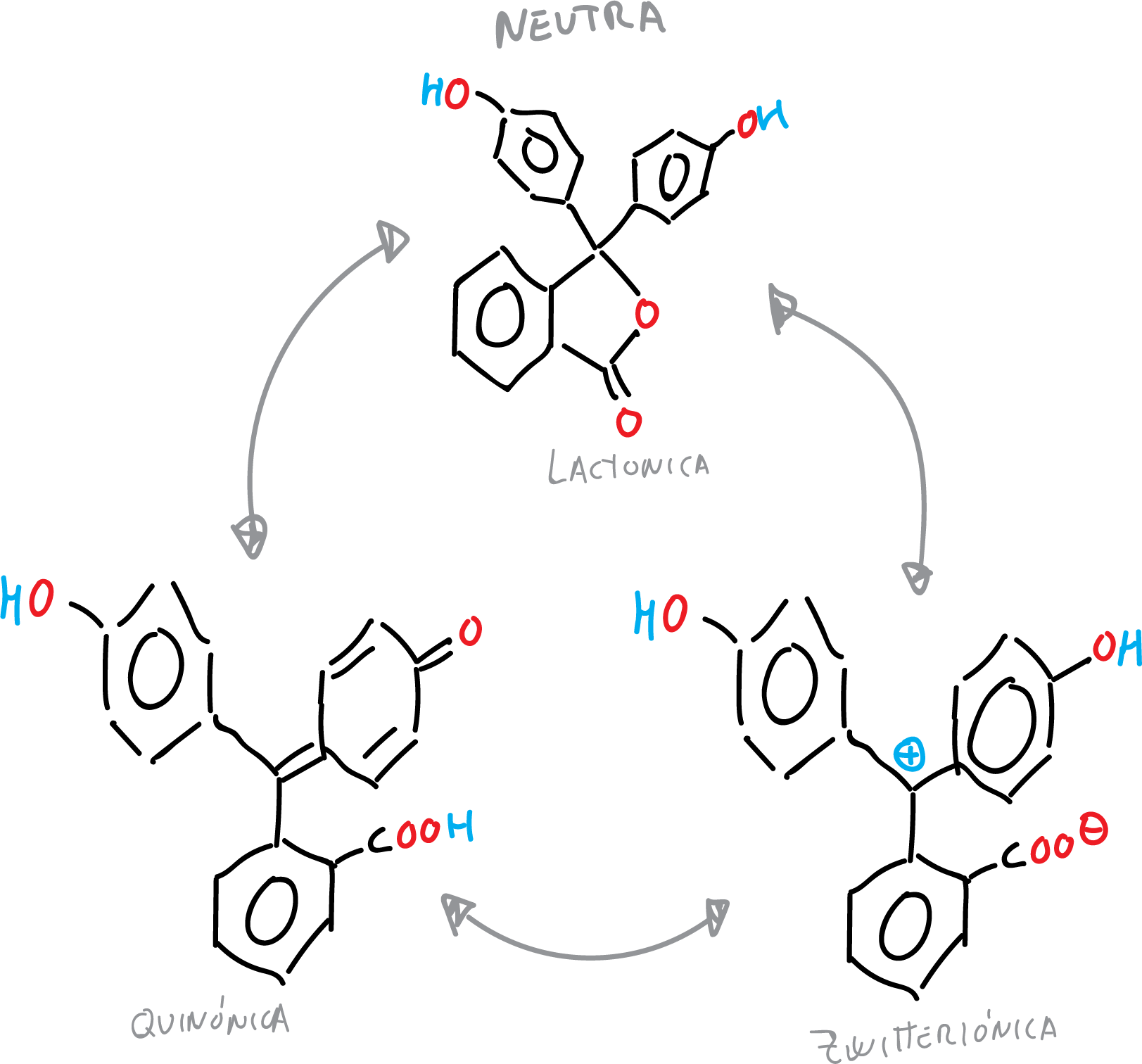
Este cambio de color es debido a la conjugación de los electrones π del derivado de fenolftaleína que a diferente pH absorbe a longitudes de onda de la luz visible. Esta relacionado a la diferente estructura abierta y cerrada del anillo lactónico presente en estos compuestos.
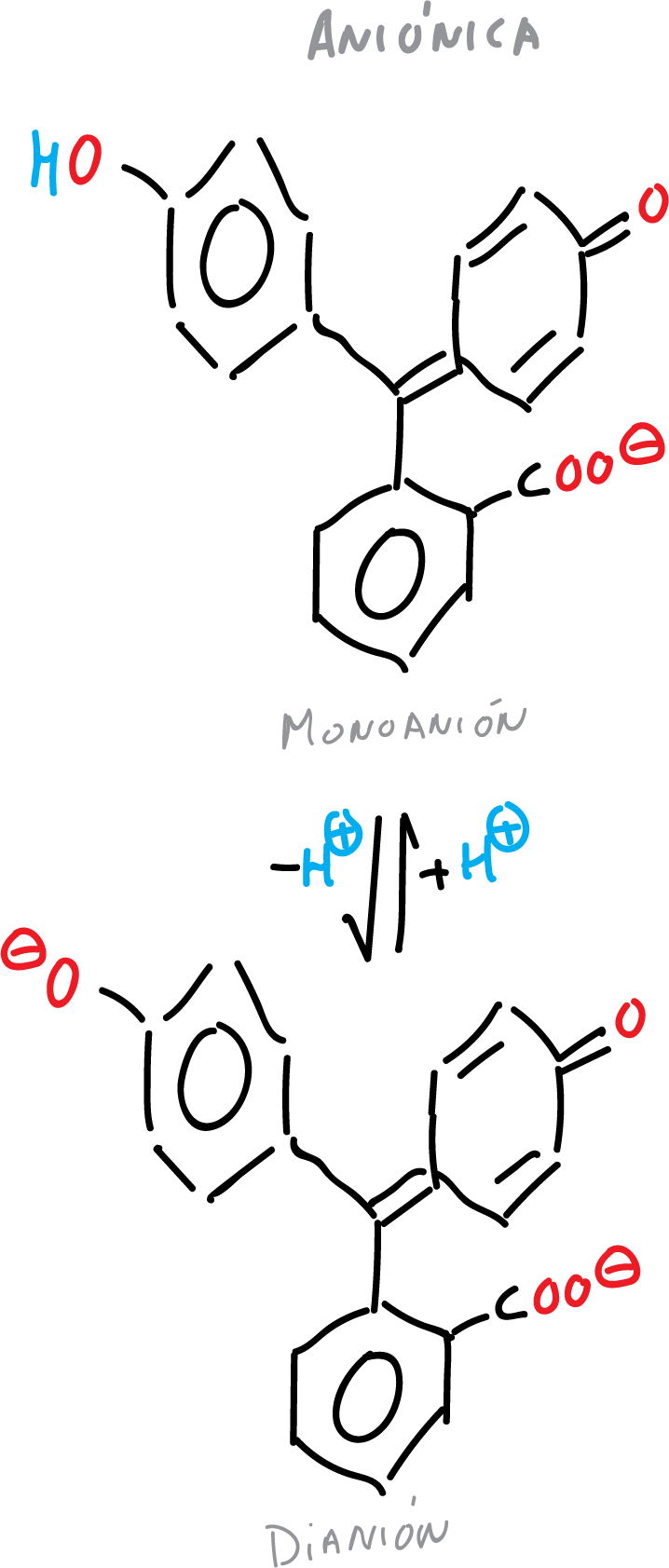
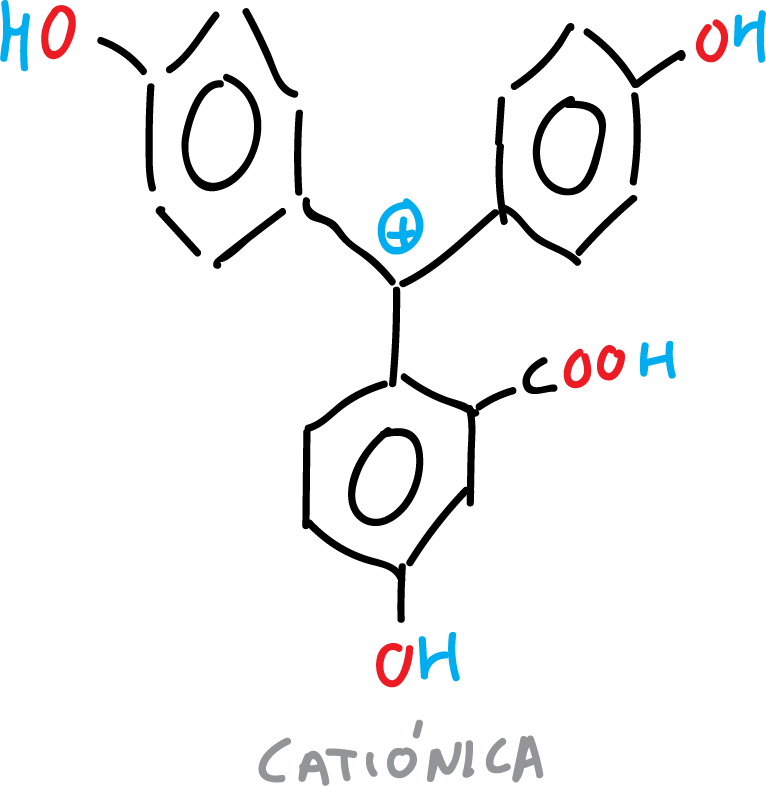
Las diferentes formas de la fenolftaleína se resumen en las siguientes figuras:
- Forma catiónica de la fenolftaleína.
- Forma aniónica de la fenolftaleína (monoanión y dianión).

- Forma neutra de la fenolftaleína (tautomerias: lactónica, zwitteriónica y quinónica).

La fenolftaleína es insoluble en agua y normalmente se disuelve en alcoholes para uso. Es un ácido débil que puede perder protones H⊕ en disolución. Por tanto, las principales aplicaciones de los derivados de ftaleína son como colorantes e indicadores de pH.
Los derivados de ftaleína se pueden sintetizar a partir de la reacción entre dos moles del derivado fenólico con un mol del derivado anhídrido en presencia de diferentes catalizadores, entre los que podemos mencionar: AlCl3, SnCl4, ZnCl2 y H2SO4, entre otros.
Mecanismo de reacción
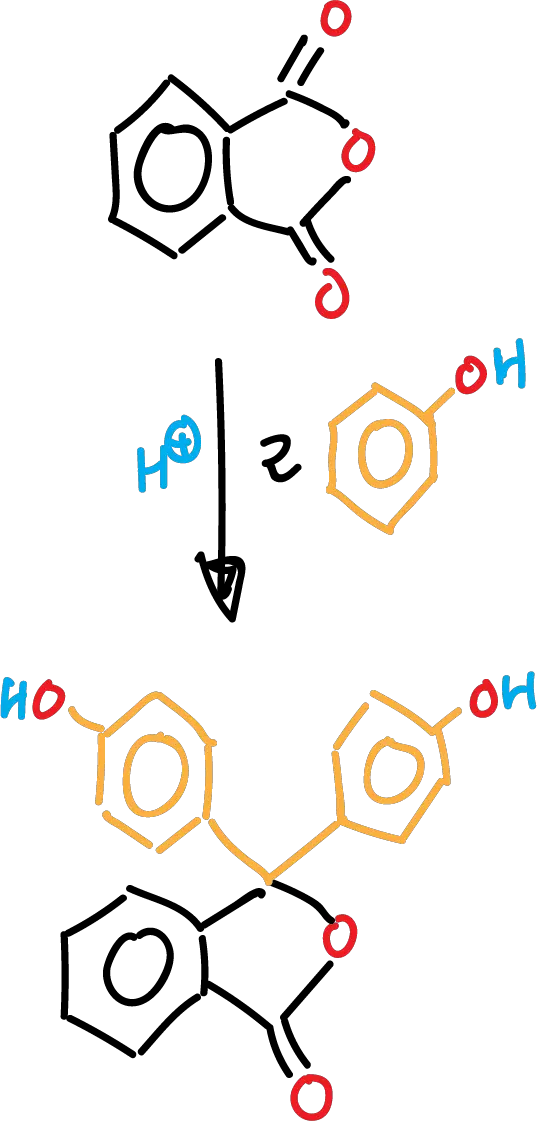
La reacción está catalizada por ácido (ácido metanosulfónico, MeSO4H). El mecanismo de reacción comienza, en un primer paso, con la protonación del anhídrido ftálico como se indica en la figura, dando lugar al carbocatión correspondiente que se encuentra en un equilibrio tautomérico.
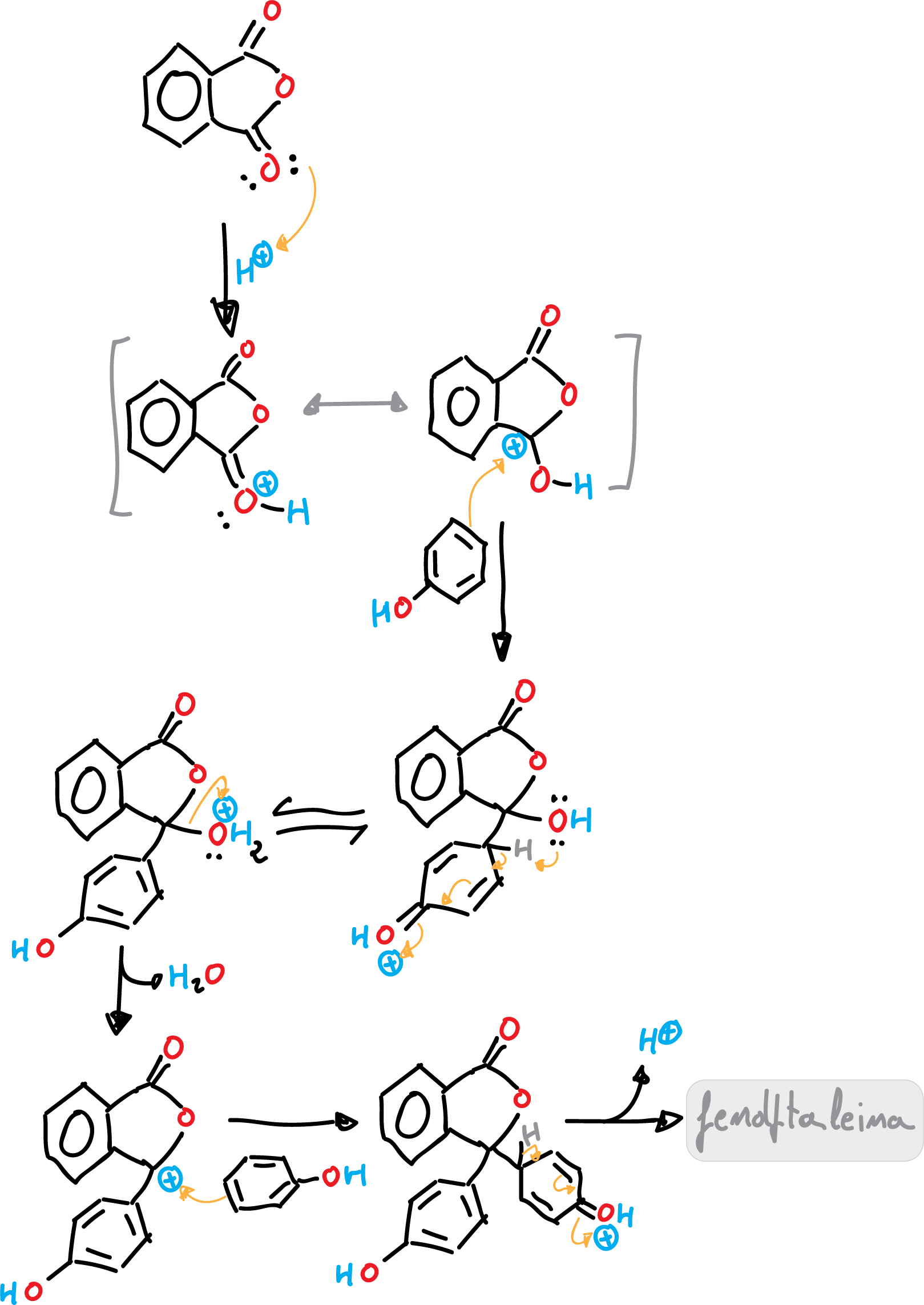
En una segunda etapa, un enlace π del fenol ataca al carbocatión que se ha formado. Se produce el intermedio de Wheland correspondiente de la reacción SEAr. Seguidamente, el par de electrones sin compartir de un oxígeno ataca al hidrógeno en posición para del fenol inicial. Posteriormente, se desprende una molécula de agua, que genera otro carbocatión. La reacción prosigue, con otro ataque SEAr de otra molécula de fenol, y finaliza con la pérdida de un protón para dar la fenolftaleína.
Procedimiento experimental
Se colocan 0.1552 g (1 mmol) de anhídrido ftálico, 0.1881 g (2 mmol) de fenol y ácido metanosulfónico, MeSO4H, 3 ml (0,046 mmol) en un matraz de fondo redondo de 100 ml. Se acopla un refrigerante de reflujo, con agitación magnética, y se coloca el matraz en un baño de aceite. El baño se calienta durante 2 horas a 90.5 ºC, y la reacción se controla por CCF cada 30 minutos.
Una vez completado el proceso, la reacción se finaliza añadiendo 2 mL de metanol, MeOH, al matraz de fondo redondo y enfriando ligeramente, antes de dejarlo enfriar, posteriormente, aún más en un baño de agua helada durante 5 minutos, para permitir la cristalización de la fenolftaleína.
Una vez formado el precipitado, se filtra a vacío y se recogen los cristales de fenolftaleína. El producto se recristaliza de metanol y se obtienen cristales de color marrón tostado. Se calcula el rendimiento del producto seco. El rendimiento estimado es de 73-94 %, y el punto de fusión 259-261 ºC.
Reacción de identificación de la fenolftaleína
Disuelva algunos cristales de fenolftaleína en 1 mL de etanol, agregue 1 mL de agua destilada, agite y agregue unas gotas de solución de sosa. Anote sus observaciones.
Video sobre la Síntesis de Fenolftaleína
International Chemical Identifier
Se aportan los identificadores InChI key de la IUPAC para, los compuestos principales utilizados en la práctica a fin de facilitar la nomenclatura y formulación de compuestos químicos y la búsqueda de información en internet de dichos compuestos.
| ácido clorhídrico | VEXZGXHMUGYJMC-UHFFFAOYSA-N |
| ácido metanosulfónico | AFVFQIVMOAPDHO-UHFFFAOYSA-N |
| anhídrido ftálico | LGRFSURHDFAFJT-UHFFFAOYSA-N |
| etanol | LFQSCWFLJHTTHZ-UHFFFAOYSA-N |
| fenol | ISWSIDIOOBJBQZ-UHFFFAOYSA-N |
| fenolftaleína | KJFMBFZCATUALV-UHFFFAOYSA-N |
| hidróxido sódico | HEMHJVSKTPXQMS-UHFFFAOYSA-M |
| metanol | OKKJLVBELUTLKV-UHFFFAOYSA-N |
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
- Reactions of phenolphthalein at various pH values
Georg Wittke
Journal of Chemical Education 1983 60 (3), 239
DOI: 10.1021/ed060p239 - Phenolphthalein and methyl orange
Charles A. Peters and Bryan C. Redmon
Journal of Chemical Education 1940 17 (11), 525
DOI: 10.1021/ed017p525