Written by J.A. Dobado | Last Updated on 1 año
Objetivo
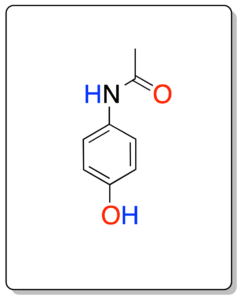
En esta práctica se aborda la síntesis del paracetamol (p-acetamidofenol) en tres pasos a partir de fenol.
Índice
 |
| Estructura 3D |
Antecedentes
El paracetamol (p-acetamidofenol) es un solido cristalino de punto de fusión 169-171 ºC que se usa como analgésico y antipirético, si bien, no presenta acción antiinflamatoria significativa. Comercialmente aparece con diversas denominaciones: Comercialmente aparece con diversas denominaciones Acertol®, Actron®, Antidol®, Apiretal®, Bandol®, Calmanticold®, Cupanol®, Dafalgan®, Dolgesic®, Dolostop®, Duorol®, Efferalgan®, Febrectal®, Gelocatil®, Melabon infantil®, Panadol®, Pediapirin®, Perfalgan®, Resakal®, Sinmol®, Temperal®, Termalgin®, Tylenol®. Por ejemplo, en 1955 fue puesto a la venta en los EEUU bajo el nombre de Tylenol, en 1956, en UK bajo el nombre de Panadol. Es un medicamento (analgésico no opiáceos y antiinflamatorio no esteroideo) que se encuentra en la lista de medicamentos esenciales de la OMS.
La síntesis del paracetamol fue realizada por primera vez por J. von Mering en 1893 aunque no se comercializó hasta 1953, considerándose desde entonces como un principio activo más seguro que la aspirina, especialmente para los niños y pacientes con úlcera de estómago.
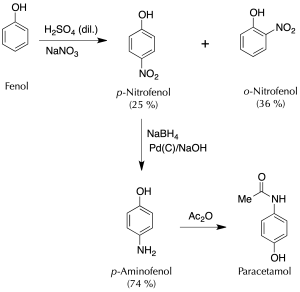
El paracetamol se puede sintetizar en tres etapas a partir del fenol. En la primera etapa se procede a la nitración del fenol y la separación de los isómeros obtenidos. En la segunda, se reduce el grupo nitro hasta grupo amino, y en la tercera, se acetila dicho grupo amino, con anhídrido acético de forma selectiva frente al grupo -OH fenólico.
Procedimiento experimental
| ¡PELIGRO! «Realizar todos los procesos en vitrina de gases.» |
A) Nitración del fenol. Síntesis del p-nitrofenol
A un matraz de 250 ml, enfriado con un baño de hielo se añaden 15 g de nitrato sódico y 40 ml de agua. La mezcla se agita hasta total disolución del sólido, y a continuación, se añaden poco a poco 25 g (13.6 ml) de H2SO4 concentrado. Seguidamente, se adicionan lentamente con ayuda de una espátula 9.4 g de fenol, de manera que la temperatura de la mezcla no supere los 20 ºC, lo cual tardará aprox. unos 20 min.
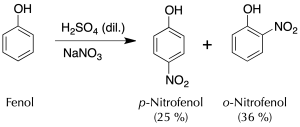
Una vez finalizada la adición, se agita la reacción durante 2 h a temperatura ambiente. En estas condiciones se produce una mezcla del o– y p-nitrofenol.
Con ayuda de una pipeta Pasteur, se elimina el líquido sobrenadante, se añade 30 ml de agua y se realiza un montaje para una destilación por arrastre con vapor con fuente de vapor interna. Se calienta la mezcla, adicionando agua desde el embudo de adición a la misma velocidad que se produce la destilación de los vapores, hasta que deja de destilar el producto (2-nitrofenol).
Cuando se enfría la mezcla que queda en el matraz, se produce la cristalización del otro isómero (4-nitrofenol) que se puede recristalizar usando una disolución de HCl de concentración 0.5 moles / 100 ml.
B) Reducción del grupo nitro hasta amino. Síntesis del p-aminofenol
A un Erlenmeyer de 100 ml se añaden 4 g de NaOH, y 10 ml de agua desionizada. Una vez disuelta la base y que la disolución se haya enfriado hasta temperatura ambiente, se adicionan 0.56 g (14.7 mmol) de NaBH4 y 50 mg de Pd(C) al 5 %.
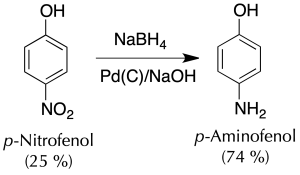
La mezcla se enfría en un baño de hielo/sal (-12 ºC) y una vez fría, se añaden lentamente 1 g (7.2 mmol) de p-nitrofenol con agitación magnética durante 30 minutos, manteniendo la temperatura de la reacción en torno a los 15 ºC. Compruébese la temperatura en el interior del Erlenmeyer con un termómetro sin que el imán golpee al bulbo.
Una vez finalizada la adición se mantiene la agitación a temperatura ambiente durante otros 15 min.
A continuación, el crudo de reacción se acidifica con HCl de concentración 6 M.
El catalizador se filtra a vacío y al filtrado se le ajusta el pH hasta 8 por adición de NaHCO3 en pequeñas porciones. El precipitado se filtra a vacío, se seca y se pesa para usar en la siguiente etapa. (rendimiento estimado 75 %).
C) Síntesis del paracetamol. Formación de amida
En un Erlenmeyer conteniendo 3.3 g de de p-aminofenol y 9 ml de agua, se añaden gota a gota con precaución 3.6 ml de anhídrido acético, agitando constantemente la mezcla. A continuación, se calienta en un baño de agua a 60 ºC hasta la disolución completa del sólido.
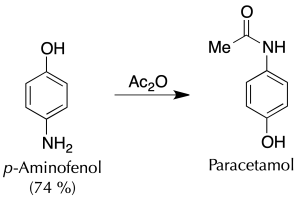
Se mantiene la agitación durante 10 min adicionales y seguidamente se enfría la disolución en un baño de hielo hasta la aparición de un producto cristalino levemente rosado. Los cristales que aparecen en el crudo de reacción se filtran a vacío en un Büchner.
Propiedades físico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| Anhídrido acético | 102.09 | -73.1 | 139.8 | 1.080 |
| Ácido benzoico | 122.12 | 125 | 249 | 1.08 |
| Fenol | 94.11 | 40-42 | 182 | 1.07 |
| o-Nitrofenol | 139.11 | 45 | 214 | - |
| p-Acetamidofenol | 151.16 | 168-172 | - | - |
| p-Nitrofenol | 139.11 | 110-115 | 279 | 1.480 |
| 4-Aminofenol | 109.13 | 185-189 | - | - |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| Anhídrido acético |    |
| Ácido benzoico |   |
| Fenol |    |
| o-Nitrofenol |  |
| p-Acetamidofenol |  |
| p-Nitrofenol |   |
| 4-Aminofenol |    |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| Anhídrido acético | WFDIJRYMOXRFFG-UHFFFAOYSA-N |
| Ácido benzoico | WPYMKLBDIGXBTP-UHFFFAOYSA-N |
| Fenol | ISWSIDIOOBJBQZ-UHFFFAOYSA-N |
| o-Nitrofenol | IQUPABOKLQSFBK-UHFFFAOYSA-N |
| p-Acetamidofenol | RZVAJINKPMORJF-UHFFFAOYSA-N |
| p-Nitrofenol | BTJIUGUIPKRLHP-UHFFFAOYSA-N |
| 4-Aminofenol | PLIKAWJENQZMHA-UHFFFAOYSA-N |
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
- F. Ellis, C. Osborne, and M. J. Pack, Paracetamol: A Curriculum Resource, Royal Society of Chemistry, 2002.
