Written by José | Last Updated on 3 meses
Ir a la página con el listado de problemas.
Transformaciones en Compuestos Aromáticos Sustituidos – soluciones a los problemas
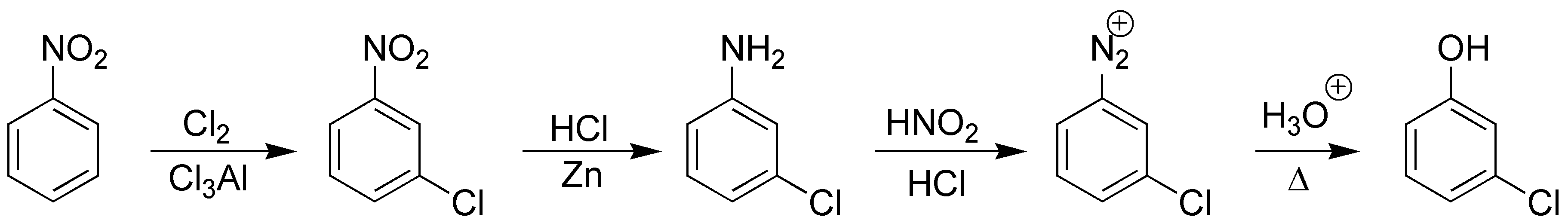
Solución 1:
La clave de ambas transformaciones será la funcionalización de la posición bencílica y la mejor manera de conseguirlo es mediante halogenación radicalaria, la eliminación con potasa alcohólica producirá el estireno a) y la sustitución nucleofílica con agua nos dará el alcohol bencílico que por posterior oxidación suave con bióxido de manganeso nos dará el compuesto carbonílico (acetofenona) b).
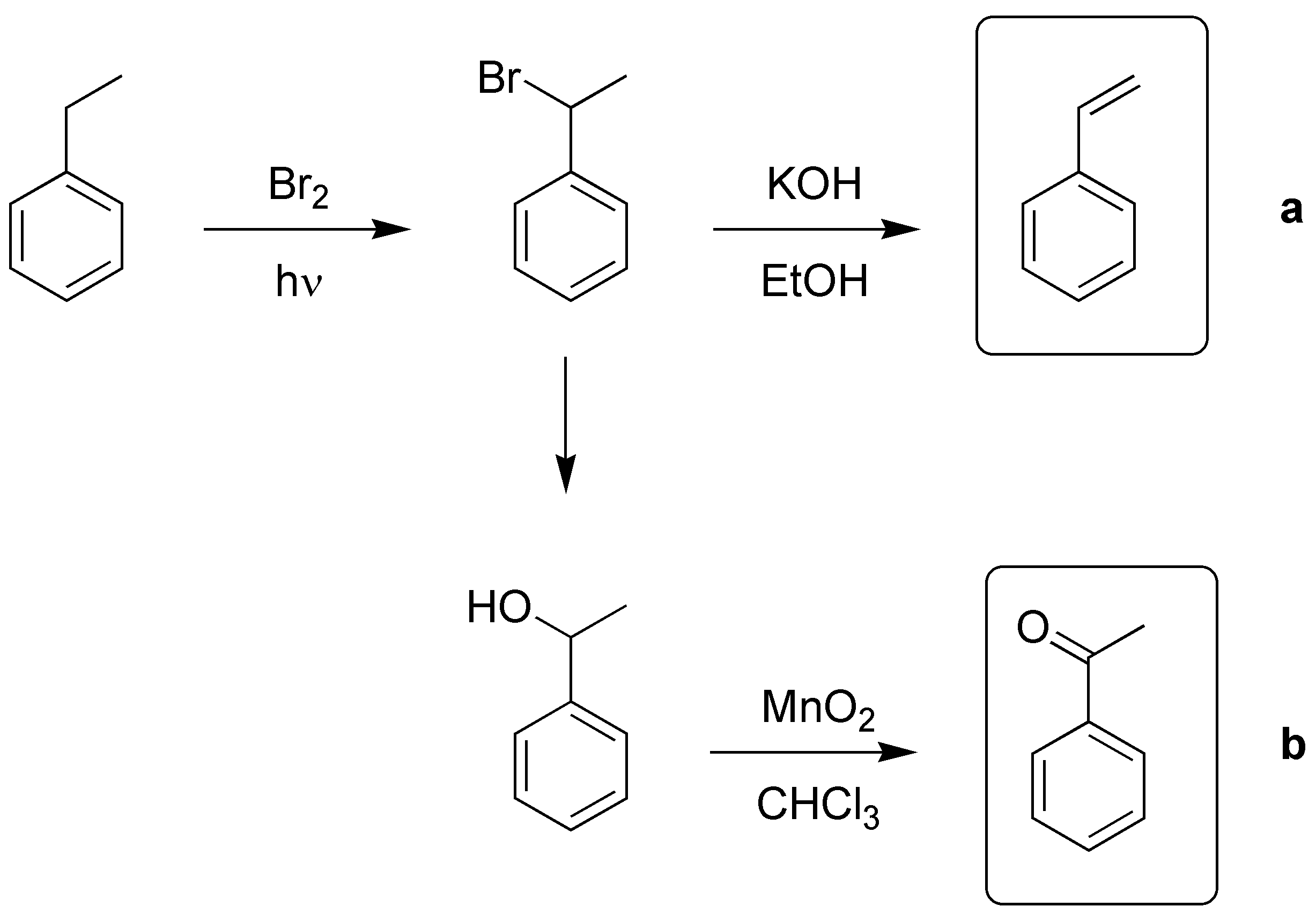
Solución 2:
Se producirá la oxidación del metilo a ácido carboxílico:
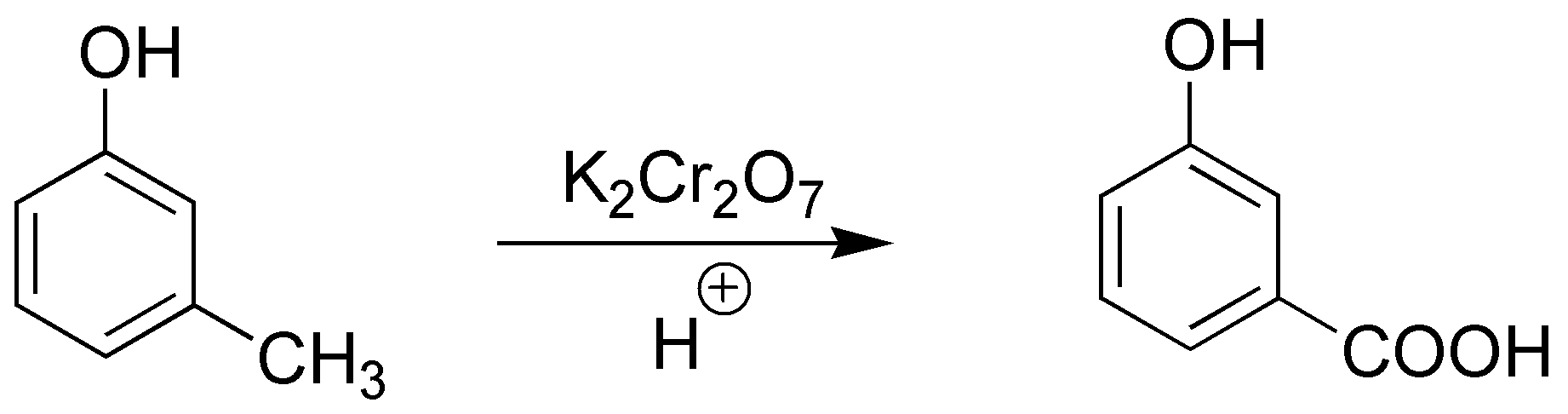
El grupo -OH no se altera en esta reacción.
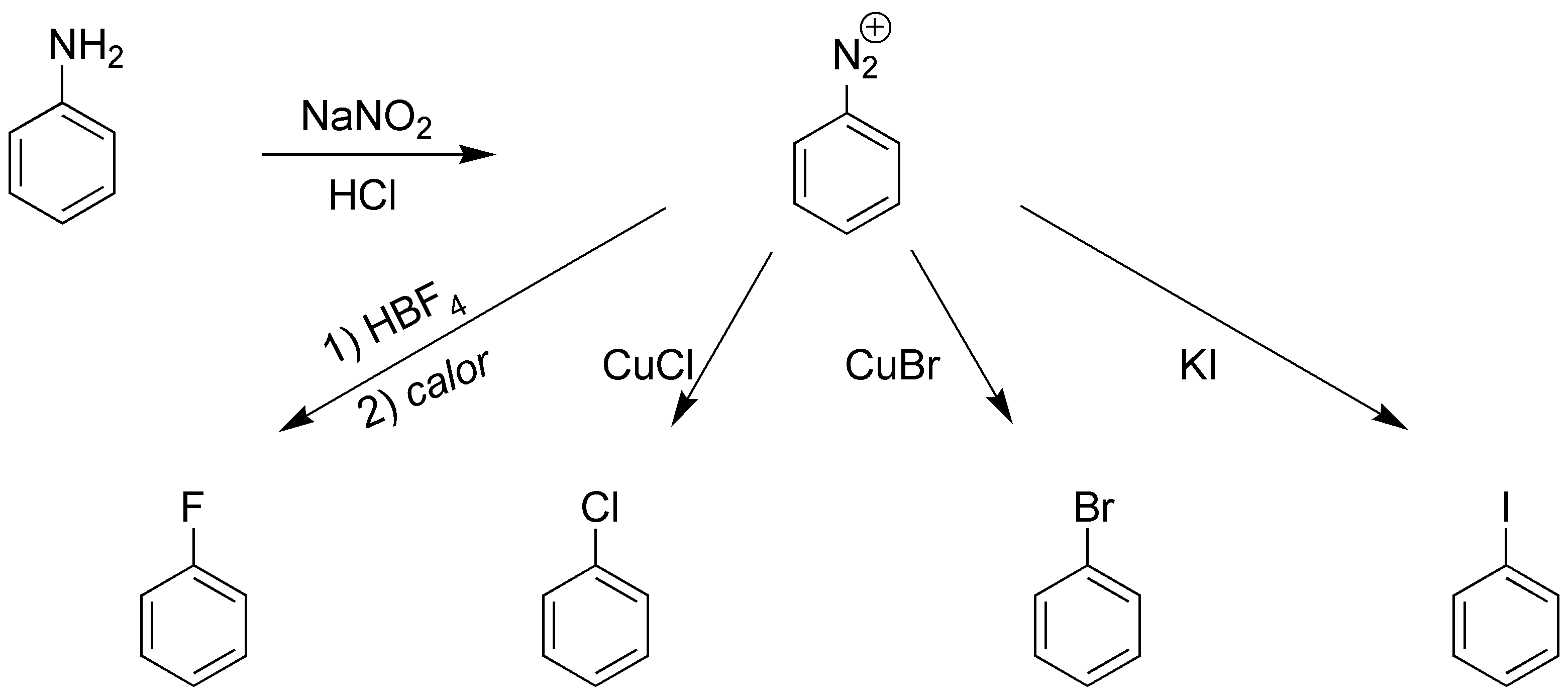
Solución 3:
La mejor manera es a través de la sal de diazonio, estas en presencia de sales cuprosas de los correspondientes haluros para el Cl y el Br permiten la obtención de los halobencenos (reacciones tipo Sandmmeyer y Rosenmund). El I- se introduce mediante KI y el F- requiere el empleo de tetrafluoroborato.
Solución 4:
Las sales de diazonio son unos excelentes electrófilos por lo que reaccionaran con otros compuestos aromáticos dando diazocompuestos:
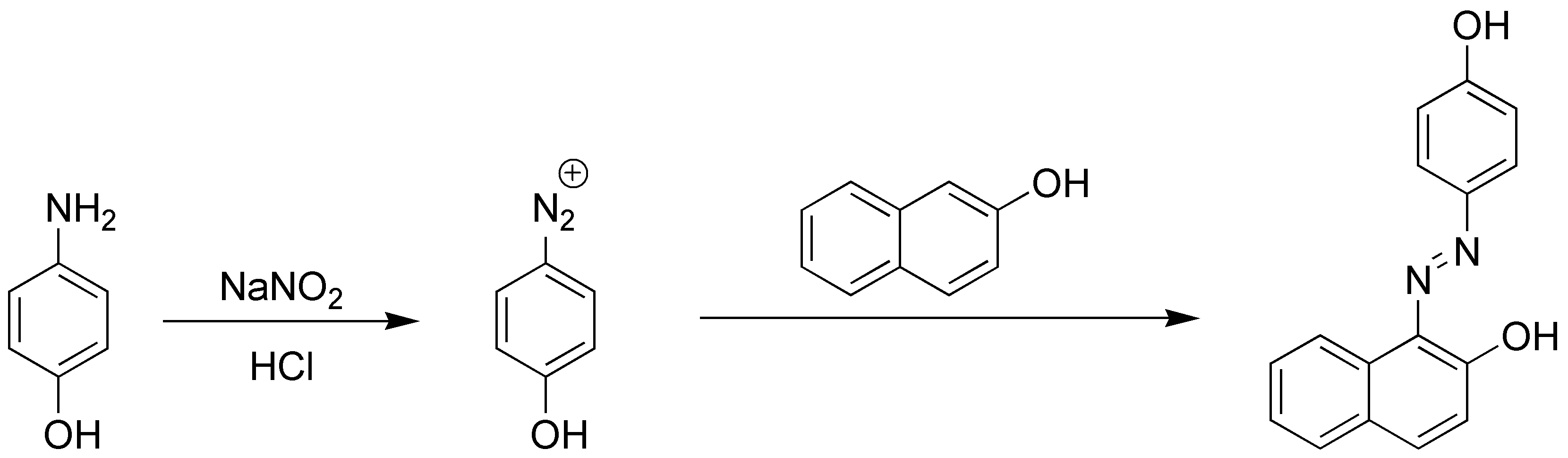
El ataque del electrófilo se produce preferentemente en la posición 1 del naftaleno.
Solución 5:
Otra interesante aplicación de las sales de diazonio es la conversión en sulfuros mediante la reacción con tioles:
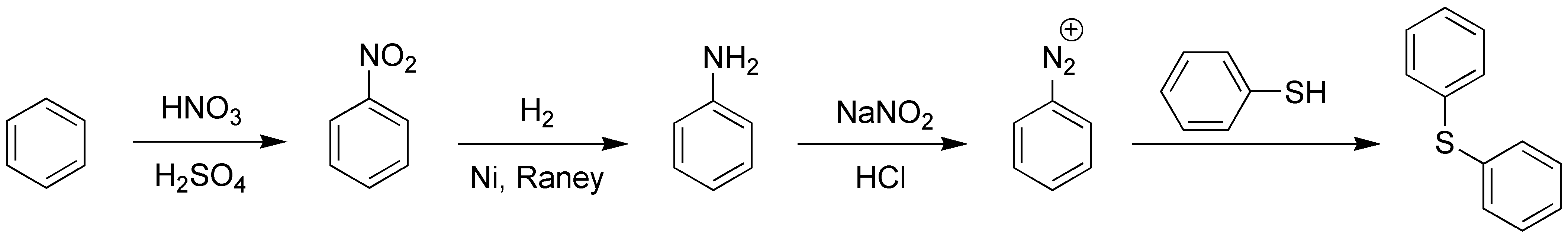
Solución 6:
a) A partir de benceno se puede obtener bromobenceno, que por alquilación Friedel-Crafts nos da el producto deseado junto al isómero orto-.
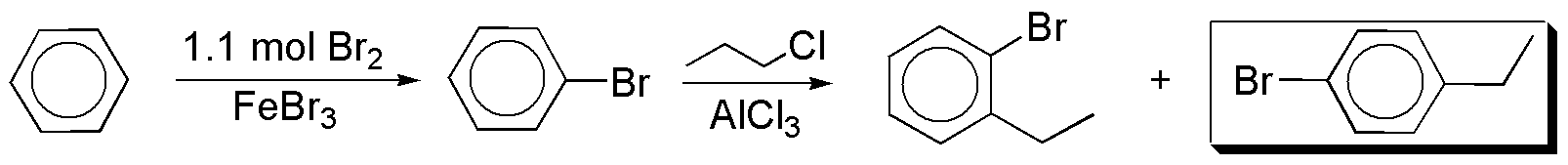
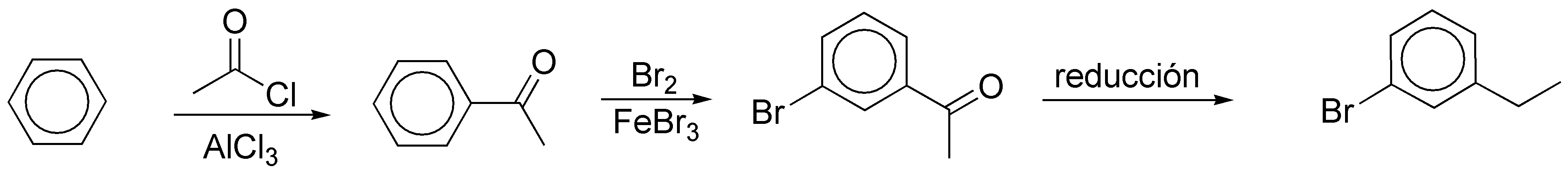
b) Para la introducción de los grupos en una disposición relativa meta- se requiere una estrategia de síntesis diferente. Cuando se dispone de una cadena alquílica y un grupo en meta- el procedimiento habitual es realizar una reacción de acilación Friedel-Crafts, y posteriormente una segunda sustitución aromática electrofílica, para introducir el grupo deseado. Seguidamente, se reduce el grupo carbonilo con un reactivo compatible con las funciones presentes en el compuesto aromático.
c) La clave de la preparación del compuesto deseado radica en:
- Un grupo carboxilo se puede generar por oxidación de una cadena alquílica.
- Introducir un grupo en posición orto- antes de transformar dicha cadena en carboxilo ya que COOH es meta-dirigente.
- Bloquear la posición para- evitando la obtención del correspondiente isómero. La forma convencional de bloquear una posición en un anillo de benceno es mediante una reacción de sulfonación, ya que el grupo SO3H se puede eliminar por suave calentamiento en medio ácido.
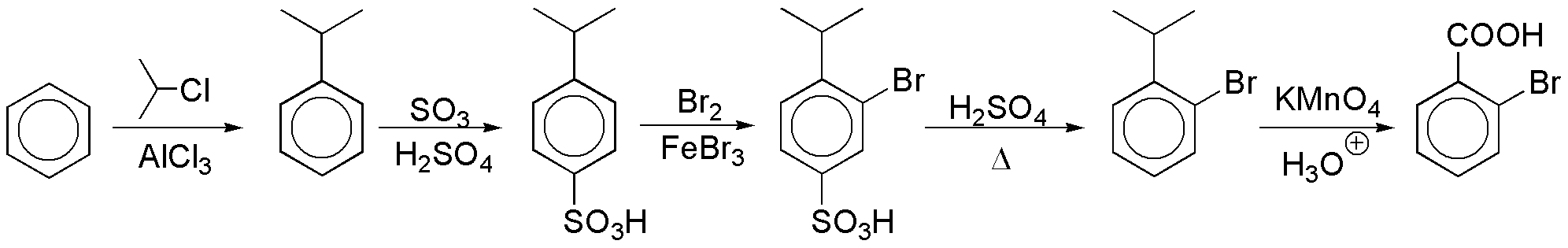
En la primera reacción se ha utilizado un grupo voluminoso con el objetivo de favorecer la orientación en para- de forma exclusiva, evitando por efectos estéricos la formación, en este paso, del isómero orto-.
d) Las reacciones de polisustitución se favorecen con grupos fuertemente activantes y orto- y para-dirigentes. En este sentido, podrían ser útiles los grupos OH y NH2. Estos deben eliminarse en una segunda fase de la síntesis. El NH2 tiene estas características, ya que las sales de diazonio se hidrolizan con H3PO2, y dichas sales se obtienen a partir de los grupos NH2.
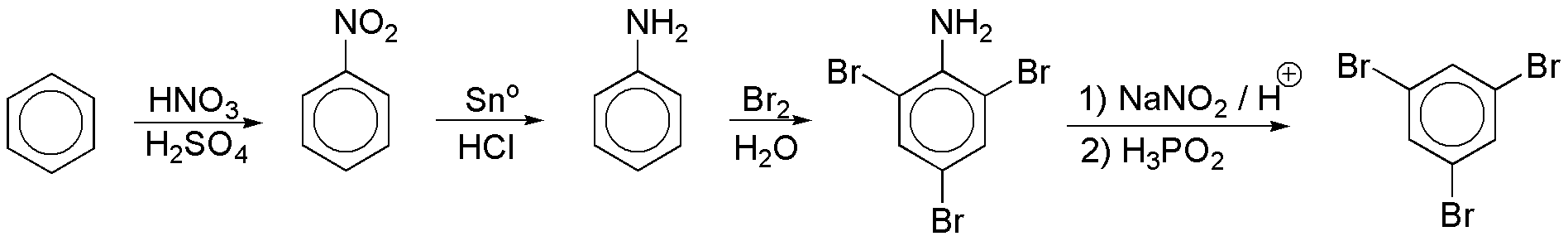
e) Para la síntesis de este compuesto se pueden seguir dos rutas:
La primera ruta resulta más favorable, ya que el grupo COCH3 es moderadamente desactivante, mientras que el grupo NO2 es fuertemente desactivante.
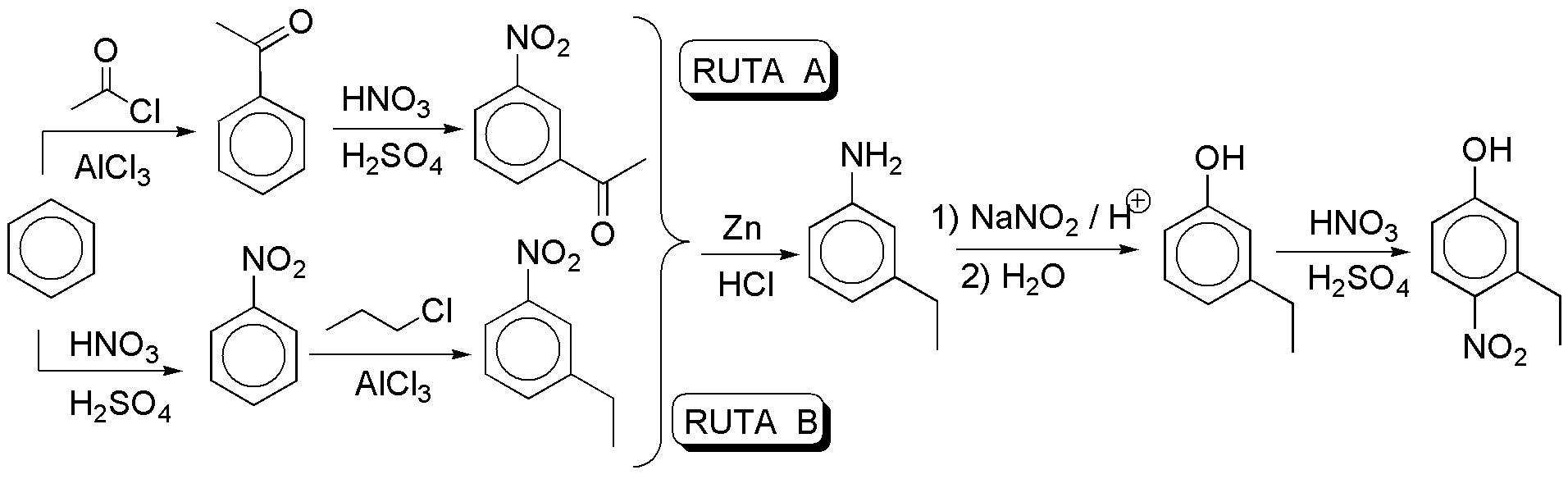
f) Los azocompuestos se preparan con ayuda de sales de diazonio, que a su vez se obtienen a partir de aminas. Se puede usar como único producto de partida benceno, ya que el fenol, necesario para la obtención del diazocompuesto, es posible prepararlo a partir de la sal de diazonio, por suave calentamiento en medio acuoso.
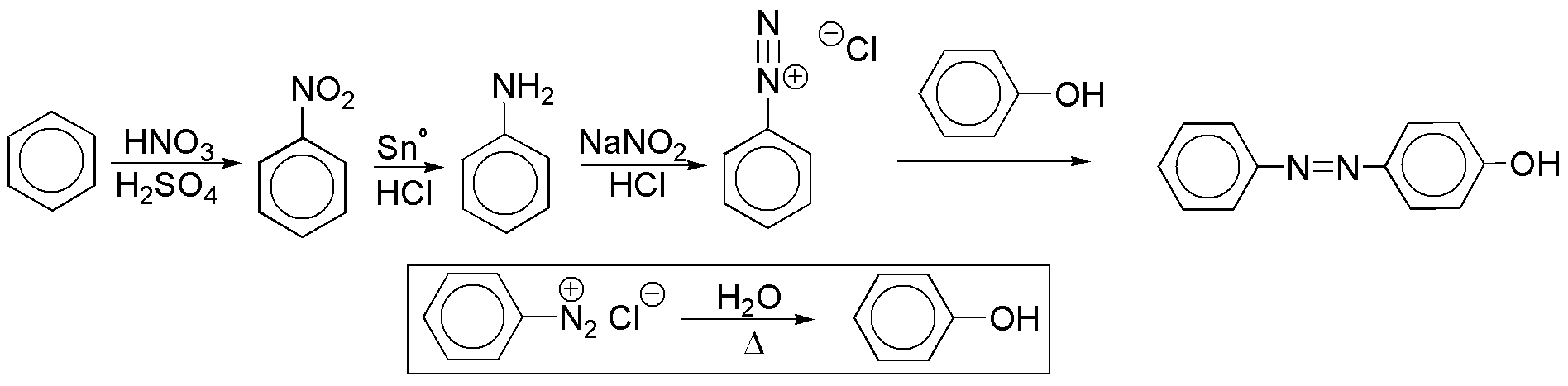
Solución 7:
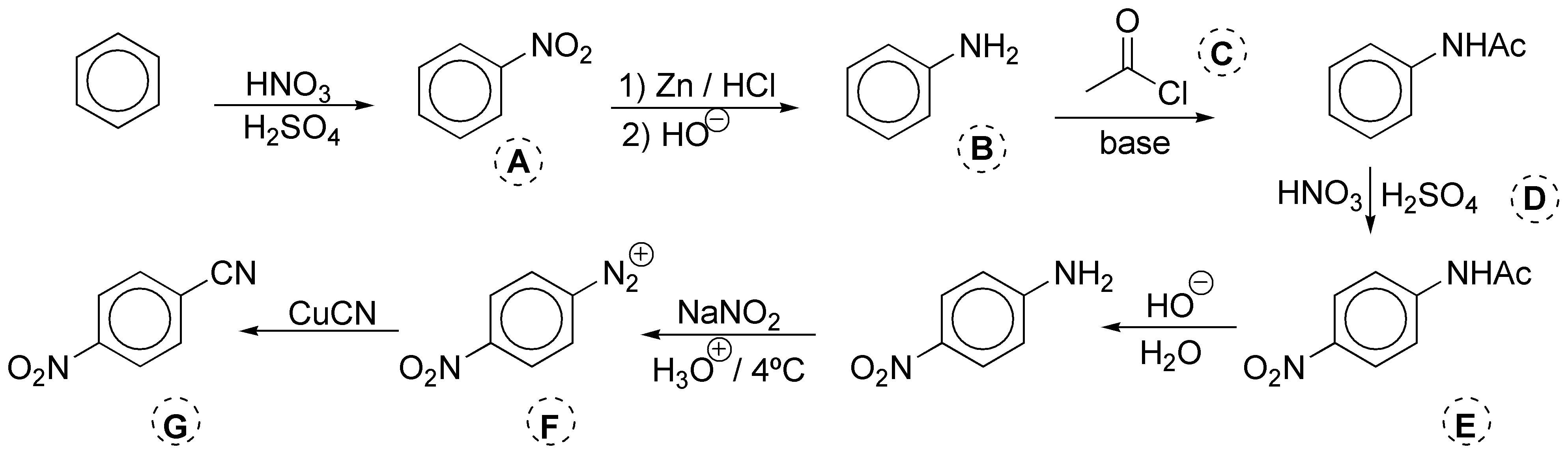
La primera reacción es una nitración, por lo que A es nitrobenceno. A continuación, se procede a reducir el grupo nitro con Zn y HCl. El resultado es la obtención del clorohidrato de anilina, ya que el medio es ácido. Para aislar la anilina B es necesario tratar con una base. Seguidamente se lleva a cabo la acilación de la amina con anhídrido acético y una base o bien con cloruro de acetilo, también en presencia de una base C. De esta forma, se amortigua la reactividad de la anilina y se protege el grupo amino, frente al siguiente paso que es una nueva reacción de nitración con ácido nítrico catalizada con ácido sulfúrico D. Una vez introducido el grupo NO2 se libera el NH2 de su protección mediante una hidrólisis ácida o básica. La hidrólisis ácida presenta el inconveniente de que hay que tratar con una base para liberar la amina, ya que lo que realmente se aisla en este paso es el clorohidrato de la amina, por lo que se elige la hidrólisis básica, E (HO–, H2O). Con nitrito sódico en medio ácido se produce la sal de diazonio F. La reacción se realiza a baja temperatura, dado que este tipo de compuestos son inestables y descomponen con facilidad. Por último se introduce un grupo CN, mediante una reacción de Sandmmeyer, para lo cual se usa la correspondiente sal de cobre(I) del cianuro G.
Solución 8:
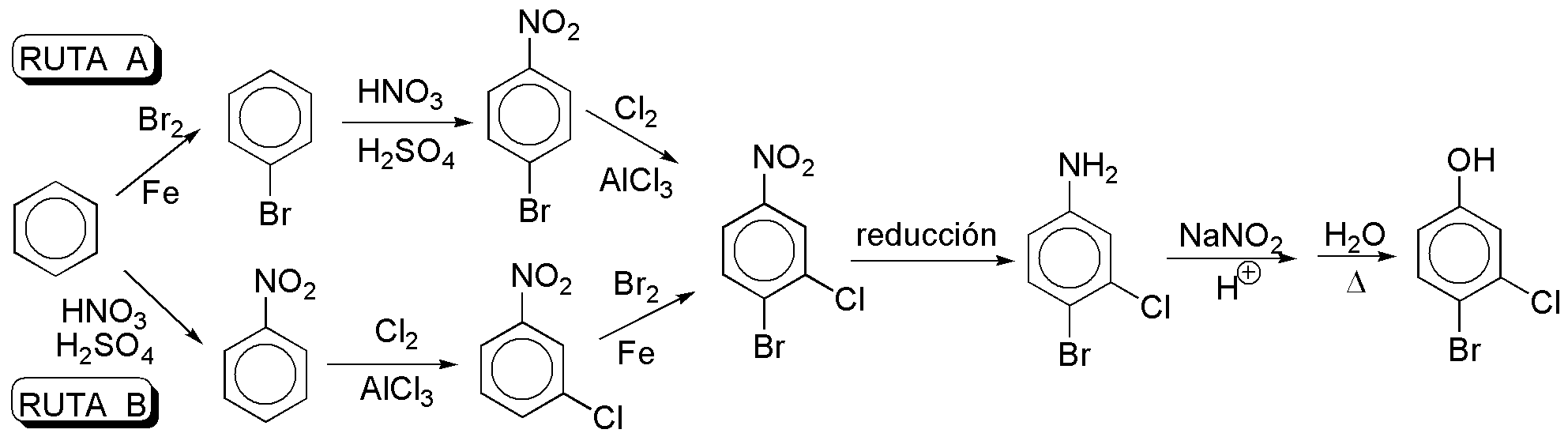
a) Se pueden plantear dos rutas posibles para la síntesis de este compuesto, partiendo de benceno. El número de pasos para ambas rutas es el mismo. La ventaja, de la ruta A sobre la B, radica en que en el primer paso, el Br es débilmente desactivante, mientras que el grupo nitro es fuertemente desactivante, por lo que es de esperar que la ruta A presente un mayor rendimiento global.
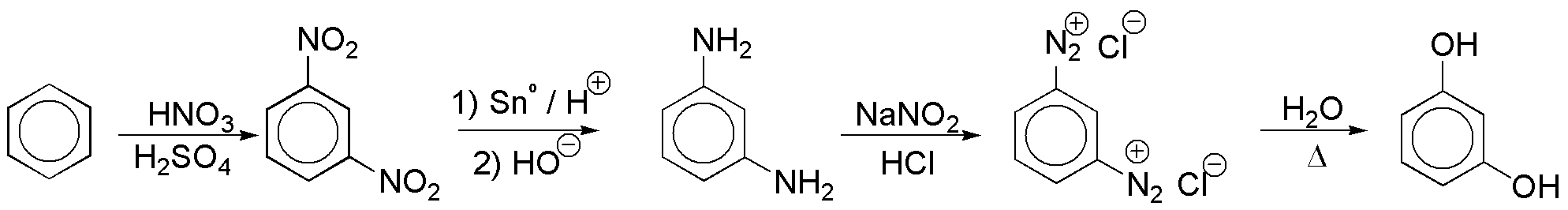
b) Los grupos OH se sitúan en una disposición relativa meta- por lo que se requieren dos grupos en dichas posiciones susceptibles de transformarse en OH. La opción más viable es introducir dos grupos NO2 y transformarlos en OH mediante sales de diazonio. Según este planteamiento el esquema de reacción sería:
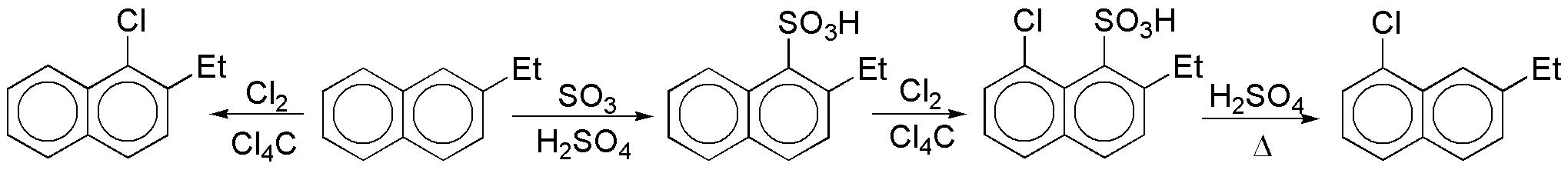
c) La halogenación directa del producto de partida no produce el compuesto deseado, ya que el anillo más rico en electrones es el que presenta el grupo etilo. Será necesario bloquear la posición y hacer que la reactividad de este anillo disminuya. En este sentido, el grupo SO3H es el adecuado, ya que es desactivante y la reacción de sulfonación es reversible.
Solución 9:
a) La clave de esta primera síntesis será la bromación del areno y la posterior sustitución nucleofílica sobre el bromuro bencílico obtenido con ión cianuro.
En b) puesto que es imposible introducir dos restos alquílicos en meta por alquilaciones sucesivas, la primera etapa deberá ser una acilación de Friedel-Craft, cuya alquilación o acilación posterior conducirá a la disposición meta de los sustituyentes y finalmente la reducción de la cetona a alquilo.
c) La acilación y posterior sulfonación conduce al producto deseado. No así si se invierten el orden de las reacciones.
d) La nitración en primer lugar dirigirá a meta la posterior alquilación.
e) Primero la cloración (orto- y para- dirigente) y posterior sulfonación.
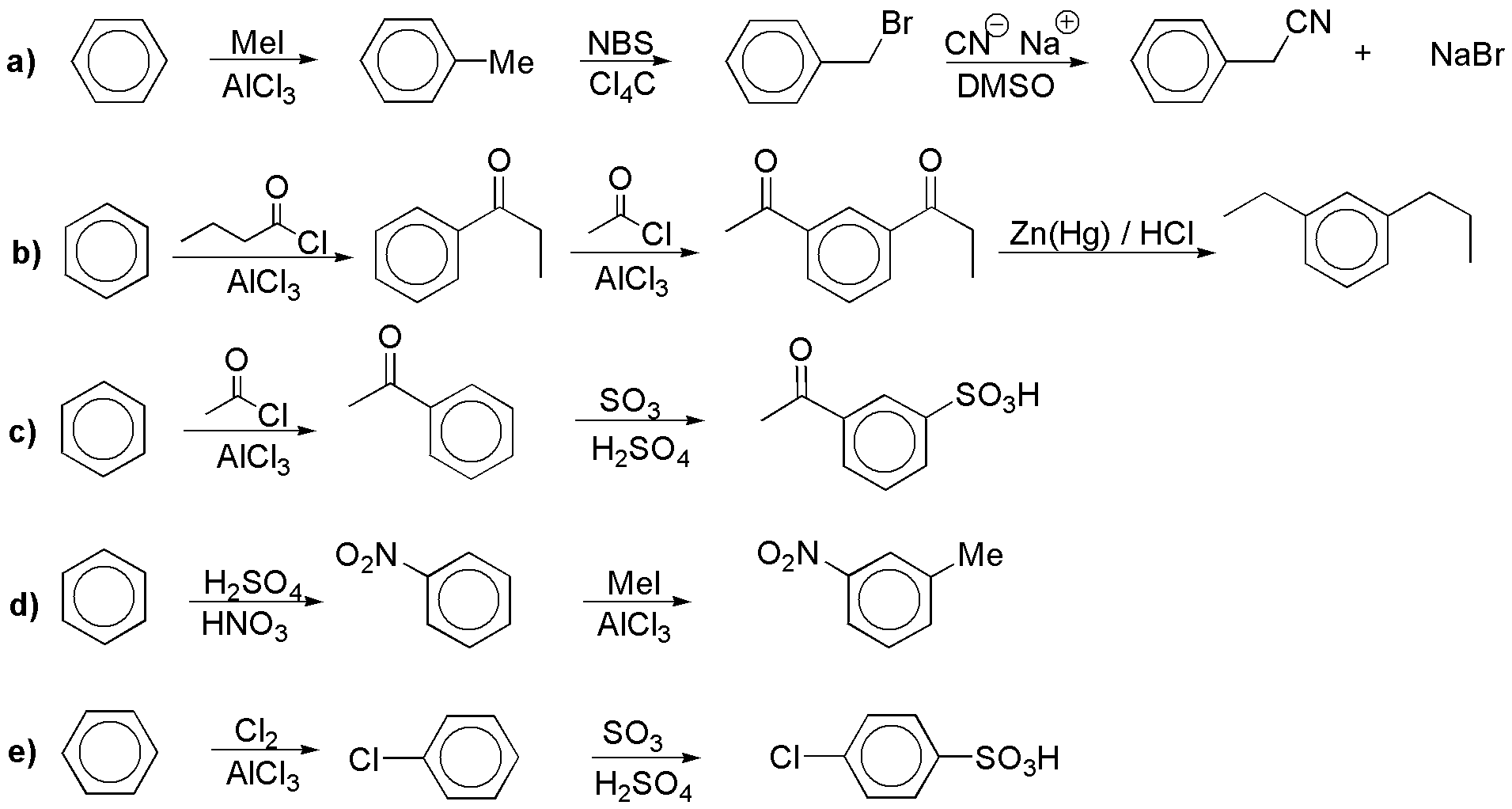
Solución 10:
a) Como el flúor no puede introducirse directamente en el anillo aromático, esa será la clave de la síntesis. Para introducirlo necesitamos una sal de diazonio (reacción de Schiemann). La otra clave es la introducción de un metilo y un amino en orto, por lo que necesitaríamos proteger la posición para temporalmente.
b) Análogo al anterior.
c) Es una alquilación de Friedel-Crafts.
d) Los fenoles suelen introducirse a partir de sales de diazonio.
e) Podemos introducir el cloro también a partir de sal de diazonio (reacción de Sandmmeyer).
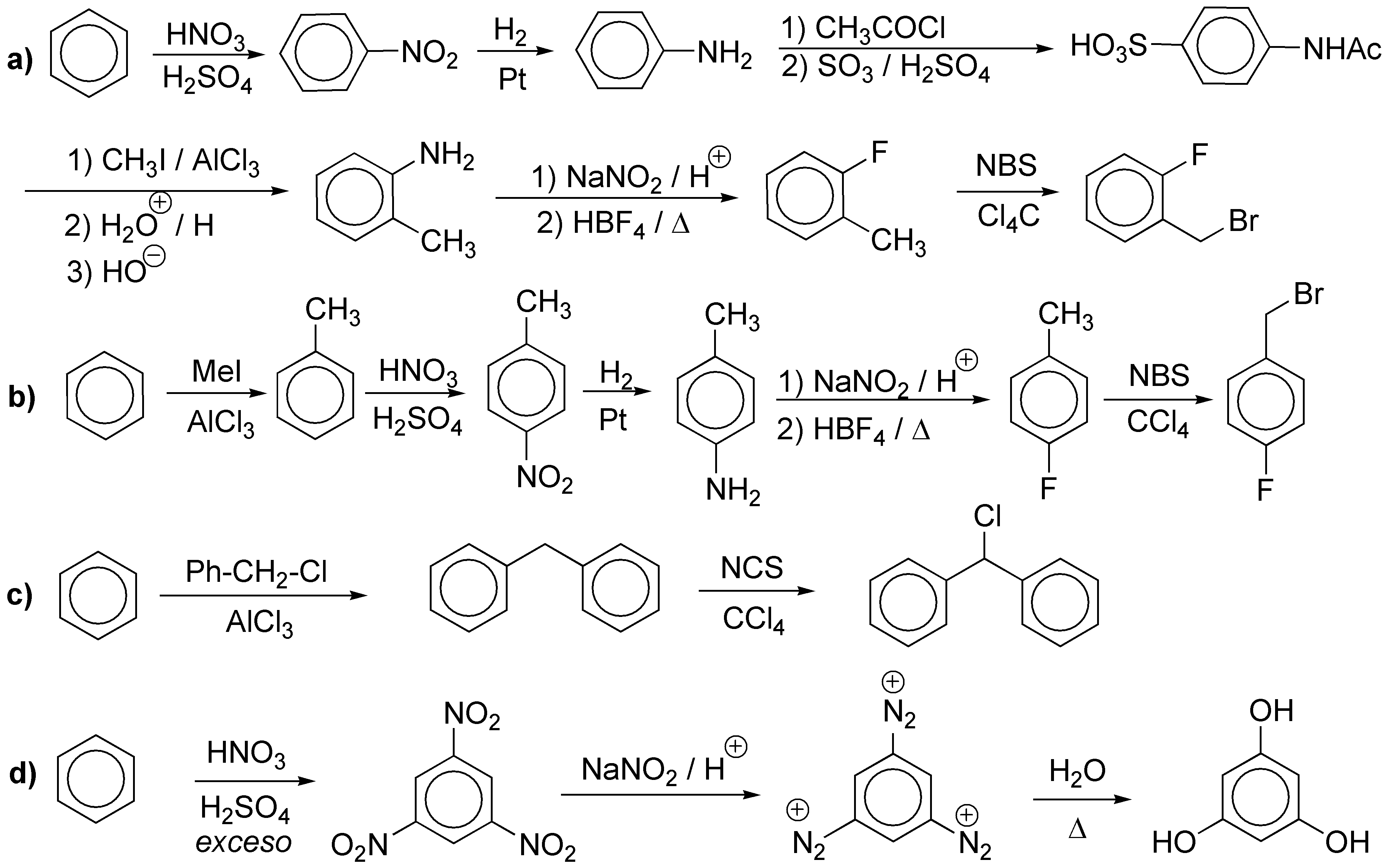
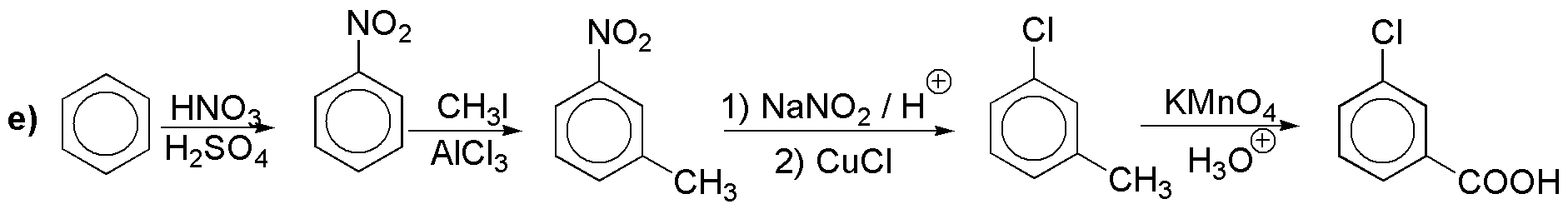
Solución 11:
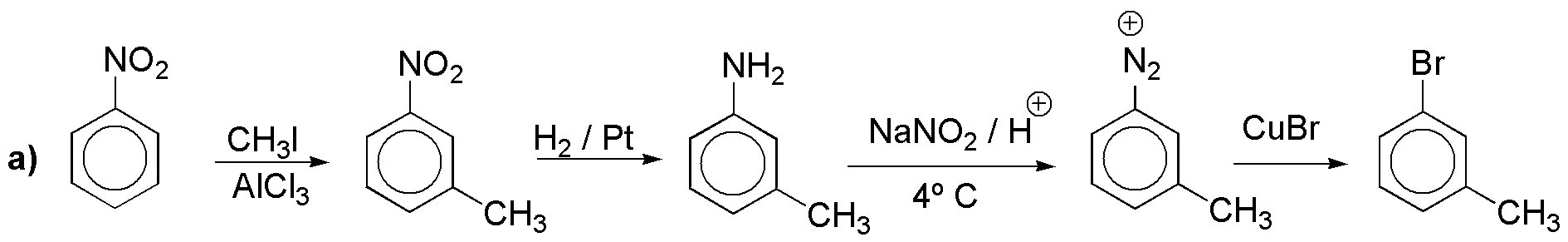
a) El cloro y el metilo no pueden introducirse directamente en posición meta-. Para hacer posible la síntesis debemos hacerlo a partir de una reacción de Sandmmeyer con sales de diazonio.
b) La nitración directa del fenol transcurre con rendimientos bajos. Por lo que la introducción del grupo hidroxilo la haremos a partir del grupo amino (sal de diazonio).
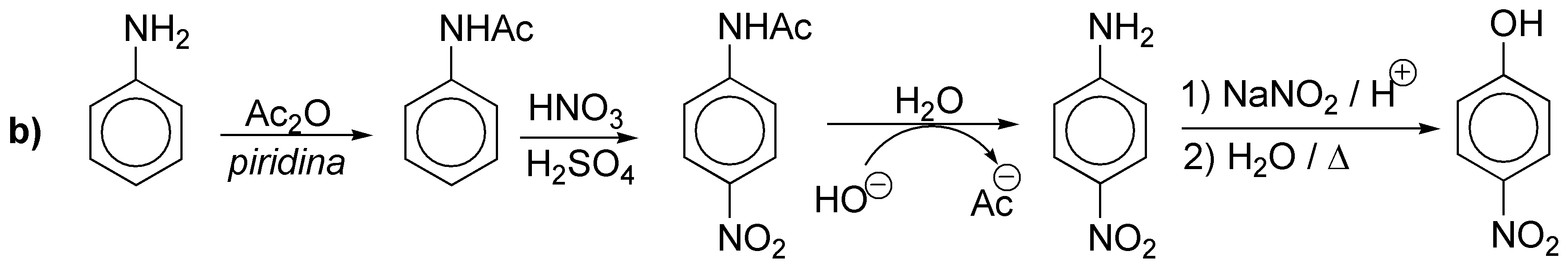
c) Con las mismas consideraciones anteriores.
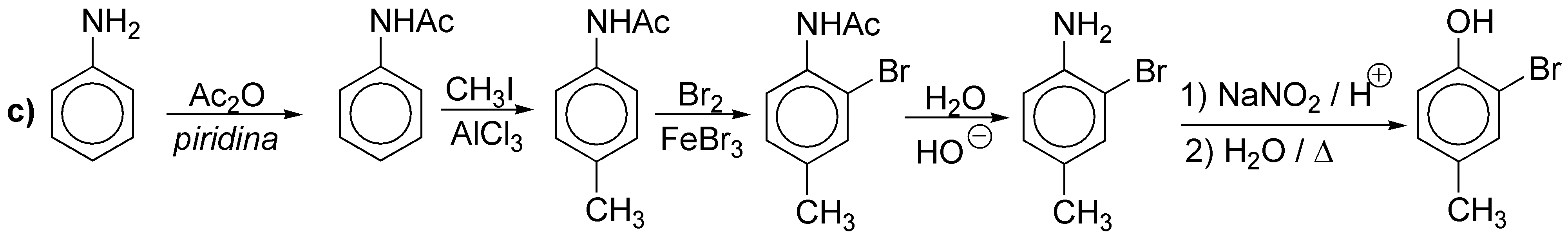
d) Igual que en los casos anteriores, pero la disposición en meta- de los sustituyentes nos obliga a partir de nitrobenceno.
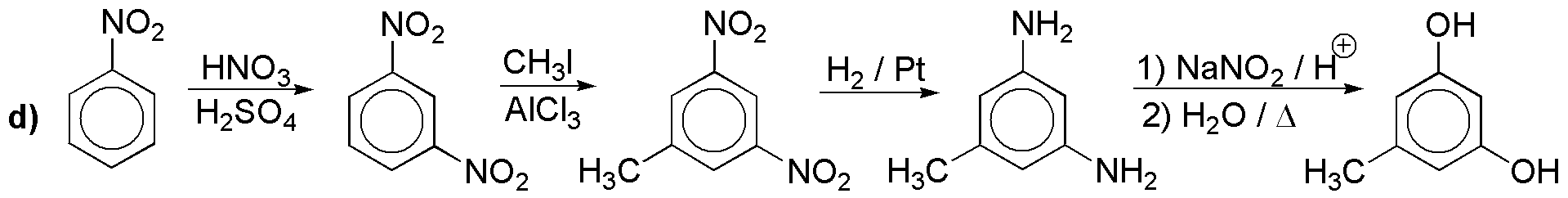
e) No es posible la introducción directa del yodo. La disposición en meta- nos obliga a partir de nitrobenceno.
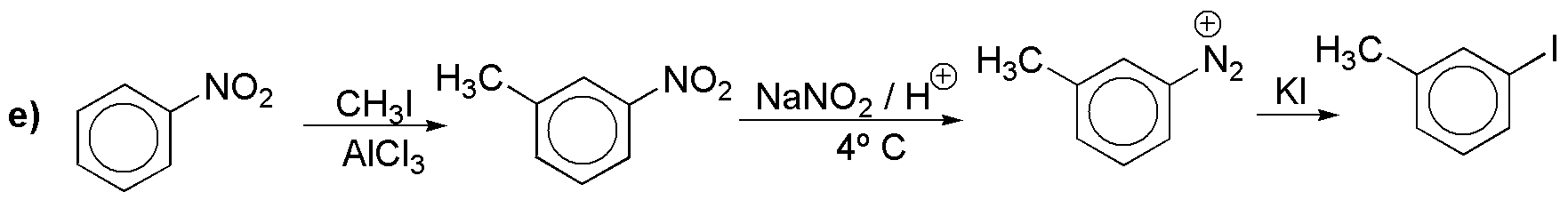
f) Se trata de un diazo compuesto. Partiremos de la anilina.
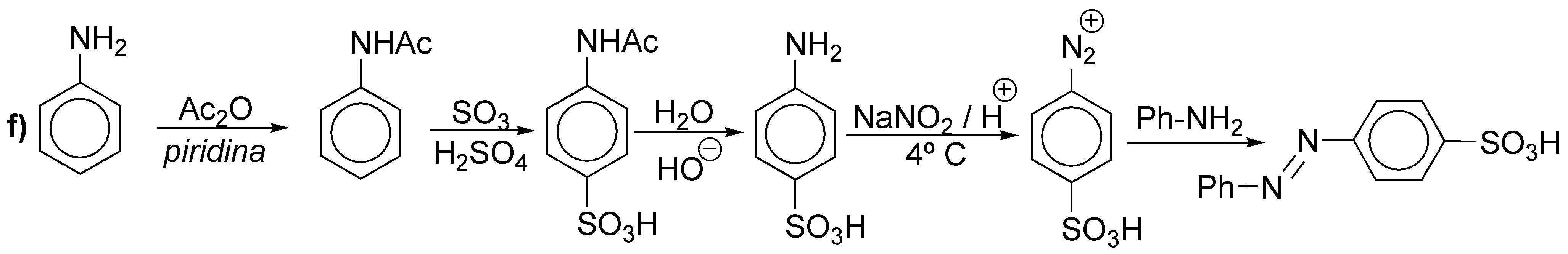
Solución 12:
Las soluciones que se proponen no son únicas, para todas las síntesis suelen existir varias posibilidades, aquí se apuntan algunas:
a) La conversión de metilo a ácido carboxílico es rutinaria pero no así la introducción de yodo. Como no es posible introducir un átomo de yodo en el anillo bencénico por halogenación directa debemos hacerlo a través de una sal de diazonio.
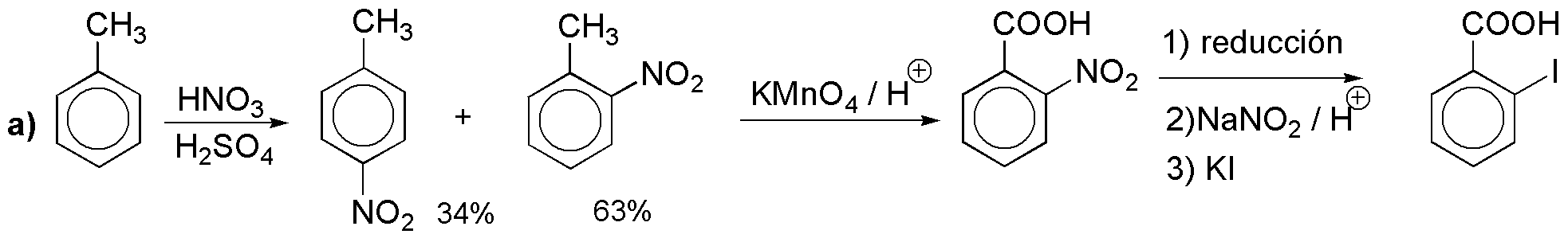
b) La misma sal de diazonio anterior nos serviría para obtener el correspondiente bromuro; otra alternativa sería la mostrada: halogenación seguida de oxidación (y no es la mejor pues el orto derivado sería minoritario). En el problema 18 se propone otra síntesis del mismo.
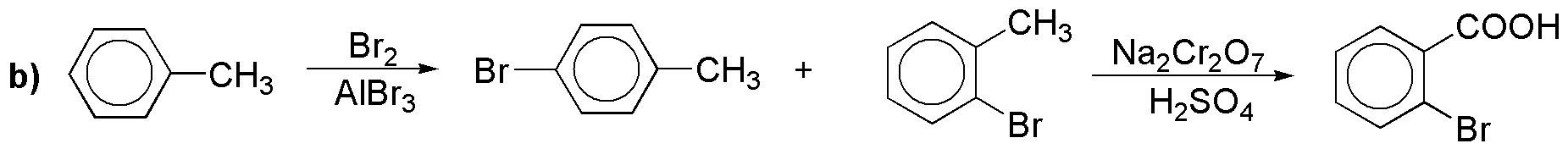
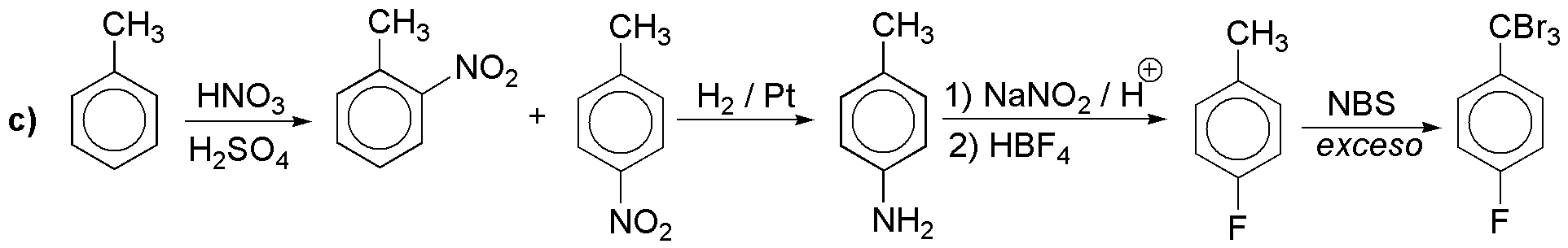
c) Al igual que en a) la introducción del flúor no es una reacción directa del anillo aromático y debemos hacerlo a través de la sal de diazonio. La halogenación radicalaria del metilo puede continuar hasta la completa halogenación utilizando exceso de reactivo.
d) La manera más simple de introducir un amino en el metilo seria por sustitución nucleofilica del correspondiente haloderivado:
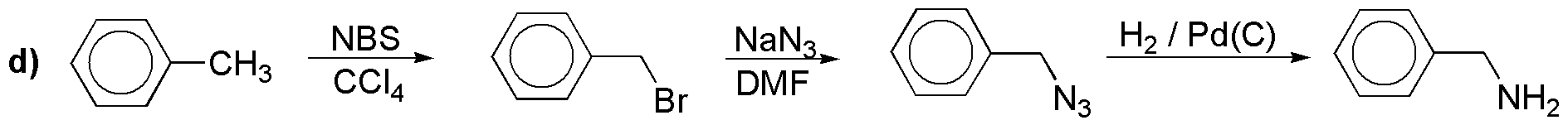
e) No es fácil introducir hidroxilos en el anillo aromático. En el laboratorio la forma más simple es a través de una sal de diazonio:
Solución 13:
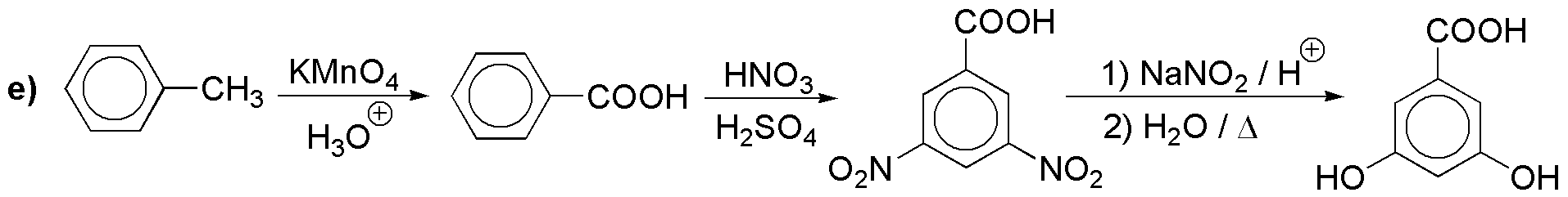
La disposición vecinal de los tres sustituyentes nos obliga a proteger temporalmente la posición 4 más accesible.
Solución 14:
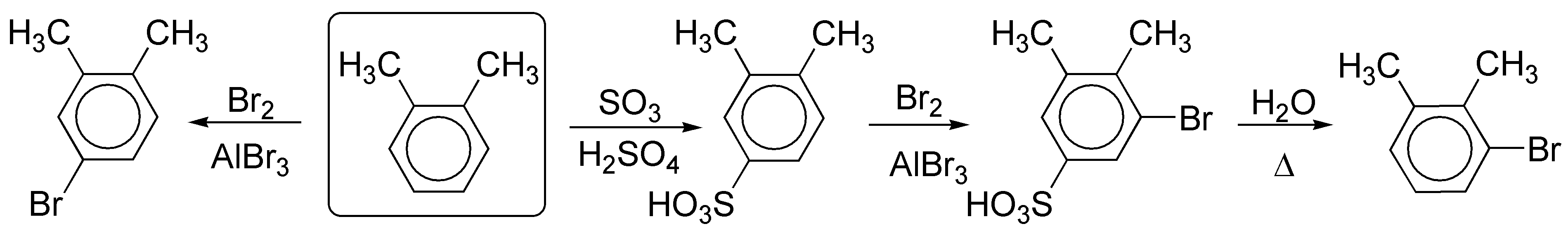
La metilación y posterior nitración del benceno nos conduce a la disposición adecuada de los sustituyentes.
Solución 15:
Es necesario proteger el grupo amino temporalmente para poder utilizar medio ácido. La disposición orto de los sustituyentes nos obliga a proteger así mismo la posición para con ácido sulfónico.
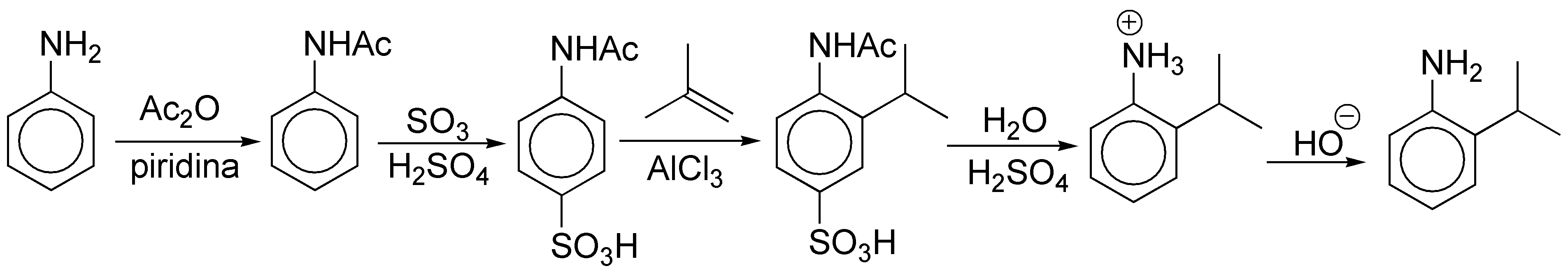
Solución 16:
Se utilizará la misma estrategia que en el problema anterior. Para introducir el grupo hidroxilo empleamos la sal de diazonio
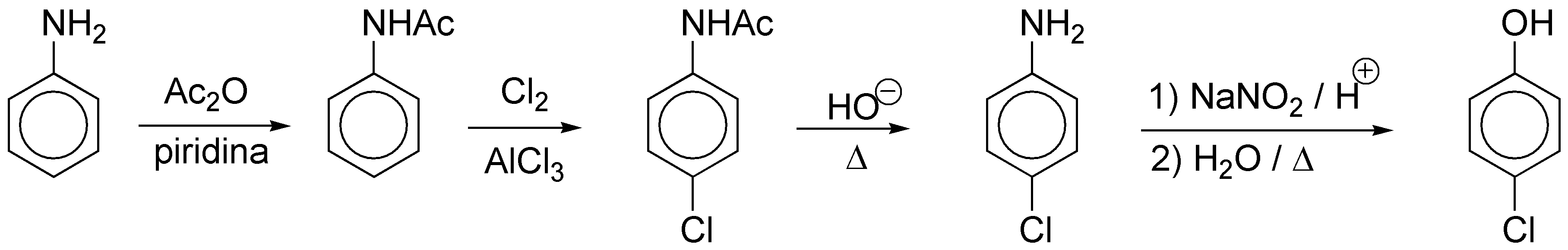
Solución 17:
Las claves de esta síntesis compleja son las dos sustituciones nucleofílicas aromáticas indicadas en el esquema.
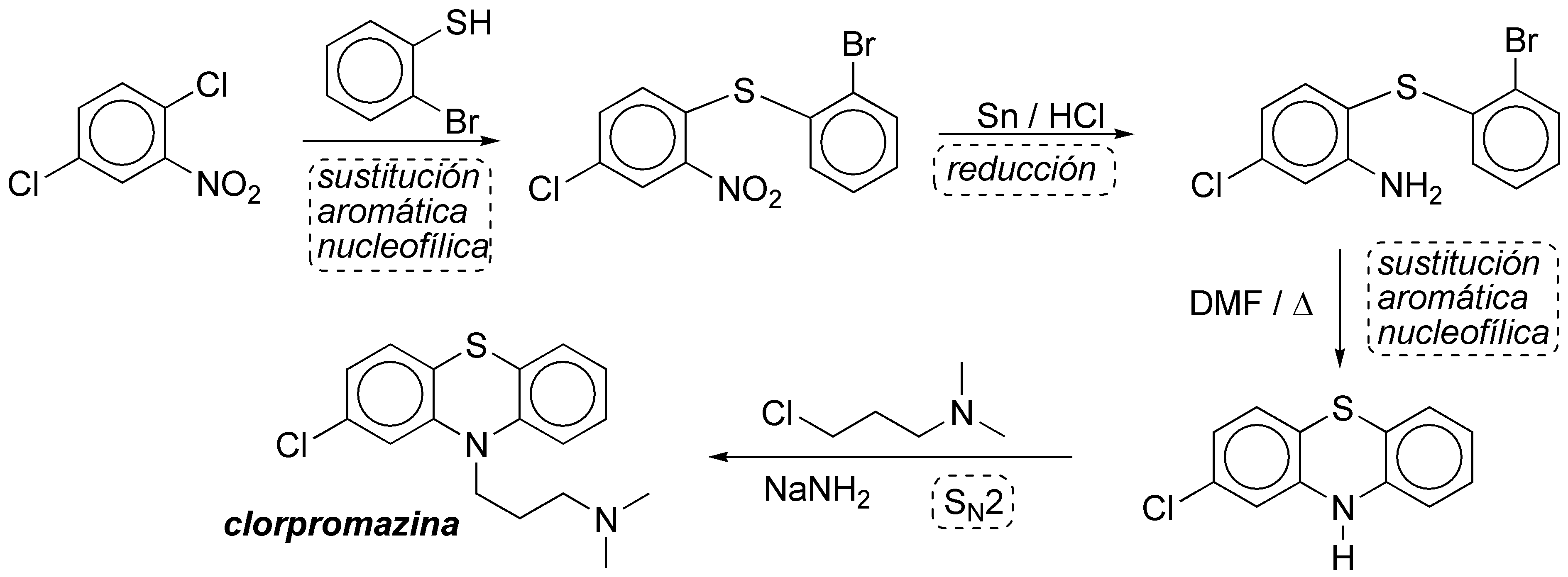
Solución 18:
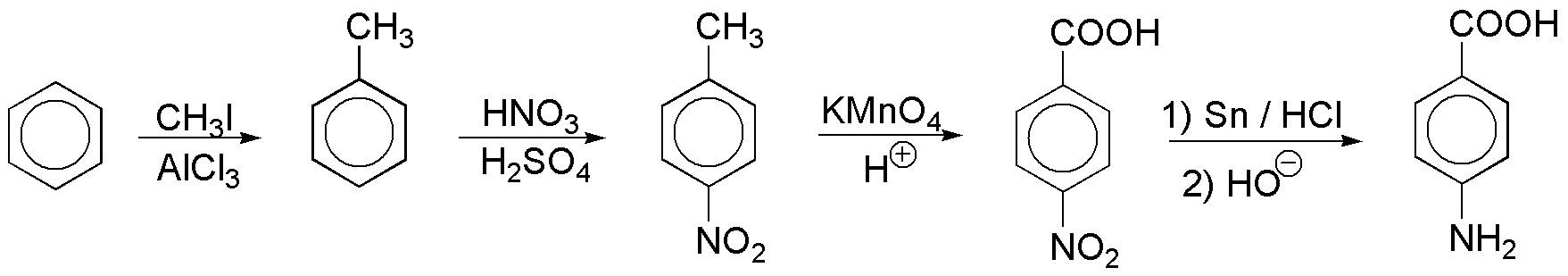
a) Como no es posible introducir directamente el grupo amido en el anillo aromático, debemos introducir el ácido por oxidación del resto alquílico, posteriormente lo transformamos en el cloruro de ácido y este por reacción con amoníaco producirá la amida.
b) La bromación del anillo y posterior halogenación bencílica, produce un derivado dihalogenado que por tratamiento con una base producirá el alqueno.
c) La nitración del benceno y posterior cloración produce la disposición meta- deseada. Después, se reduce el grupo nitro.
d) La clave es la formación del compuesto de Grignard que se adiciona nucleofílicamente a la ciclohexanona dando el producto deseado.
e) La clave consiste en la protección de la posición para del tolueno mediante la sulfonación del mismo, la posterior bromación del producto obtenido, oxidación del metilo y desulfonación conducen al producto deseado.
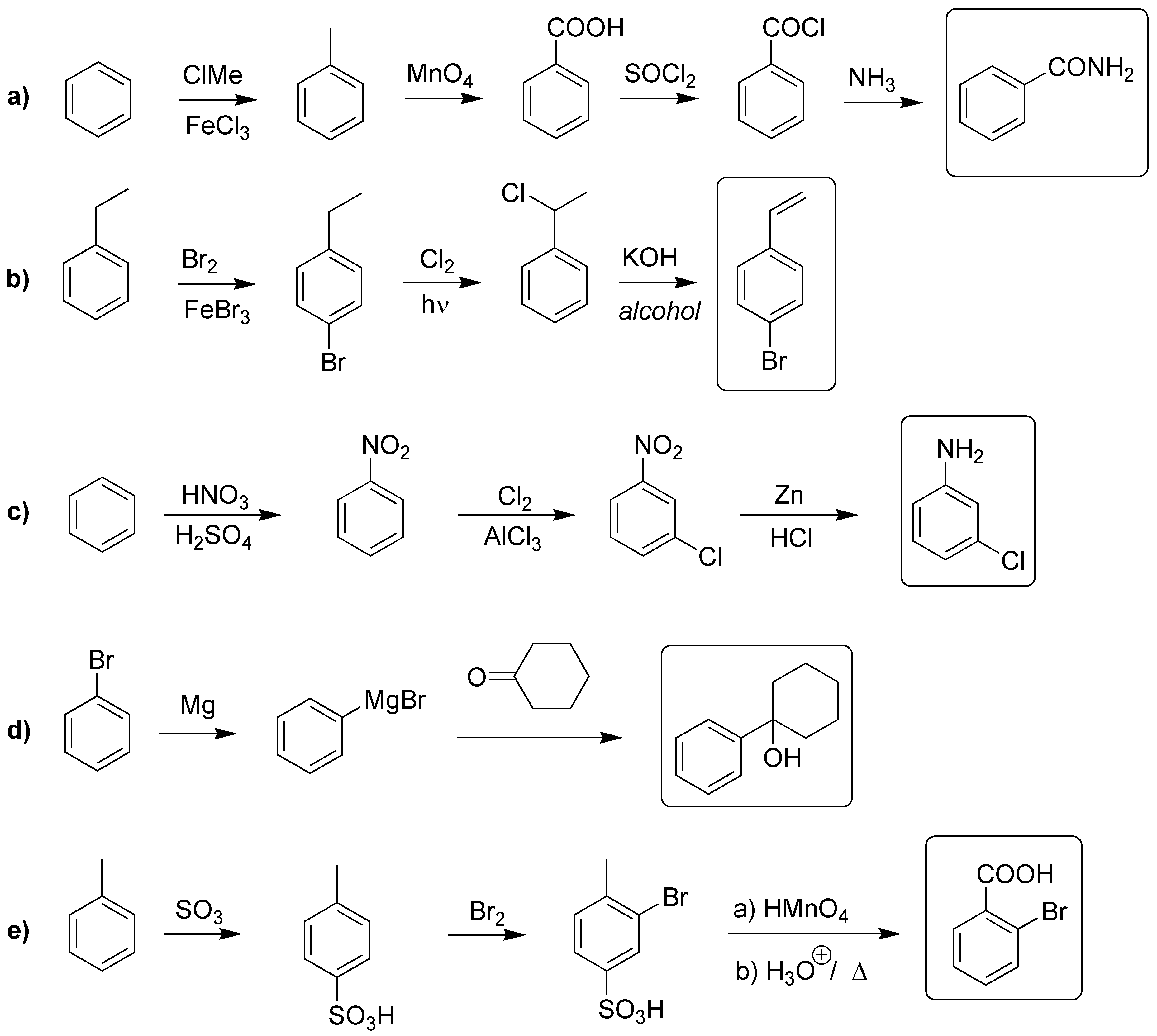
Solución 19:
El grupo metoxilo orientará en para- dando por acilación el cetoácido A. B será el producto de reducción del grupo ceto. Finalmente C corresponderá al producto de una nueva acilación de Friedel-Crafts.
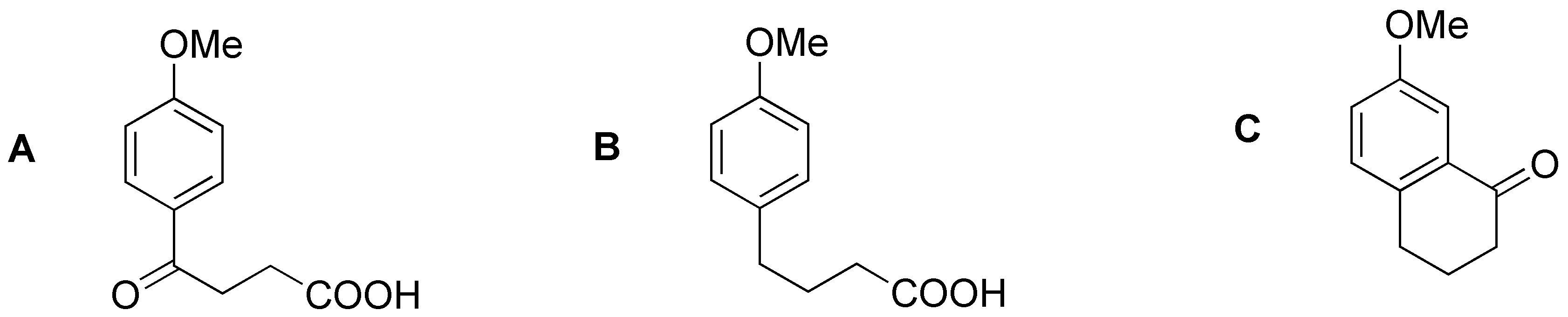
Solución 20:
a) Se trata de una halogenación bencílica. b) Se perderán los grupos sulfónicos. c) y d) se tratan de oxidaciones de restos alquílicos a los correspondientes ácidos carboxílicos.
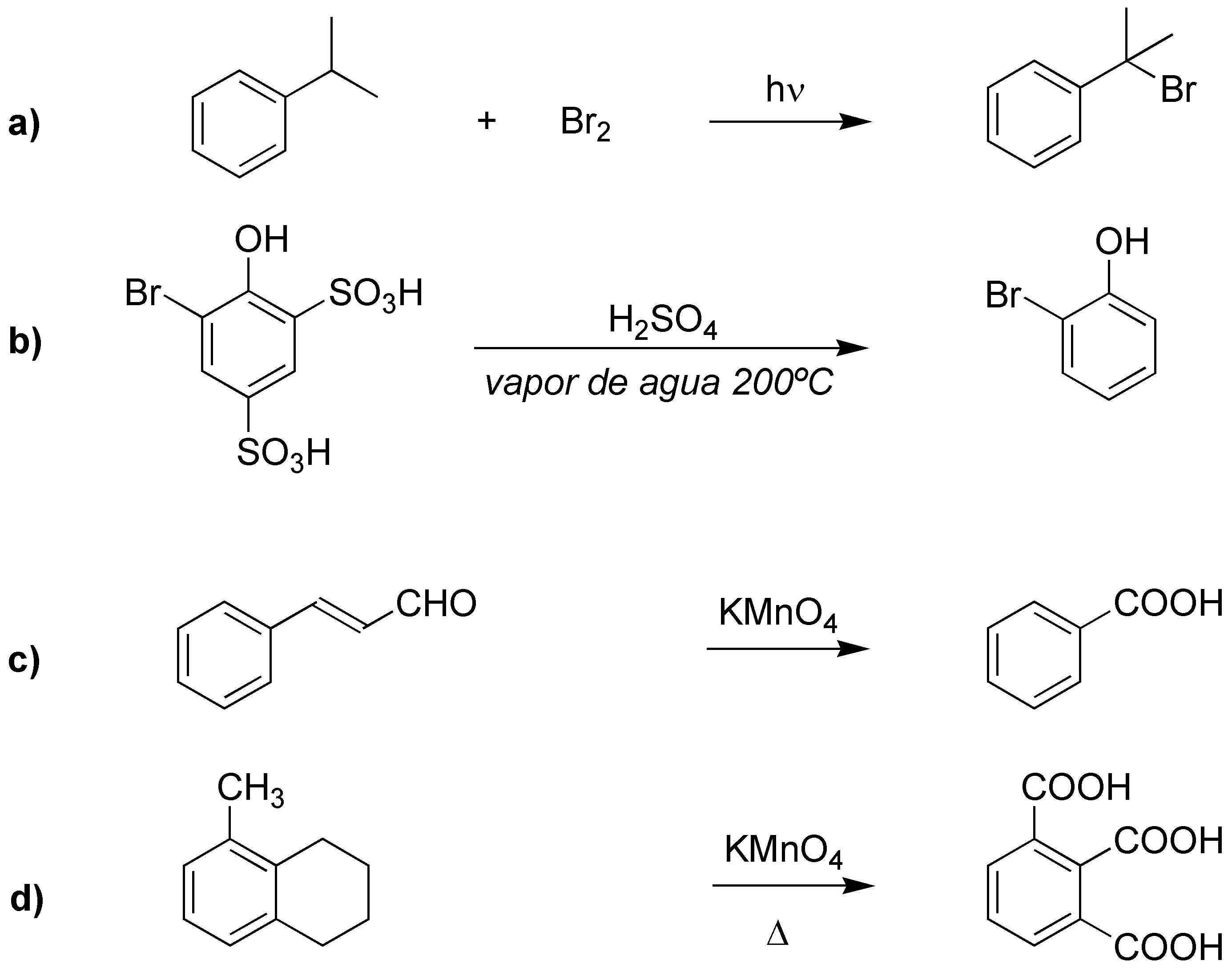
Solución 21:
En principio la mayor dificultad estará en la obtención del orto-nitrobenzoíco pues la secuencia se alarga por la necesidad de proteger la posición para respecto del alquilo.
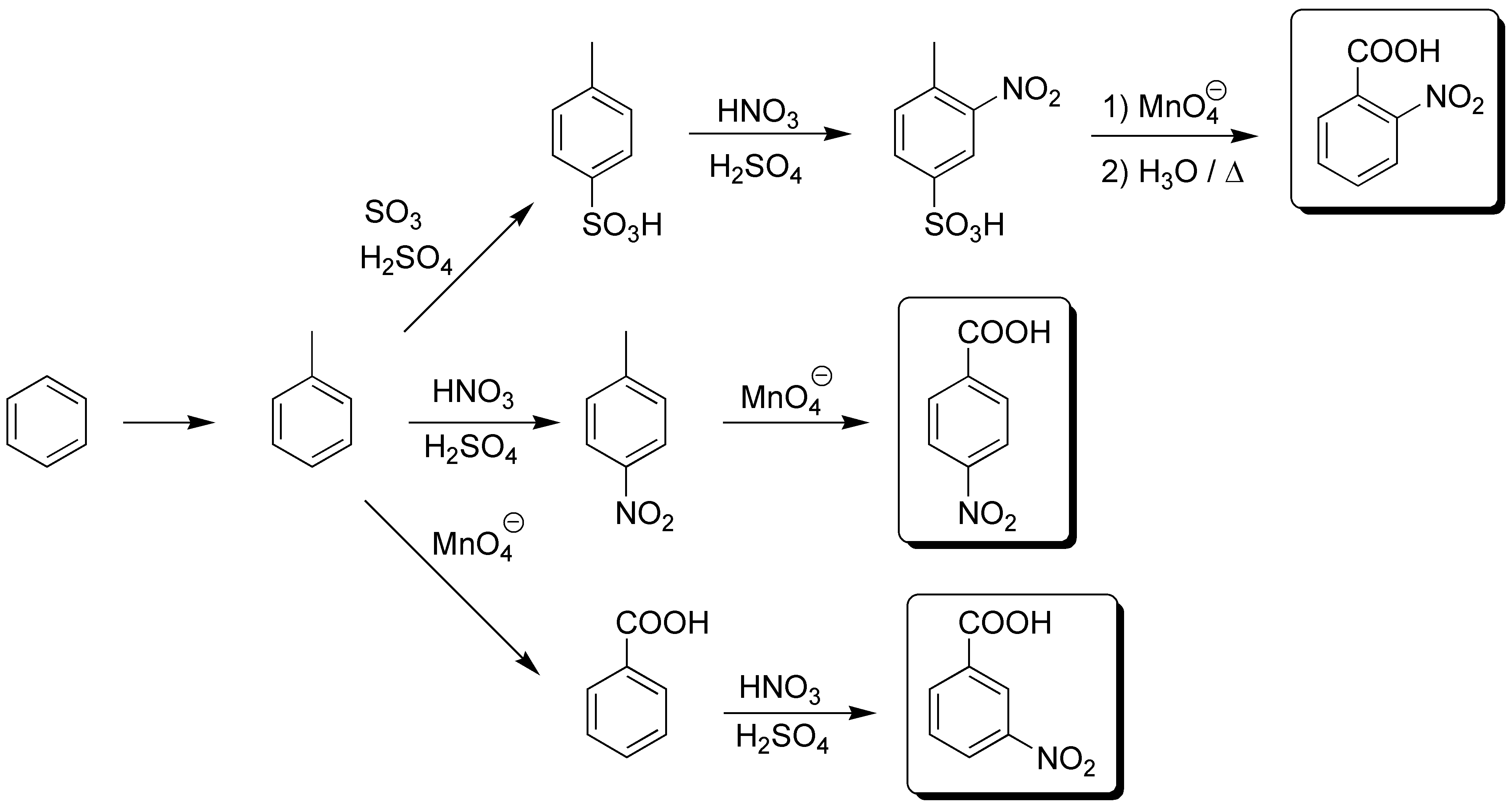
Solución 22:
Los grupos electrón-atrayentes aumentan la acidez mientras que los electrón donante la disminuyen por tanto el orden será:
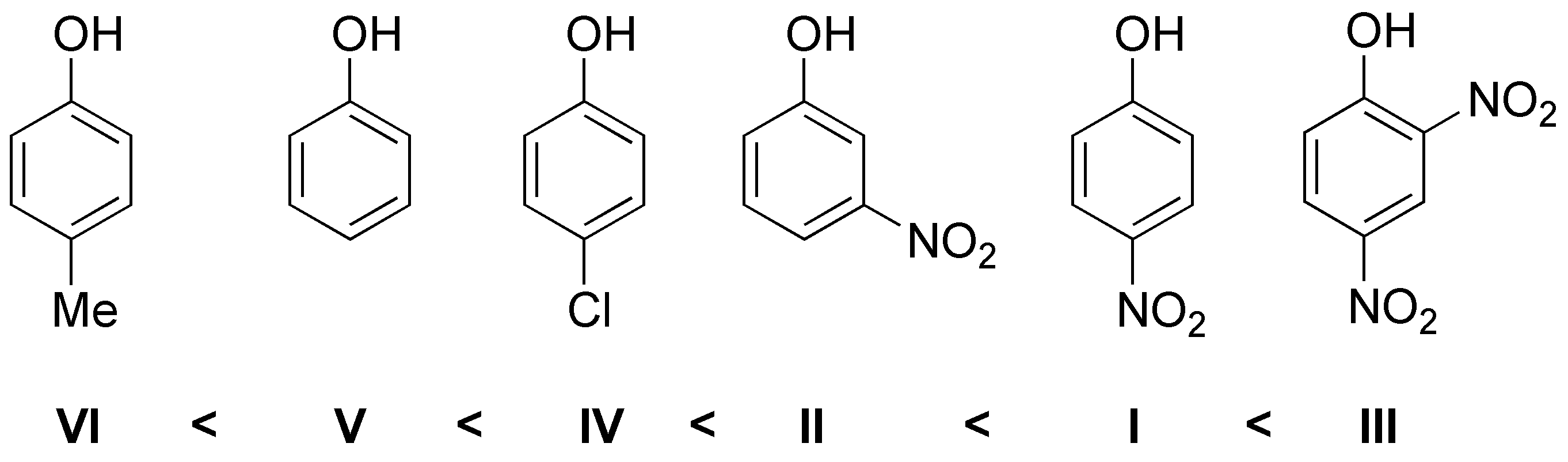
Solución 23:
La manera más eficaz de introducir el grupo hidroxilo en el anillo aromático es a partir de la sal de diazonio. Por tanto, la secuencia propuesta será: