Written by J.A. Dobado | Last Updated on 1 año
¿Qué es el ácido nítrico?
Es un ácido mineral de fórmula general HNO3, al que se le denomina también como ácido fumante (que forma humos).
Índice
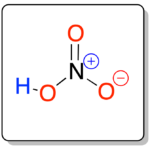 |
| Estructura 3D |
Propiedades fisicoquímicas
El ácido nítrico HNO3, es un líquido viscoso, inodoro e incoloro, en estado puro, pero de color amarillo parduzco, debido a las impurezas de óxido de nitrógeno disueltas. Libera humos amarillos (de ahí su nombre de ácido fumante) a temperatura ambiente. Es soluble en agua y presenta un punto de fusión de -41.6 ºC, y punto de ebullición de 83 ºC.
Propiedades ácido-base
Es un ácido fuerte y también un buen agente oxidante, llegando a ser explosivas sus reacciones con grupos carburos o cianuros. Debido a que es un ácido fuerte monoprótico, en disolución acuosa se disocia de la siguiente forma:
HNO3 + H2O → NO3⊖ + H3O⊕
Ademas su carácter ácido, el HNO3 le hace reacciona con la mayoría de las bases para dar el nitrato correspondiente. Los iones nitratos NO3⊖ que se originan, forman las sales del ácido nítrico, y se les denomina con el mismo nombre (nitratos). Por ejemplo, nitrato de plata (AgNO3).
De igual forma, debido a que es un ácido mineral fuerte, tiene la capacidad de desplazar a otros ácidos más débiles. Por ejemplo, desplaza a la sal del ácido acético (acetato de sodio) cuando reacciona de la siguiente forma para formar nitrato de sodio:
HNO3 + CH3COONa → NaNO3 + CH3COOH
Igualmente, la reacción del ácido sulfúrico con nitrato potásico produce ácido nítrico y un precipitado de bisulfato potásico.
También, es de especial utilidad en reacciones orgánicas de sustitución electrofila aromática (SNAr), debido a la reacción que tiene lugar con el ácido sulfúrico para dar el ión nitronio (NO⊕2).
Es inestable térmicamente, y al calentarlo descompone de la siguiente manera:
4HNO3 → 4NO2 ↑ + 2H2O + O2↑
Además, a la mezcla 1:3 (relación molar) de ácido nítrico y ácido clorhídrico se le denomina agua regia. El nombre proviene de la Alquimia debido a que esta disolución disolvía metales nobles como oro, y platino.
Producción
El ácido nítrico se obtiene mezclando pentóxido de dinitrógeno (N2O5) y agua que dan HNO3 puro.
N2O5 + H2O → HNO3
Sin embargo, hay que realizar la destilación con H2SO4, ya que el HNO3 forma un azeótropo con el agua (68 % de HNO3 y 32 % de H2O).
Debido a esto, se distribuye en disoluciones comerciales que presentan concentraciones en el rango 52-68 % de ácido nítrico. Además, cuando este valor es superior al 86 % se le denomina ácido nítrico fumante (en dos variedades: blanco y rojo). El HNO3 blanco fumante también se etiqueta como 100 %, debido a que el contenido de agua es menor del 1%.
Proceso de Ostwald
A nivel industrial, se produce mediante el proceso de Ostwald, mediante reacción del amoníaco con el oxígeno del aire, y catalizada por platino a altas temperaturas (1000 ºC).
4NH3 + 5O2 → 4NO↑ + 6H2O
El óxido de nitrógeno gas NO pasa a unas torres metálicas de absorción para dar la siguiente reacción:
2NO + O2 → 2NO2↑
Posteriormente, el dióxido de nitrógeno que se forma reacciona con agua:
3NO2 + H2O → 2HNO3 + NO↑
Finalmente, el óxido nitroso vuelve a reaccionar con oxígeno de la siguiente manera :
2NO + O2 → 2NO2↑
