Índice
Un compuesto heterocíclico es un compuesto orgánico en el que uno o más de los átomos de carbono en el esqueleto de la molécula han sido reemplazados por un átomo distinto al carbono. Los heteroátomos típicos incluyen nitrógeno, oxígeno y azufre. De este grupo, a los que obedecen la regla de Hückel se les denomina aromáticos.
Heterociclos con 6 átomos y 6 electrones π

Los heterociclos totalmente insaturados de 6 miembros se pueden considerar como una molécula de benceno en el que uno o más átomos de carbono ha sido reemplazado por un heteroátomo.
La piridina (o azabenceno) es el más sencillo de este tipo de compuestos, con un átomo de nitrógeno en el anillo.
Al igual que el benceno, la piridina es plana, y la única diferencia estructural con el benceno es la distorsión que origina la distancia C—N más corta que la del enlace C—C.

Se puede representar por una estructura cíclica formada por 5 átomos de carbono sp2 a cada uno de los cuales esta unido un hidrógeno, y un átomo de nitrógeno sp2.
Cada uno de los 6 átomos del anillo tiene un orbital p ortogonal al plano del anillo. Presentando una estructura similar al benceno.
Un ciclo completo de orbitales p con 6 electrones, pero se diferencia en que tiene un par de electrones sin compartir del nitrógeno en el plano del anillo.
Al igual que el benceno, la piridina se puede representar con dos estructuras resonantes de Kekulé.
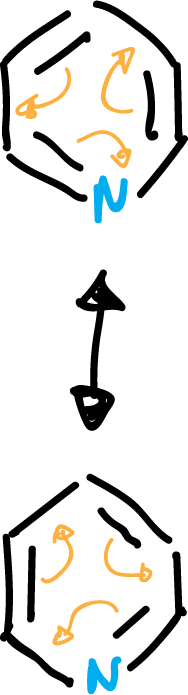
Para interpretar la estructura electrónica del benceno y de la piridina se utiliza la teoría de Orbitales Moleculares (TOM). Los orbitales atómicos se combinan para formar los orbitales moleculares.
En la aproximación Hückel, los electrones de los orbitales p se tratan de manera independiente de los que forman los enlaces σ del plano del anillo.
Los 6 orbitales p se combinan para dar 6 orbitales moleculares π deslocalizados cada uno de los cuales puede contener un máximo de 2 electrones.
El cálculo de la energía de estos orbitales nos lleva a concluir de que tres de ellos tienen menor energía que los p aislados, mientras que la energía de los otros tres es más elevada.
Los tres orbitales de menor energía (π enlazantes) pueden alojar a los 6 electrones.
Los orbitales de mayor energía (π* antienlazantes) se quedan vacíos.
Reglas de aromaticidad de Hückel
Hückel define moléculas aromáticas como:
Las moléculas planas que presentan un ciclo completo e ininterrumpido de orbitales p, se estabiliza cuando tienen (4n + 2) electrones π, para n = 0, 1, 2, 3, 4, … etc.
El benceno, la piridina, y otros análogos con 6 electrones π obedecen la regla de Hückel cuando n = 1, por lo que se clasifican como moléculas aromáticas.
Cuando representamos los orbitales π del benceno y de la piridina, se observa que el tamaño de los círculos indica aproximadamente los coeficientes relativos de los orbitales, y los círculos rojos y azules indican las fases opuestas de las funciones de onda.
fig-01 (OM benceno y piridina)
Los orbitales de la piridina son similares al benceno pero existen dos diferencias notables:
- Los orbitales π de la piridina son de menor energía que los del benceno, consecuencia de la mayor electronegatidad del nitrógeno en relación al carbono.
- Los orbitales moleculares OM ocupados de mayor energía (HOMO) del benceno son degenerados (presentan igual energía), π2 y π3. Los HOMO de la piridina tienen energía distinta (el π2 presenta menor energía que el π3). El orbital π3 de la piridina es el HOMO. Además, el π2 posee un coeficiente grande sobre el nitrógeno.
La relación entre la estructura del benceno y la de la piridina también se aplica a otros sistemas anulares conjugados de seis miembros con más de un átomo de nitrógeno.
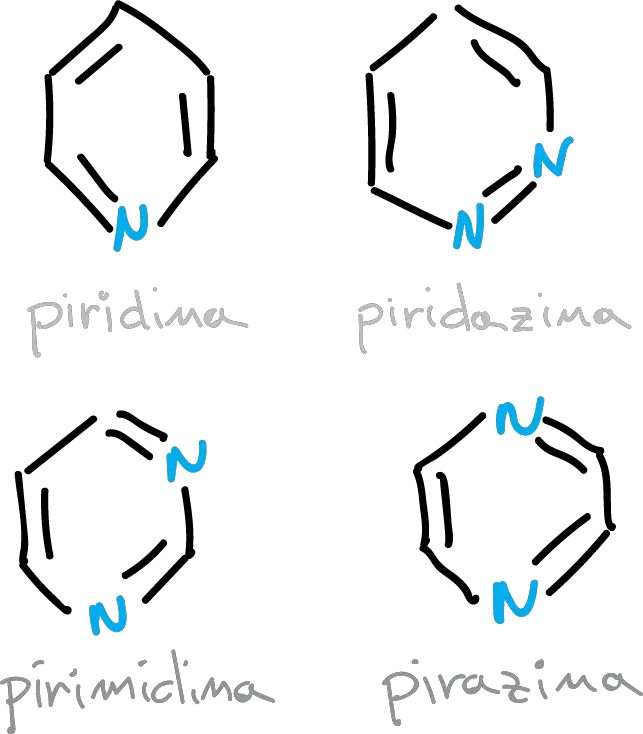
La energía del HOMO baja a medida que aumenta el número de nitrógenos. De igual forma, también lo hace el LUMO, con lo que la diferencia HOMO—LUMO es constante.

En la piridina y heterociclos relacionados existe menor densidad de electrones π en los átomos de carbono del anillo, comparado con el benceno. Esto es especialmente notable en las posiciones orto y para.
Por esta razón a estos heterociclos se les llama compuestos heterocíclicos π deficientes.
Otros heterobencenos
El único átomo distinto al nitrógeno de la primera fila de la tabla periódica que puede reemplazar al grupo CH del benceno, en un heterociclo aromático sin carga es el boro.
Los borabencenos, a pesar de su estructura tan simple y la fortaleza del enlace B—C, no han sido aislados en estado libre (sin un ligando donante en el átomo de boro) porque son unos poderosos ácidos de Lewis.
Se han preparado algunos de sus complejos y el 1H-boratobenceno, que es similar al benceno pero con carga, ha sido aislado como sal de litio.
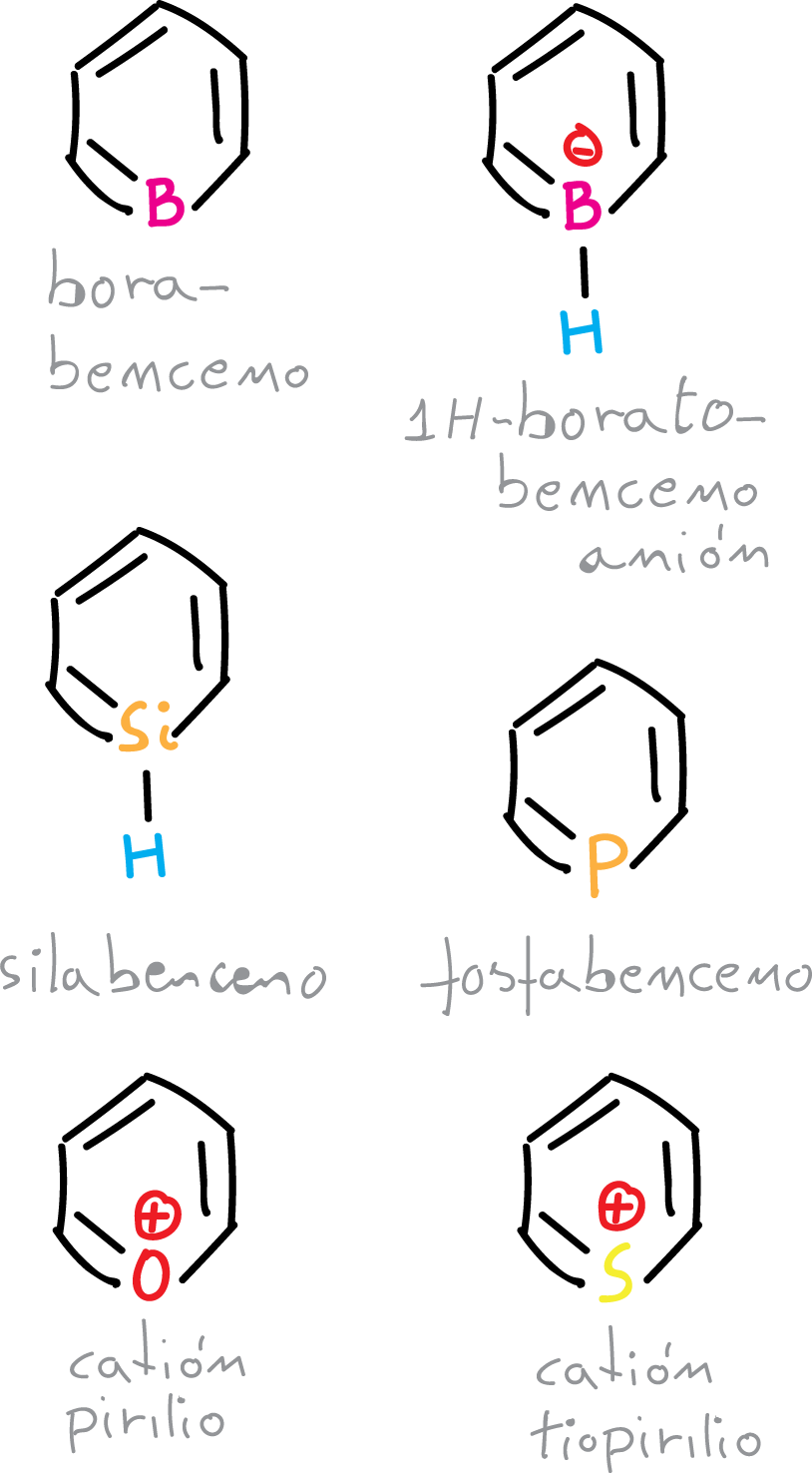
Por otro lado, los heterociclos aromáticos sin carga pueden incorporar, también, átomos como silicio, fósforo, arsénico, y de la segunda fila o posteriores en los grupos 14 y 15. De esta forma, se han preparado pero son limitados.
Además, otros heterociclos del grupo 16, que incluyen oxígeno, azufre, selenio y teluro, se pueden incluir en las especies cargadas positivamente.
Heterociclos con 5 átomos y 6 electrones π
Los heterociclos planos insaturados que contienen 5 átomos pueden considerarse aromáticos, si contienen 6 electrones.
No existe ningún carbociclo análogo a no ser el anión ciclopentadienilo.
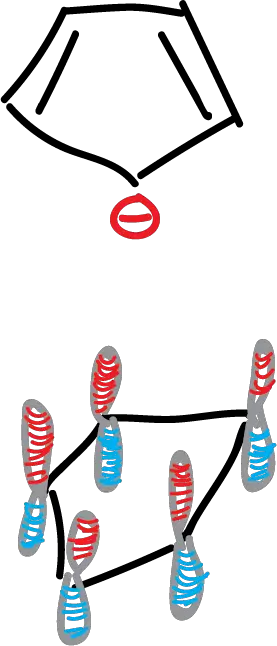
Esta molécula presenta estructura de pentágono simétrico con 5 átomos de carbono con hibridación sp2 y un conjunto cíclico de 5 orbitales p con 6 electrones.
Si consideramos el pirrol, puede ser un ejemplo de heterociclo aromático de 5 miembros. El pirrol es una molécula plana, lo que indica que el átomo de nitrógeno presenta hibridación sp2. Además, los 3 enlaces σ del nitrógeno se sitúan en el plano molecular, y el orbital p, se orienta ortogonal a dicho plano contiene el par de electrones sin compartir.
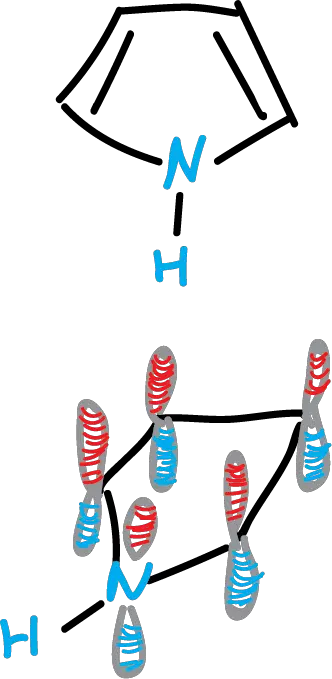
Los orbitales p originan nubes π por encima y por debajo del plano del anillo. Están formados por los orbitales p de los carbonos y el del nitrógeno. Es una nube derivada de 5 orbitales p, pero que contienen 6 orbitales σ (el nitrógeno con 2). Por tanto, cumple la regla de Hückel de 4n + 2, cuando n = 1.
El par de electrones del nitrógeno interviene en la formación de la nube π. Por tanto, esto conlleva una menor basicidad el pirrol comparado con la piridina. Los orbitales moleculares del pirrol se podrían representar de la siguiente forma:
fig-01 (OM pirrol)
Se manifiesta en el desdoblamiento de los orbitales π2 y π3 siendo π2, que se sitúa sobre el nitrógeno, el de más baja energía.
La distribución electrónica p calculada en el pirrol muestra que el sistema anular es rico en electrones (6 electrones en 5 átomos). Además, se observa que los átomos de carbono presentan mayor densidad de electrones π que en el benceno. Aunque esta densidad es mayor en el nitrógeno. Por tanto, debido a su mayor densidad de electrones π en el carbono, en comparación con el benceno, hace que se les denomine compuestos heterocíclicos π excedentes.
El grupo de heterocíclos aromáticos de 5 miembros es mucho mayor que el de 6, debido a que uno de los átomos del anillo puede ser divalente y por tanto pueden estar presentes otros heteroátomos, como oxígeno o azufre (por ejemplo: furano o tiofeno).
Además, para estos derivados es posible construir heterociclos aromáticos neutros reemplazando un CH por un nitrógeno.
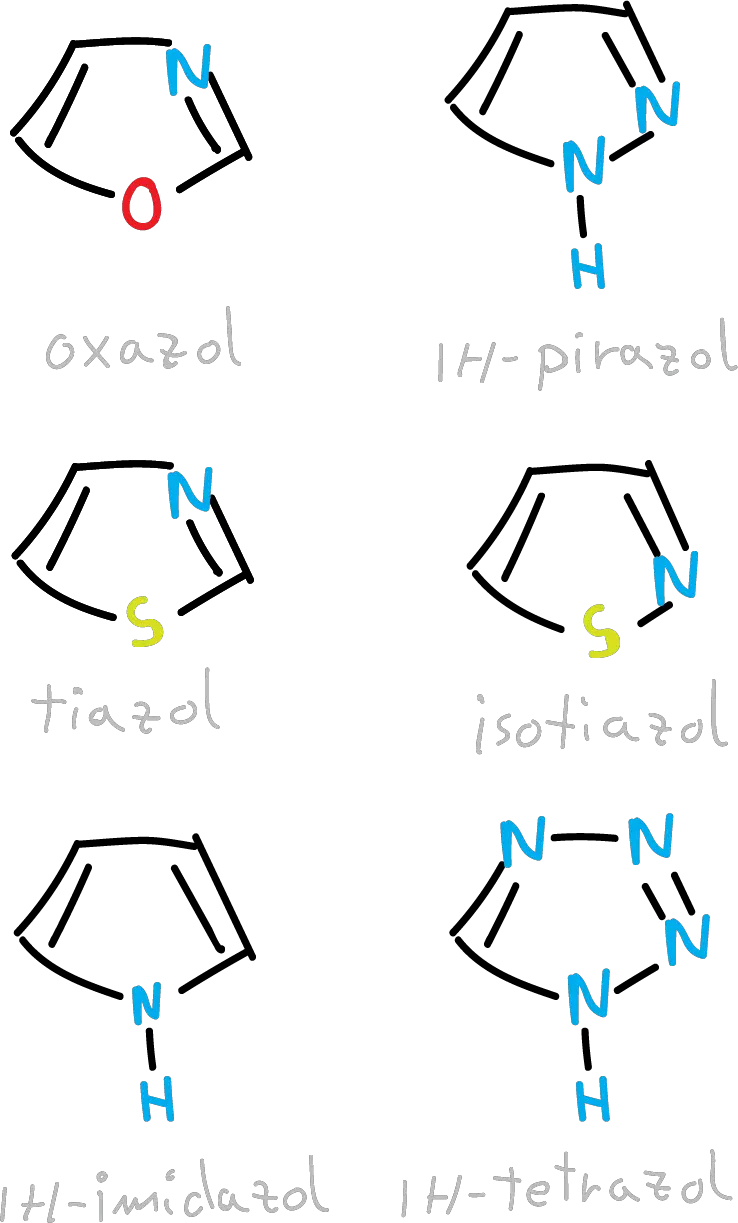
Sin embargo, los que contienen átomos de nitrógeno adicionales a los carbonos, se hacen cada vez más deficientes en electrones π conforme aumenta el número de nitrógenos.
Sistemas benzofusionados
Los compuestos con estructuras en los que un anillo bencénico se fusiona con otro anillo aromático, conservan sus propiedades aromáticas aunque algo modificadas.
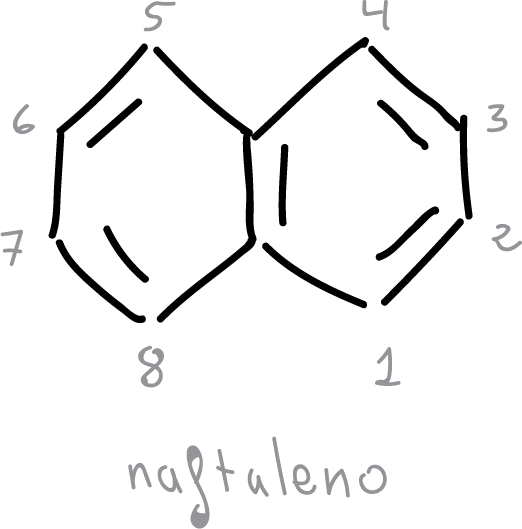
- En el naftaleno, el enlace C1—C2 es más corto que el C2—C3.
- Se pierde la simetría hexagonal del benceno.
- Sin embargo, los naftalenos conservan las propiedades características de compuestos aromáticos.
De la misma forma, cuando un heterociclo se fusiona a un anillo de benceno, el sistema se clasifica como aromático. Así, encontramos los compuestos fusionados con nitrógeno de 6 miembros, como por ejemplo azanaftalenos:

Estos compuestos, como el naftaleno, muestran una alternancia de longitudes de enlace que es consistente con las estructuras de Kekulé.
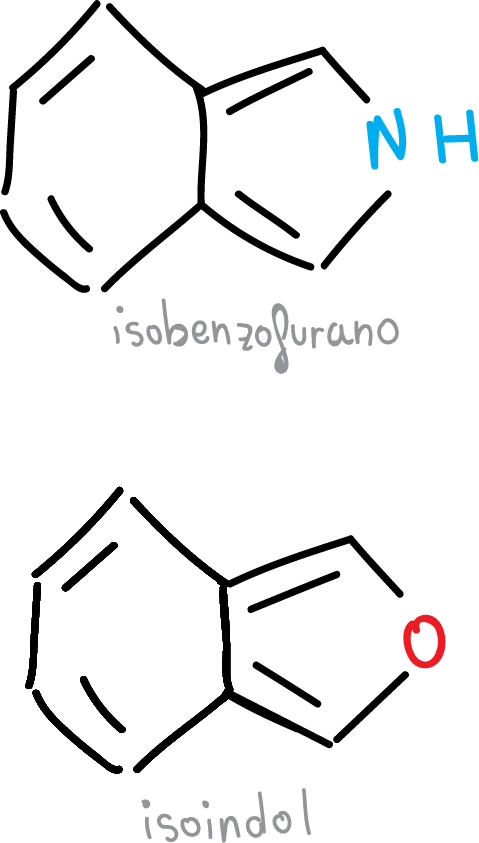
Otra serie de compuestos benzofusionados la formarían los heterociclos de 5 miembros fusionados.

Estos también presentan un alto grado de aromaticidad. En cambio, aquellos en los que el heterociclo se une al benceno a través del enlace C3—C4, que es el más largo de los enlaces C—C, presentan un grado de aromaticidad mucho menor, como los heterociclos de la figura.
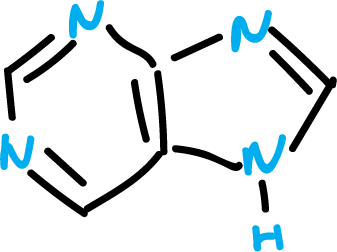
Existen, como se detalla más adelante, una gran variedad de heterociclos fusionados a otras estructuras distintas del benceno. Así, algunas de estas son muy relevantes como por ejemplo el caso de la purina.
Criterios de aromaticidad en heterociclos
Criterio termodinámico
Se define sistema antiaromático a los sistemas cíclicos conjugados que son termodinámicamente menos estables que los análogos cíclicos correspondientes.
- Aromático cuando la energía de deslocalización del sistema cíclico es mayor que la del sistema acíclico. (4n+2 Hückel).
- No aromático cuando la energía de deslocalización del sistema cíclico es igual a la del sistema acíclico. (independientes).
- Antiaromático cuando la energía de deslocalización del sistema cíclico es menor a la del sistema acíclico. (4n Hückel).
Ejemplos
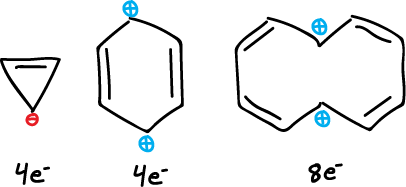
Tanto el catión como el anión del ciclooctatetraeno son planos y son aromáticos debido a que presentan 6e- y 10e- (regla de Hückel 4n+2), respectivamente.
Longitud de enlace
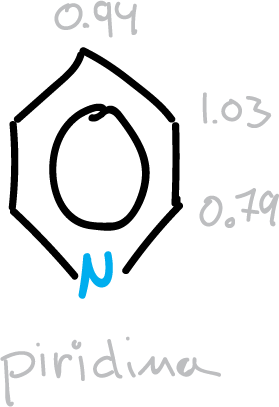
Los compuestos aromáticos, en general, muestran una distancia de enlace intermedia entre los valores estandar de enlace doble C=C y sencillo C—C. En el benceno, la distancia carbono-carbono es 1.395 Å ≅ 1.4 Å, intermedia entre los valores del enlace doble C=C que es igual a 1.33 Å y la del enlace sencillo C—C igual a 1.53 Å.
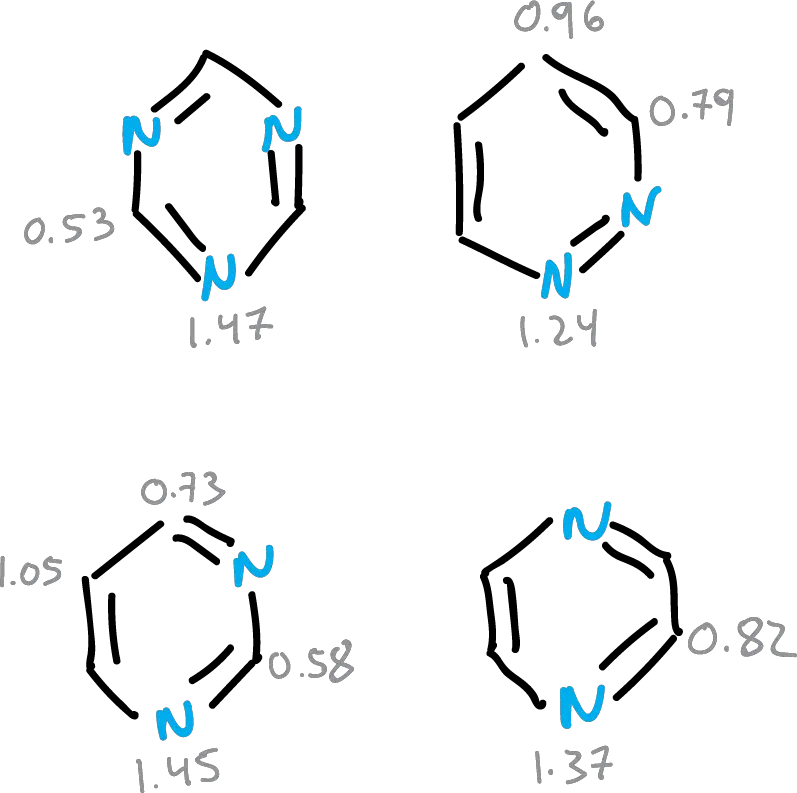
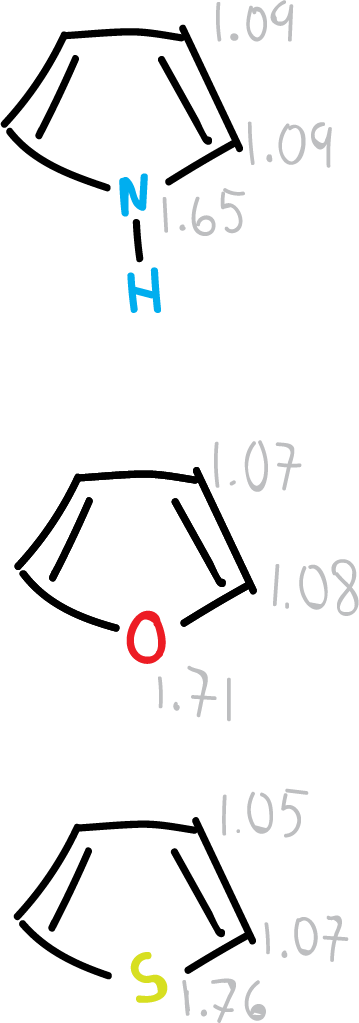
Para los heterociclos de 6 miembros, este valor intermedio se aproxima a los valores relales, siempre considerando la perturbación que origina el heteroátomo.
- Valores intermedios entre enlace doble y sencillo para los de 6 miembros, y como consecuencia hay una deslocalización cíclica de los electrones π en esos compuestos.
- Para los anillos de 5 miembros hay un considerable grado de alternancia que implica una localización de estructuras. Presentando, el oxígeno el mayor grado de localización.
- Los heterociclos fusionados presentan un mayor grado de localización.
Se han propuesto diferentes índices estructurales de aromaticidad en función de las distancias de enlace que puedan cuantificar la aromaticidad en moléculas. En la figura, se resumen los datos para diferentes heterociclos.

Espectroscopía RMN en heterociclos
Se justifica el desplazamiento a campo bajo de los protones aromáticos con relación a los vinílicos, debido a una corriente circular diamagnética inducida que se opone al campo externo, en el interior del anillo (corriente diamagnética del anillo).
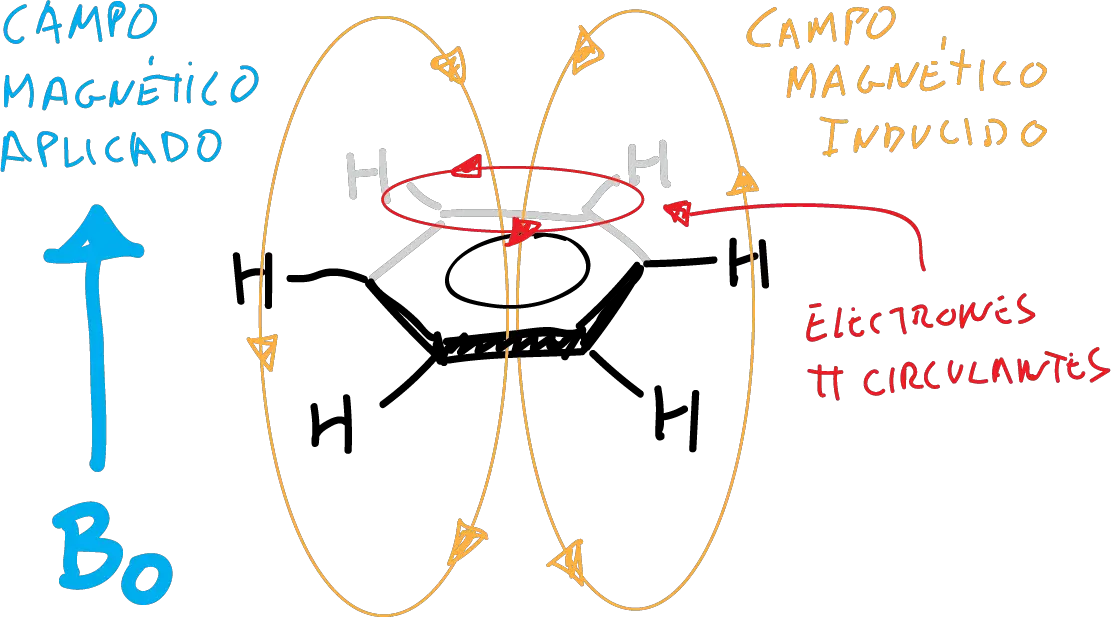
Esto no se da en los compuestos antiaromáticos, y por tanto se puede mediar la aromaticidad de un carbociclo por su datos de RMN.
- En heterociclos no hay una regla, ya que no es facil encontrar compuestos heterocíclicos antiaromáticos para comparar.
- Los desplazamientos químicos están influenciados por otros factores al margen de la corriente diamagnética inducida, incluyendo la distorsión de la distribución de electrones π y el efecto de disolvente.
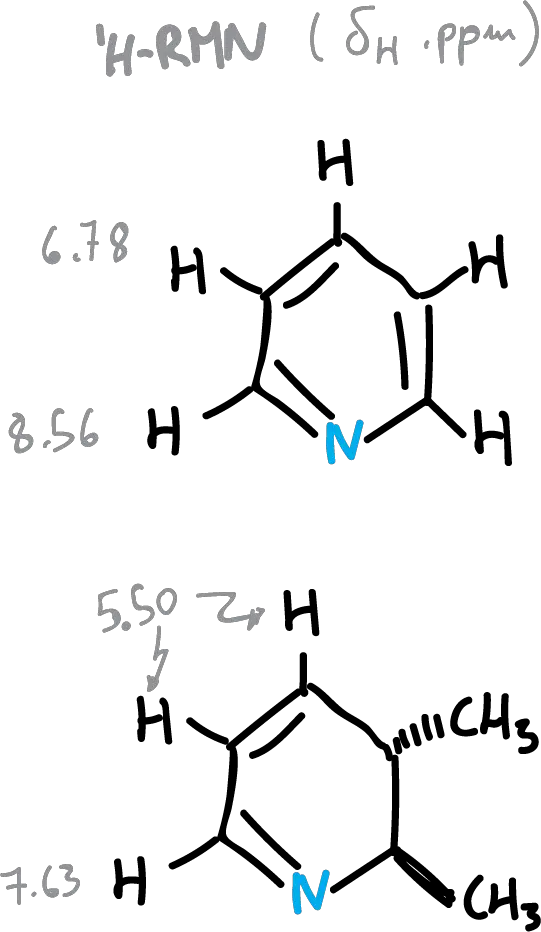
Un resumen de valores de desplazamientos químicos (δH) de heterociclos se recogen en la siguiente figura. El efecto de la corriente diamagnética, como se observa es más cualitativo que cuantitativo. Se aprecia una corriente que disminuye en el siguiente orden: benceno > piridina > tiofeno > pirrol > furano.

La energía de deslocalización en la piridina y otros anillos bencenoides, es la misma que la del benceno, si no se considera la perturbación originada por el cambio de CH por nitrógeno. Así, progresivamente van siendo menores para otros heterociclos: quinolina, pirimidina, pirrol y tiofeno.
Carácter aromático y otros tipos de heterociclos insaturados
Sistemas monocíclicos que obedecen la regla de Hückel
Se han sintetizado muchos heterociclos que obedecen la regla de Hückel, en sistemas monocíclicos insaturados. Así, el heterociclo, generalmente nitrogenado, puede formar parte de un doble enlace, como en la piridina, o donar un par de electrones al sistema π, como en el pirrol.
Para heterociclos del tipo: 
estaríamos en el caso límite, pero no hay pruebas de que se favorezca una estructura cíclica plana que tendría 6 electrones π en dichos compuestos.
El ozono, por ejemplo, no es cíclico y alguna triaziridina que se ha aislado revierte rápidamente a la forma abierta. Los resultados de cálculos de OM indican nitrógeno piramidal y estructuras cíclicas con mayores energías que para las formas lineales.
En sistemas de 4 miembros del tipo: 
sólo se han aislado el ditieto:

y no hay certeza de que el anillo sea aromático.
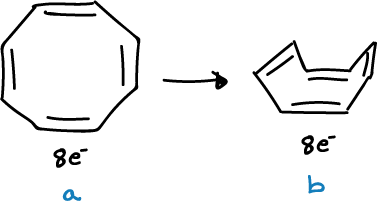
Por otro lado, se han sintetizado diferentes heterociclos con 10 electrones π de diferentes tipos. De esta forma, se han podido obtener heterociclos con enlaces dobles cis, incorporando un nitrógeno pirrólico en un anillo de 9 miembros, o bien dos nitrógenos en un anillo de 8 miembros, como se indica en las figuras.
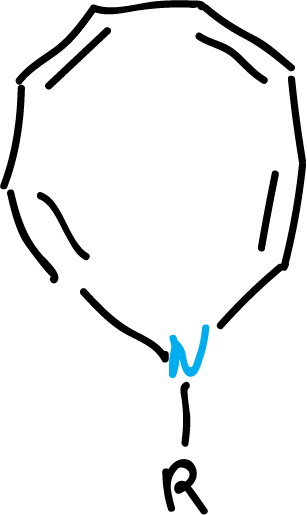
A pesar de la tensión, ambos compuestos parecen ser bastante planos, como para sustentar una corriente anular, a menos que los sustituyentes (-R), sean fuertemente electrón-atrayentes.
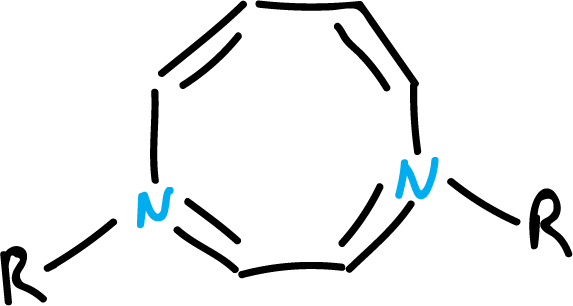
En este caso, las estructuras no serán planas, debido a una mayor localización, de los pares de electrones, sobre los heteroátomos, cuando -R es electron-atrayente.
Un tercer tipo de estructura es la que contiene dos enlaces dobles transoides unidos por un puente de metileno. El sistema se indica en la figura.

Se pueden considerar aromáticos, según criterio de longitudes de enlace y de su espectro 1H de RMN.
Sin embargo, existen todavía algunos aza-anulenos mayores que contienen 14 electrones π o 18 electrones π. Su aromaticidad se ha puesto de manifiesto por su espectro de 1H de RMN.
Existen, también, algunos heterociclos fusionados distintos a los benzofusionados que presentan indicios de deslocalización cíclica. Por ejemplo, la indolizina, presenta una apreciable energía de resonancia,
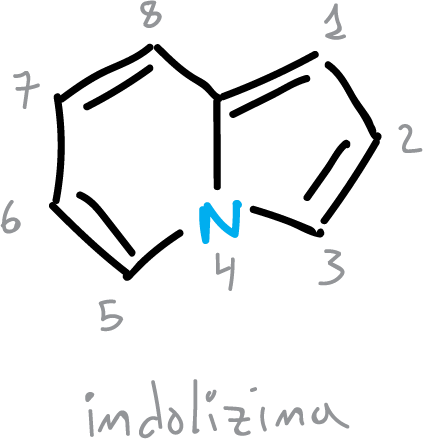
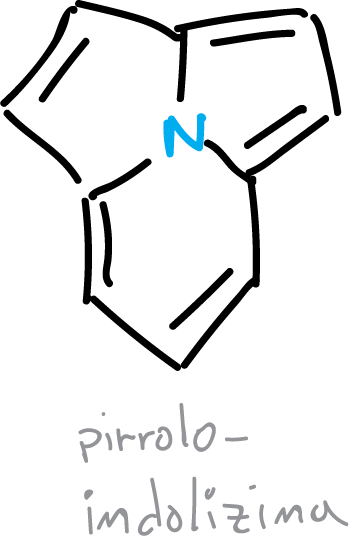
Además, el heterociclo pirroloindolizina (pirrolo[2,1,5,cd]indolizina) también presente deslocalización de electrones en los 3 anillos.
Tautomerías de compuestos heteroaromáticos
Muchos compuestos heteroaromáticos pueden existir en dos o más formas tautoméricas. El ejemplo más típico se dá en las piridinas que presentan en la posición α un sustituyente hidroxílico o amínico. Entonces, el protón hidroxílico o uno de los amínicos puede localizarse sobre el heteroátomo o del heterociclo.
Los equilibrios se establecen normalmente en disolución, por transferencia rápida del proton.
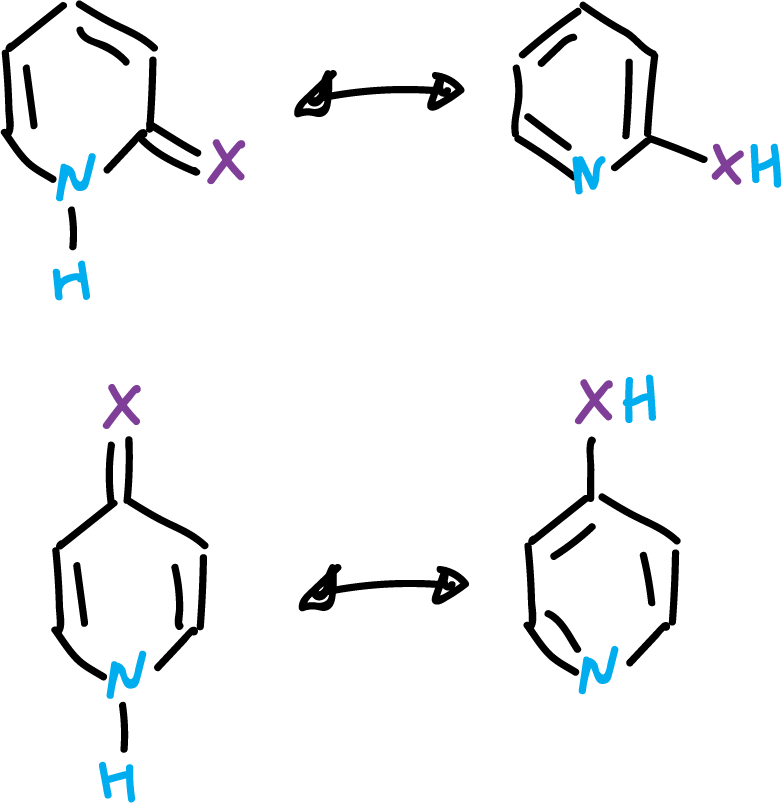
Estos equilibrios son de particular importancia en los derivados de pirimidina y purina, debido a que forman parte de los ácidos nucleicos.
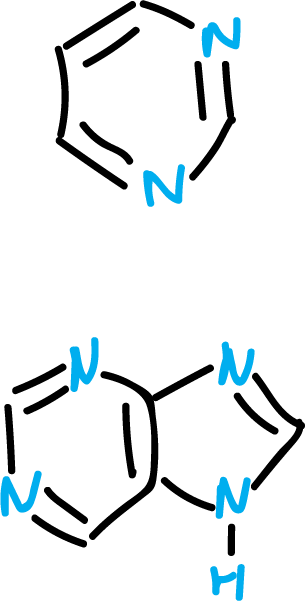
Si un tautómero predomina en disolución, su estructura se representa normalmente así, y esto se detacta por comparación de sus datos espectroscópicos con sus derivados alquilados.
Ejemplos:
Los datos espectroscópicos de la 2-piridona están muy cercanos a los de la N-metil-2-piridona.
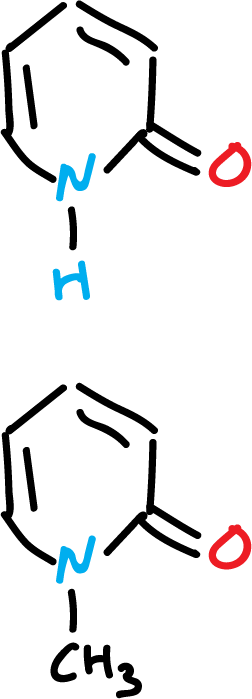
Los desplazamientos químicos de los nitrógenos en (15N-RMN) se utilizan con frecuencia para asignar la estructura preferente de un equilibrio tautomérico.
En otro ejemplo, la pirazina-2-tiona, existe (según los datos de los desplazamientos de 15N-RMN) como se muestra en la figura, en un 97 % como 2-tiona.
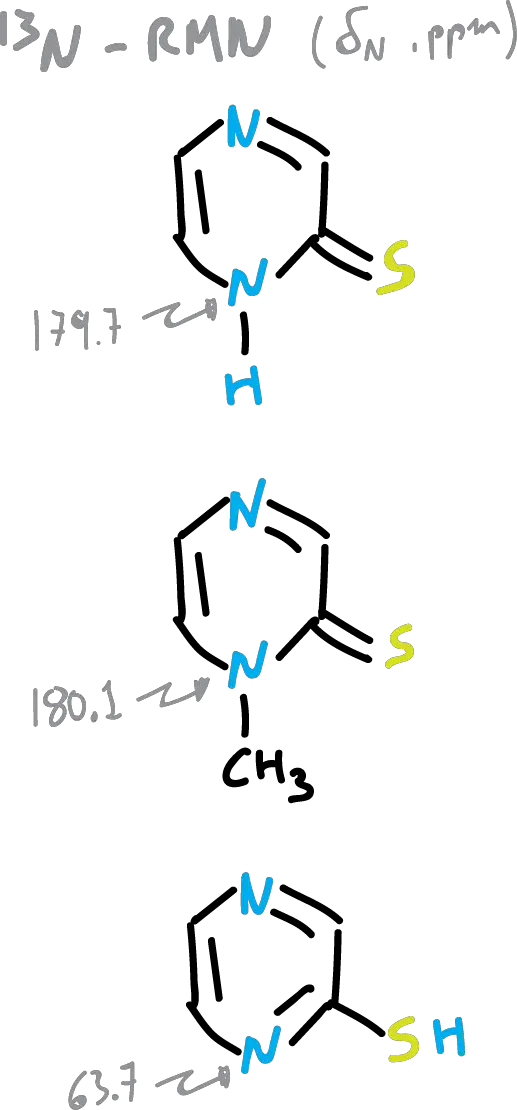
Los disolventes polares pueden desplazar los equilibrios, ya que los tautómeros están solvatados de forma diferente.
Los tautómeros difieren, generalmente, en polaridad y en su capacidad para formar enlaces de hidrógeno con el disolvente. No obstante, conviene aclarar que las reacciones químicas no tienen lugar, necesariamente, sobre la estructura predominante de una mezcla de tautómeros. Particularmente, si la transferencia protónica ocurre rápidamente.
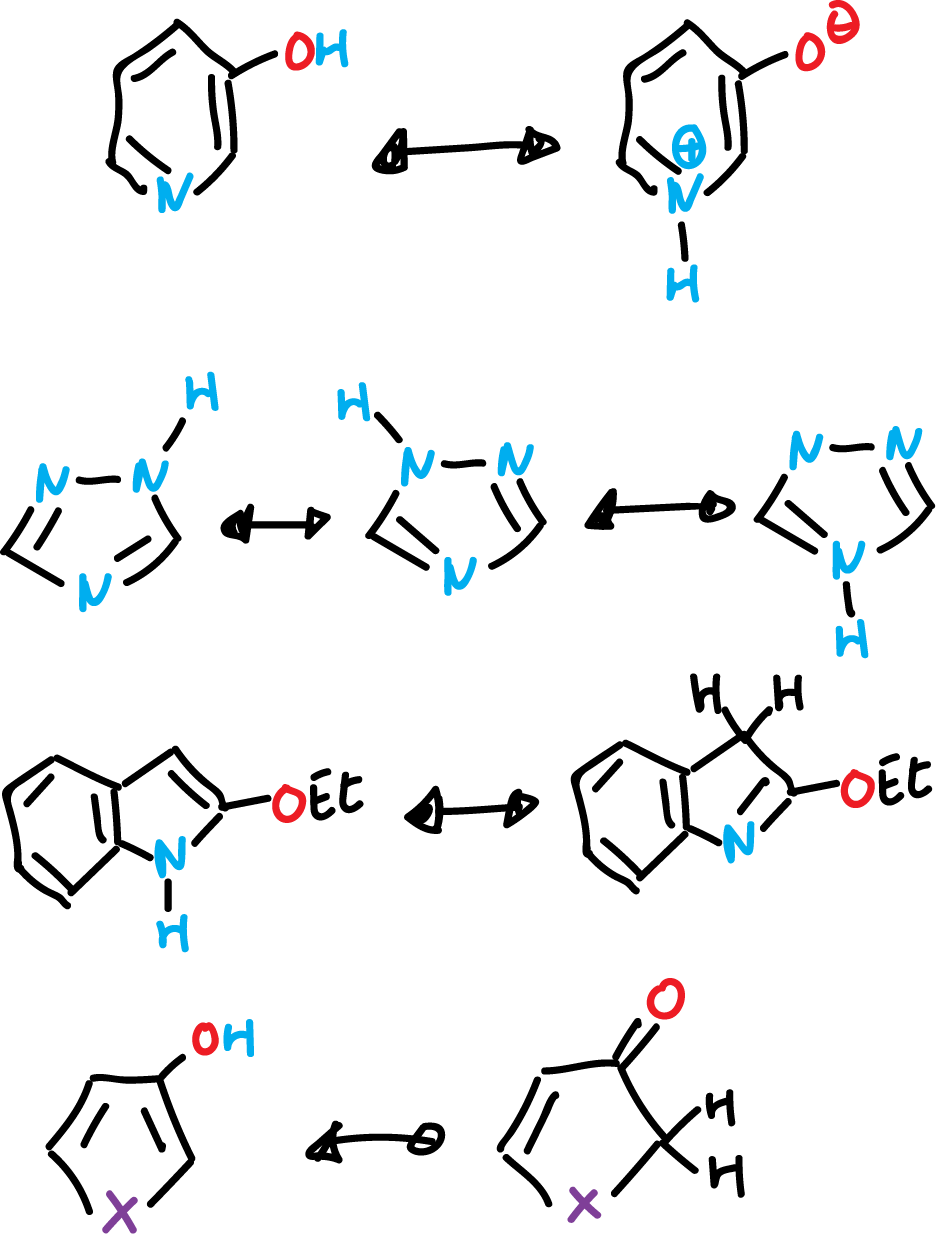
Existen otros tipos de tautomerías (por ejemplo, el primer equilibrio de 3-hidroxi-pirimidina ↔ óxido de pirimidinio) en heterociclos aromáticos recogidos en el siguiente esquema:
Video sobre los Heterociclos Aromáticos
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
