Written by J.A. Dobado | Last Updated on 1 año
La Química de heterociclos de 3 miembros está dominada por la tensión angular, lo que nos lleva a una gran reactividad.
Índice
El ataque de un nucleófilo a un carbono del anillo, el calentamiento o la irradiación, pueden sar como resultado la apertura del anillo.
Por tanto, los heterociclos de 3 miembros son moléculas anormalmente reactivas, y muy útiles como intermedios en síntesis.
Oxiranos (epóxidos)
Los oxiranos o epóxidos son reactivos muy comunes en Química Orgánica, ya que se pueden formar o destruir el sistema anular con facilidad y de manera altamente selectiva.
Se encuentran presentes en muchos compuestos de interés biológico. Los oxiranos derivados de hidrocarburos aromáticos (óxidos de areno) son intermedios en reacciones de hidroxilación aromática en sistemas vivos.
Los oxiranos derivados de alquenos sencillos, por reacción catalítica con oxígeno, son productos químicos industriales en gran escala, que se utilizan para la fabricación de polímeros.
Existen diferentes procedimientos de síntesis de oxiranos, casi todos partiendo casi siempre de olefinas.
Síntesis de oxiranos mediante epoxidación de olefinas
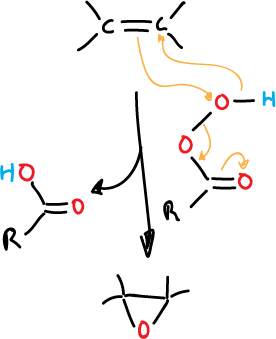
Los reactivos más comunes que se utilizan para esta reacción son los ácidos perocarboxílicos (perácidos).
Cuando se hace reaccionar un alqueno con un perácido orgánico se rompe el enlace π, formándose un éter cíclico de 3 miembros.
Los perácidos más utilizados son el ácido perbenzoico, el ácido monoperftálico y el ácido peracético.
Los perácidos son electrófilos y atacan a la nube π del alqueno. Este ataque está favorecido si hay sustituyentes que liberen electrones.
El mecanismo para el ataque se cree que es el siguiente:
La reación es estereoespecífica, transcurriendo mediante una adición cis, como se ilustra en la figura siguiente:
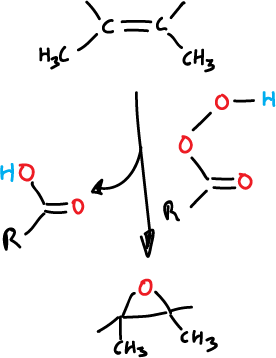
La epoxidación se realiza por la cara menos impedida de la olefina.
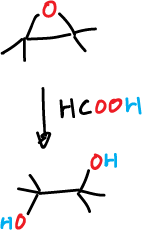
El ácido perfórmico no puede utilizarse, ya que el ácido fórmico liberado es muy fuerte y ataaría al epóxido formando un diol trans.
Cuando el enlace olefínico se encuentra conjugado con un grupo que atrae electrones fuertemente, como el grupo carbonilo (>C=O) o ciano (—C≡N), la velocidad de epoxidación se hace más lenta, o bien la reacción deja de afectarse.
Para sistemas de este tipo se suele emplear la epoxidación con peróxido de hidrógeno (HOOH) alcalino (HO⊖).
La reacción se efectúa mediante una adición de Michael del anión hidroperóxido al sistema insaturado, seguido por desplazamiento intramolecular del ión hidroxilo.
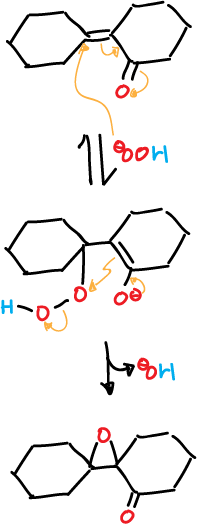
La epoxidación con peróxido de hidrógeno no es estereoespecífica, como en el caso del perácido. Sin embargo, suele formarse un sólo epóxido, que no guarda relación estereoquímica con el reactivo.
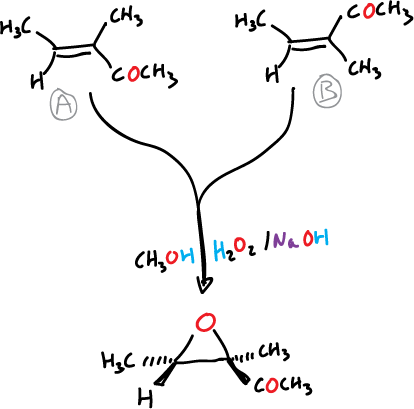
Por ejemplo, la oxidación con peróxido de las cetonas isómeras A y B, producen el mismo epóxido, como se muestra en el esquema.
Los nitrilos α,β-insaturados, en estas condiciones producen α,β-epoxiamidas.
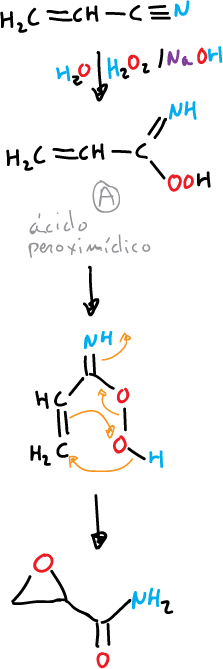
La reacción se efectúa mediante el intermedio A (ácido peroximídico) que funciona como un reactivo electrófilo.
Síntesis de oxiranos a partir de halohidrinas
En realidad este método parte también de olefinas ya que las halohidrínas provienen de olefinas.
Reacción de Darzens de síntesis de oxiranos
La reacción de Darzens parte de compuestos carbonílicos. Se puede representar por la adición de cloroacetado de etilo al grupo carbonilo de la acetofenona, en condiciones de catálisis de una base muy fuerte como el terbutóxido potásico (tBuOK) o amiduro sódico (NaNH2).
Inicialmente, se forma una halohidrina (clorhidrina) que en medio básico origina el epóxido.
fig-09
La reacción es reversible hasta que se anhidriza, entonces se convierte en irreversible.
La reacción de Darzens no suele acabar en el epóxido, sino que con una base cono el hidróxido sódico (NaOH) da lugar a un aldehído, produciéndose una dexcarboxilación (perdida de CO2).
fig-10
Síntesis de oxiranos mediante eliminación de un tosilato
Esta reacción parte de un alcohol, y está relacionada con la eliminación de HX en las halohidrinas.
fig-11
Síntesis de oxiranos mediante reacción de aldehídos aromáticos con triamidas fosfóricas
Las triamin fosfinas reaccionan con aldehídos aromáticos para dar oxiranos, como se indica en la siguiente figura:
fig-12
El mecanismo propuesto consiste en las siguientes etapas.
fig-13
Obtención industrial de oxiranos por oxidación de olefinas
Este procedimiento es bueno para obtener el óxido de etileno, en cambio origina problemas con el propileno, que suele oxidar al metilo de la posición alílica. Se lleva a cabo con hidroperóxidos, como por ejemplo: hidroperóxido de etilbenceno o hidroperóxido de terbutilo (tButOOH)
fig-14
La reacción se realiza en dos pasos:
- En una primer paso, el oxígeno y la olefina se mezclan para dar el hidroperóxido correspondiente.
fig-15
- En un segundo paso, el hidroperóxido oxida a la olefina, formándose el alcohol correspondiente.
fig-16
Reactividad de los oxiranos
La reactividad tan marcada de los oxiranos se debe a la tensión anular. Los ángulos de enlace promedio de 60º de un triángulo son, considerablemente, más pequeños que el ángulo tetraédrico de los carbonos (109.5º), o el del oxígeno divalente (110º).
A continuación, se listan primero las reacciones que tienen lugar en medio ácido y en medio básico.
Apertura de oxiranos catalizada por ácido
En general, los epóxido u oxiranos pueden protonarse como los éteres, pero una vez protonados pueden sufrir ataques por diversos nucleófilos, que dan lugar a hidroxilación anti.
fig-17
Cuando el epóxido es asimétrico el ataque del nucleófilo transcurre en la posición que se indica en la siguiente figura:
fig-18
Si la reacción se lleva a cabo con cloruro de hidrógeno (HCl) o bromuro de hidrógeno (HBr) gaseosos, se produce la reacción inversa a la síntesis de epóxidos a partir de halohidrina.
fig-19
El óxido de etileno puede polimerizar, en medio ácido como se indica en el esquema:
fig-20
Apertura de oxiranos catalizada por bases
Los oxiranos se diferencian más de los éteres corrientes, por este tipo de apertura de anillo. Así, el ataque lo sufre el epóxido mismo, no el epóxido protonado.
fig-21
Cuando esta reacción se lleva a cabo en medio ácido, transcurre como se indica en el siguiente esquema, dando el mismo producto que en medio básico.
fig-22
Aunque las dos reacciones anteriores den el mismo producto, existen diferencias entre llevar a cabo la reacción en medio ácido o básico. Esto se pone de manifiesto cuando se utiliza como material de partida un epóxido asimétrico.
fig-23
En medio ácido el lugar preferido por el nucleófilo es el carbono central, debido a que en esa posición se acomoda mejor la carga.
fig-24
En cambio, el ataque del nucleófilo en medio básico, tiene lugar en el carbono menos impedido estéricamente.
fig-25
Resumiendo los dos tipos de reacciones:
- En medio básico predomina la interacción estérica.
- En medio ácido predomina la interacción electrónica.
Apertura de oxiranos por adición de otros nucleófilos
En los siguientes esquemas se muestran otros ejemplos de adición de otros nucleofilos de diferente tipo (NH3, SH2, CH3MgBr, AlLiH4), que también producen apertura de oxiranos.
fig-26
Transposición de oxiranos a dihidrofuranos
Los viniloxiranos pueden sufrir una transposición a dihidrofuranos, mediante una reacción que implica una ciclación 1,5-dipolar.
fig-27
Desoxigenación de oxiranos
Los epóxidos se pueden desoxigenar con facilidad mediante fosfinas terciarias a temperaturas elevadas (150-200 ºC) produciendo olefinas.
fig-28
Dependiendo de la configuración del epóxido se la mezcla de alquenos quedaría mayoritariamente en los alquenos (Z o E), como se indica en el esquema. Los epóxidos cis dan, mayoritariamente, alquenos E, y los trans dan lugar a alquenos Z.
La reacción se efectúa por ataque nucleofílico de la fosfina terciaria en un átomo de carbono del epóxido, por lo que se obtiene un producto similar a la betaina.
fig-29
El cual al rotar 180º en el enlace central C—C, se rompe y libera el óxido de fosfina para dar como producto predominane una olefina de configuración opuesta a la del epóxido inicial.
Ejemplos de utilización de oxiranos en Síntesis
- La reacción de Darzens para la formación de ácido glicídico, engloba la reacción o condensación de una cetona o un aldehído aromático con un α-haloéster, en presencia de una base fuerte como el terbutóxido potásico (tBuOK) o amiduro sódico (NaNH2).
El producto, inicialmente formado (producto de condensación aldólica), se cierra a un anillo oxiránico por vía intramolecular. Estas sustancias son llamadas ésteres glicídicos o α,β-epoxiésteres.
- Los epóxido se pueden utilizar como agentes alquilantes para compuestos con metileno activo.
fig-30
- Reacción de epóxidos con dimetilsulfóxido (DMSO) generan sales de dihidroxialquil dimetilsulfonio que en medio básico forman las correspondientes aciloínas (α-hidroxicetonas).
fig-31
Aziridinas
Al igual que los oxiranos, las aziridinas son también heterociclos muy lábiles. Presentan gran tendencia a la apertura, por lo que son buenos agentes alquilantes. Por esta misma razón, muchas de las aziridinas son tóxicas y agentes mutagénicos.
Existen en la naturaleza, como por ejemplo, el antibiótico y antitumoral mitomicina C, cuyo carácter antibiótico está asociado al anillo aziridínico.
fig-32
Síntesis del anillo
Casi todas las reacciones de síntesis del anillo de aziridina son reacciones de cierres provocados por sustituciones intramoleculares. Estos cierres son muy parecidos a los empleados en la síntesis de oxiranos.
Los productos de partida son generalmente aminoalcoholes, que a su vez pueden obtenerse de los oxiranos por reacción con amoniaco (NH3). Normalmente el grupo hidroxilo (–OH) se transforma en un buen grupo saliente con el reactivo adecuado (grupo sulfonato o benceno sulfonato).
Síntesis de Wenker de aziridinas
La síntesis de Wenker es la conversión (en medio ácido) de un β-amino alcohol en un sulfato β-aminohidrogenado que cicla por tratamiento con una base fuerte.
fig-33
Obtención de α-haloaminas y posterior ciclación
Otro método de obtención de aziridinas sería la conversión del amino alcohol en β-haloamina y su posterior ciclación como se indica en la figura.
fig-34
Las α-haloaminas se pueden obtener a partir de alquenos de la siguiente forma:
fig-35
A partir de olefinas e isocianato de yodo
Las aziridinas también se pueden sintetizar a partir de olefinas, si se las trata con isocianato de yodo.
fig-36
En condiciones básicas, el NH del grupo carbamato se desprotona parcialmente. Así, el anión resultante logra un desplazamiento interno de tipo SN2, que conduce al carbamato ciclado que a su vez se hidroliza y genera la correspondiente aziridina.
fig-37
Cicloadición 1,3-dipolar entre azida y olefinas
Otra ruta sintética para la preparación de aziridinas, consiste en la reacción de cicloadición 1,3-dipolar de azidas a olefinas, como se indica en el siguiente esquema.
fig-38
Se forman 1,2,3-triazoles inermedios con retención de la configuración de la olefina de partida que o bien térmicamente o fotoquímicamente generan la aziridinina correspondiente con perdida de nitrógeno (N2).
Funcionalización del nitrógeno
El nitrógeno de las aziridinas (N—H), o bien los nitrógenos de las aziridinas N-alquiladas, es nucleófilo. Por tanto, se puede comportar como aminas secundarias o terciarias. Así pues, es susceptible de alquilarse con haloalcoanos, epóxidos y reactivos similares. De esta forma, sufren reacciones de adición conjugada que generan nitrilos y compuestos carbonílicos a,b-insaturados.
Por otro lado, se pueden preparar, también, N-cloro y N-acilaziridinas, a partir de los compuestos sin sustituyentes en el nitrógeno.
Algunos ejemplos en los que se pueden aislar productos de sustitución con buen rendimiento se indican a continuación:
fig-39
Reacciones de apertura de anillo
La facilidad de apertura del anillo por nucleófilos depende de las propiedades aceptoras de electrones del sustituyente N—R(H), efectos estéricos sobre los carbonos del anillo y de la naturaleza del atacante. Entonces, la rotura tiene lugar sobre el carbono menos sustituido.
fig-40
Reacciones de fragmentación
Las aziridinas no sustituidas en el nitrógeno se desaminan estereoselectivamente con cloruro de nitrosilo (NOCl). El mecanismo transcurre, probablemente, a partir de N-nitrosoaziridina.
fig-41
Tiiranos (sulfuro de etileno)
Los tiiranos, o sulfuros de etileno, tienen mucho en común con los demás heterociclos de 3 miembros. Sin embargo, parte de su Química se asocia específicamente a la presencia del átomo de azufre.
Por ejemplo, existen dos versiones oxidadas del sistema anular, el monóxido y el dióxido que se muestran en el esquema.
fig-42
Síntesis de tiiranos
Se obtienen a partir de oxiranos, por reacción con iones tiocianato o con tiourea.
fig-43
Reactividad de tiiranos
Analogamente a las aziridinas y oxiranos, los tiiranos sufren rotura anular por acción de ácido o base diluida.
fig-44
2H-Aziridinas
De los dos posibles isómeros de las azirinas solo se ha podido aislar y caracterizar las 2H-azirinas. Sin embargo, es inestable por encima de la temperatura del nitrógeno líquido (-196 ºC).
fig-45
Muchas otras aziridinas son líquidos o sólidos aislables de bajo punto de fusión. Además, la mayor parte de los compuestos conocidos de este tipo presentan un sustituyente alquilo, arilo o dialquilamino en la posición 3.
fig-46
Síntesis de 2H-aziridinas
El método más general de síntesis de estos compuestos es la desomposición térmico o fotoquímica de azidas de vinilo. Esta reacción puede ocurrir a través de vinilnitrenos intermedios.
fig-47
Reactividad de 2H-aziridinas
La tensión anular desempeña un papel notable en la determinación de la Química de estos compuestos. Se pueden dar tres tipos de reacciones:
- Reacciones en el enlace C3=N1.
- Rotura térmica del enlace N1—C2.
- Rotura del enlace C2—C3 con luz ultravioleta (fotoquímicamente).
Reacciones en el enlace C3=N1 de 2H-aziridinas
Este enlace es susceptible al ataque nucleofílico.
El hidruro de aluminio y litio (LiAlH4) reduce el enlace con formación de aziridinas. Además, la reducción es estereoselectiva y tiene lugar por la cara menos impedida.
Una reacción similar ocurre con los reactivos de Grignard.
fig-48
Rotura térmica del enlace N1—C2 de 2H-aziridinas
Esta reacción de rotura térmica del enlace N1—C2 es la inversa de la ciclaión de vinilnitrenos.
La termólisis da como resultado, con frecuencia, la rotura de este enlace. Sin embargo, a veces se encuentran productos derivados de la rotura del enlace C—C.
Cuando se calientan las azirinas, con sustituyentes conjugativo en C2, el producto principal es a menudo un anillo de 5 miembros. Este anillo es un derivado de una transposición que se forma por rotura del enlace y reciclación.
fig-49
Rotura fotoquímica del enlace C2—C3
La rotura con luz ultravioleta (fotólisis) de aziridinas implica a menudo la rotura de enlace C—C y formación de iluros de nitrilo.
fig-50
Heterociclos de 3 miembros con 2 heteroátomos
fig-51
Se pueden sintetizar con relativa facilidad pero su reactividad es muy elevada y poseen ciertas propiedades poco usuales.
Síntesis de oxaziranos
La preparación de estos compuestos se logra con facilidad mediante la inserción directa de un heteroátomo adecuado a un doble enlace carbonílico o imínico.
- Los oxaziranos se sintetizan mediante la oxidación de iminas con perácidos orgánicos. Es una reacción distinta a la epoxidación de olefinas, que era por etapas y se formaban intermedios de imina protonada. A diferencia, en oxidación de iminas se forman nitronas como subproductos.
fig-52
Otro método de síntesis sería la reacción de aldehídos y cetonas con cloroaminas (CH3NHCl).
fig-53
El mecanismo de reacción transcurre mediante una adición 1,2 inicial del componente que tiene nitrógeno al grupo carbonilo. Este proceso viene seguido por un desplazamiento intramolecular SN2.
fig-54
Síntesis de diaziridinas
Las diaziridinas se pueden preparar a partir de cetonas por reacción con amoniaco, o una amina primaria, junto con un agente aminante como la cloramina o el ácido hidroxil-amino-O-sulfónico.
fig-55
Otro método de cierre electrocícliclo de azometinimidas estabilizadas ocurre en presencia de luz ultravioleta, y es reversible.
fig-56
Además otras diaziridinas con sustituyentes electrón-atrayentes (conjugativas) tambíen se rompoen con calor.
Síntesis de 3H-diazirinas
Las 3H-diazirinas son isómeros cíclicos de los diazoalcanos y de hecho se han obtenido algunas diazirinas por fotoisomerización de los diazoalcanos. Sin embargo, la forma más fácil de obtenerlos es la oxidación de las diaziridinas no sustituidas con: óxido de plata, permanganato potásico, oxido de mercurio, etc.
Reactividad de oxaziranos
Los oxaziranos son compuestos oxigenados activos, comparables en gran medida a los peróxidos orgánicos. El anillo de oxazirano suele descomponerse lentamente en presencia de ácidos fuertes, pero es estable ante reactivos básicos débiles, aunque presenta excepciones.
La estabilidad varía en función de la naturaleza y numero de sustituyentes en la molécula.
Normalmente, el anillo de oxazirano se rompe en todas sus reacciones. Como, por ejemplo, la formación de iminas y aminas del siguiente esquema.
fig-57
La hidrólisis ácida se produce con formación de un aldehído aromático y una alquilhidroxilamina.
fig-58
Esta reacción presenta una estabilidad configuracional en el nitrógeno.
También, las N–sulfoniloxaziridinas son excenlentes reactivos de transferencia de oxígeno.
Por ejemplo, el compuesto opticamente activo, canforsulfoniloxaziridina, y su enantiómero han sido usados como reactivos asimétricos de transferencia de oxígeno.
fig-59
Aunque el anillo de oxazirano es estable frente a reativos básicos, sin embargo, los oxaziranos con sustituyentes 2-metileno o 2-metinilo reaccionan vigorosamente con alcali en disolución acuosa o alcohólica. Producen amoníaco en forma cuantitativa.
fig-60
Reactividad de diaziridinas
Las diaziridinas que también son un tipo de agentes oxidantes, son más estables que los oxaziranos. Además, son ligeramente básicas y forman sales pero igualmente se hidrolizan con facilidad en solución ácida, para dar un compuesto carbonílico y una hidrazina. Por otro lado, son estables frente a alcali.
Se pueden hidrogenar cataliticamente y dan dos aminas, pero con hidruro de aluminio y litio (LiAlH4) se obtienen otros tipos de aminas.
fig-61
En la hidrólisis ácida, el aumento de sustituyentes sobre el átomo de carbono acelera la hidrólisis.
fig-62
Por otro lado, las diaziridinas, que contienen por lo menos un grupo NH, experimentan ciertas reacciones características de aminas secundarias, con retención del anillo.
Por ejemplo, la condensación de diaziridinas con cloral (tricloroacetaldehído).
fig-63
Reactividad de 3H-diazirinas
Los isómeros de diazoalcanos presentan notables diferencias con las 3H-diazirinas, como por ejemplo que son más estables y de menor reactividad, a excepción de su naturaleza explosiva (en los derivados de bajo peso molecular). Sin embargo, los ácidos y los alcali no reaccionan con el anillo de 3H-diazirinas a temperatura ambiente.
La descomposición térmica o fotoquímica de 3H-diazirinas produce la salida del nitrógeno, en presencia de nitrobenceno, como se ilustra en el siguiente esquema.
La fotólisis en presencia de trans-2-buteno produce principalmente trans-ciclopropano.
fig-64
También, pueden sufrir reacciones con retención del anillo. Por ejemplo, la adición de reactivos de Grignard.
fig-65
