Written by J.A. Dobado | Last Updated on 12 meses
Objetivo
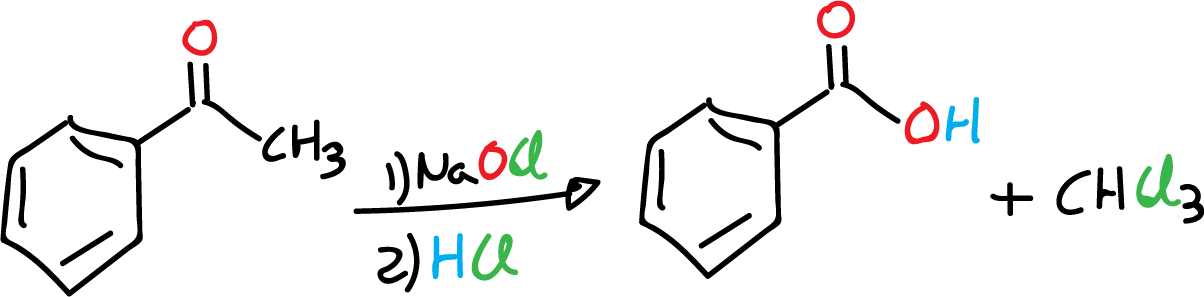
El propósito de esta práctica es llevar a cabo una modificación de la reacción del haloformo, usando reactivos químicos oxidantes cotidianos como lejía (hipoclorito sódico, NaOCl).
Índice
Antecedentes
La reacción de haloformo es característica de los compuestos que presentan un grupo metilo (CH3) adyacente a un grupo carbonílico (C=O). A las familias de moléculas con este tipo de agrupamiento de grupos funcionales se les denomina metilcetonas. La reacción de haloformo se lleva a cabo usando cloro en medio básico para dar un ácido carboxílico. Esta reacción se utiliza como prueba analítica para detectar las metilcetonas. En esta práctica se modifica el proceso sustituyendo el cloro (Cl2) por blanqueador comercial de fácil manejo (lejia, hipoclorito sódico, NaOCl), para la oxidación de metilcetona.
Procedimiento experimental
Pesar 2.5 ml de acetofenona (anotar el peso en gramos), y colóquelo en un matraz de fondo redondo de 250 ml con imán (para agitación magnética). Por cada gramo de acetofenona usada se le agregan al matraz 40 ml de lejía comercial (NaOCl al 5%). Agitar la mezcla a temperatura ambiente mientras se agregan 2.5 ml de solución de NaOH al 10% (por cada gramo de acetofenona usada).
Se acopla un refrigerante de reflujo y se procede a calentar la reacción en un baño maría (de agua a 70 ºC durante 20 min (agitación magnética).
Durante este tiempo de calentamiento, el cloroformo (CH3Cl) que se produce se evapora de la mezcla. Al comienzo de este proceso, se puede observar una capa aceitosa de acetofenona flotando sobre la mezcla acuosa; al final de la reacción, la fase aceitosa no se debería observar porque ha reaccionado para dar el producto (ácido benzoico).
Después del calentamiento, enfriar la reacción a temperatura ambiente (usar un baño de hielo externo si es necesario), retirar el refrigerante de reflujo y agregar en pequeñas porciones 1 ml de acetona, mientras se agita para eliminar el NaOCl restante.
Agregue lentamente HCl (conc.) con una pipeta, con agitación, hasta que se haya formado una cantidad significativa de precipitado. Cuando no pueda detectar la formación de más precipitados, mezcle bien y verifique que el pH del líquido sea 2-3 o menos. Enfriar la mezcla en un baño de hielo para completar la cristalización del producto de ácido benzoico y aislar este producto mediante filtración a vacío.
Lave muy bien el producto con agua fría y luego déjelo secar en la corriente de vacío durante un tiempo. Pesar el ácido benzoico seco y calcular el rendimiento.
Propiedades físico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| Anhídrido acético | 102.09 | -73.1 | 139.8 | 1.080 |
| Ácido benzoico | 122.12 | 125 | 249 | 1.08 |
| Fenol | 94.11 | 40-42 | 182 | 1.07 |
| o-Nitrofenol | 139.11 | 45 | 214 | - |
| p-Acetamidofenol | 151.16 | 168-172 | - | - |
| p-Nitrofenol | 139.11 | 110-115 | 279 | 1.480 |
| 4-Aminofenol | 109.13 | 185-189 | - | - |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| Anhídrido acético |    |
| Ácido benzoico |   |
| Fenol |    |
| o-Nitrofenol |  |
| p-Acetamidofenol |  |
| p-Nitrofenol |   |
| 4-Aminofenol |    |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| Anhídrido acético | WFDIJRYMOXRFFG-UHFFFAOYSA-N |
| Ácido benzoico | WPYMKLBDIGXBTP-UHFFFAOYSA-N |
| Fenol | ISWSIDIOOBJBQZ-UHFFFAOYSA-N |
| o-Nitrofenol | IQUPABOKLQSFBK-UHFFFAOYSA-N |
| p-Acetamidofenol | RZVAJINKPMORJF-UHFFFAOYSA-N |
| p-Nitrofenol | BTJIUGUIPKRLHP-UHFFFAOYSA-N |
| 4-Aminofenol | PLIKAWJENQZMHA-UHFFFAOYSA-N |
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
- A. M. Van Arendonk and M. E. Cupery, The reaction of acetophenone derivatives with sodium hypochlorite, Journal of the American Chemical Society 53 (1931), no. 8, 3184–3186, DOI: 10.1021/ja01359a506
