Written by José | Last Updated on 2 meses
Objetivo
El propósito de esta práctica es la obtención de un ácido carboxílico por oxidación de un alcohol primario usando hipoclorito como oxidante.
Índice
Procedimiento experimental
Un método alternativo al uso de sales de cromo(VI) que son cancerígenas para la oxidación de alcoholes es el empleo de un agente oxidante verde como el hipoclorito. Una de las fuentes de hipoclorito más usuales es la lejía que es en realidad una disolución acuosa de hipoclorito cálcico.
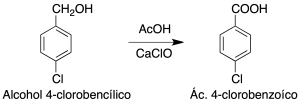
En el caso de los alcoholes primarios la oxidación con hipoclorito permite la obtención de ácidos carboxílicos si se emplea un exceso, ya que la reacción transcurre a través de un aldehído el cual se oxida hasta ácido con posterioridad.
Procedimiento experimental
En un Erlenmeyer disolver 0.5 g de alcohol 4-clorobencílico en 5 ml de acetonitrilo. Por otro lado, se pesan 2.4 g de hipoclorito cálcico comercial (65 %) y se transfieren a un matraz de fondo redondo. Se añaden 20 ml de agua agitando con un imán. Manteniendo la agitación se añaden 2 ml de ácido acético glacial, gota a gota. Se acopla el refrigerante de reflujo y el conjunto se introduce en un baño de agua.
Con la ayuda de una pipeta Pasteur se añade la disolución del alcohol a través del refrigerante. Una vez finalizada la adición, la reacción se calienta, durante 1 h, a baño María agitando vigorosamente, y evitando que la temperatura del baño supere los 50 ºC. Seguidamente, se enfría hasta alcanzar la temperatura ambiente.
El crudo de reacción se transfiere a un embudo de decantación, se le añaden 10 ml de agua y el matraz se lava con 10 ml de éter dietílico y se vierte sobre el embudo de decantación y se extrae. A continuación, se extrae de nuevo con éter dietílico (2 x 10 ml). Se juntan los extractos de éter y tratan con dos porciones de 10 ml de disolución acuosa saturada de bicarbonato sódico.
Las fases acuosas se reúnen y se acidifican con HCl al 5 % hasta pH = 3, obteniéndose un precipitado (ácido 4-clorobenzoico) que se separa por filtración a vacío. El producto se recristaliza de MeOH.
Propiedades físico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| Ácido acético | 60.05 | 16.2 | 118 | 1.049 |
| Acetonitrilo | 41.05 | -48 | 81-82 | - |
| Hipoclorito de calcio | 142.98 | 100 | - | 2.350 |
| Éter dietílico | 74.12 | -116 | 34.6 | 0.71 |
| HCl | 36.46 | -30 | >100 | 1.200 |
| MeOH | 32.04 | -98 | 64.7 | 0.791 |
| ácido p-clorobenzoico | 156.57 | 238-241 | - | - |
| Alcohol 4-clorobencílico | 142.58 | 68-71 | 234 | 1.200 |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| Ácido acético |   |
| Acetonitrilo |   |
| Hipoclorito de calcio |     |
| Éter dietílico |   |
| HCl |   |
| MeOH |    |
| ácido p-clorobenzoico |  |
| Alcohol 4-clorobencílico | No peligroso |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| Ácido acético | QTBSBXVTEAMEQO-UHFFFAOYSA-N |
| Acetonitrilo | WEVYAHXRMPXWCK-UHFFFAOYSA-N |
| Hipoclorito de calcio | ZKQDCIXGCQPQNV-UHFFFAOYSA-N |
| Éter dietílico | RTZKZFJDLAIYFH-UHFFFAOYSA-N |
| HCl | VEXZGXHMUGYJMC-UHFFFAOYSA-N |
| MeOH | OKKJLVBELUTLKV-UHFFFAOYSA-N |
| ácido p-clorobenzoico | XRHGYUZYPHTUJZ-UHFFFAOYSA-N |
| Alcohol 4-clorobencílico | PTHGDVCPCZKZKR-UHFFFAOYSA-N |

