Índice
Objetivo
El propósito de esta práctica es el aprendizaje de una serie de técnicas básicas en un laboratorio de Química Orgánica, como son:
- El empleo del reflujo como técnica general para realizar una reacción en caliente a la temperatura de ebullición de un determinado disolvente.
- La destilación simple como procedimiento para la purificación de sustancias líquidas.
- El uso de la destilación fraccionada (o con rectificación) para la purificación de mezclas de sustancias líquidas con p.e. próximos.
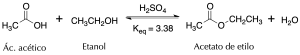
Para llevarla a cabo este objetivo se ha elegido la síntesis de un éster sencillo como el acetato de etilo.
Antecedentes
Los ésteres de ácidos carboxílicos se pueden formar por reacción entre un ácido carboxílico y un alcohol en presencia de un ácido prótico como catalizador, tal como el HCl o el H2SO4 (llamada esterificación de Fischer) o un catalizador ácido de Lewis tal como el trifluoruro de boro,[1] o por reacción de un derivado de ácido tal como cloruro de ácido o anhídrido con un alcohol.
Los ésteres son compuestos versátiles en Química Orgánica y se utilizan ampliamente debido a que se convierten fácilmente en una gran variedad de otros grupos funcionales.
Procedimiento experimental
En un matraz de boca esmerilada de 250 ml se colocan 40 ml de ácido acético glacial y 45 ml de EtOH del 96 %. Se añaden 5 ml de H2SO4 (conc.), gota a gota, con agitación magnética. A continuación, se adapta al matraz un refrigerante de reflujo y una torre de desecante. Una vez efectuado el montaje se procede a calentar a reflujo la reacción durante 1 h. Finalizado el reflujo se deja enfriar el contenido del matraz.
Se modifica el montaje disponiéndolo para una destilación simple con el objeto de separar el acetato de etilo formado junto al EtOH que no ha reaccionado y algo de ácido acético que se arrastra. Se mantiene la destilación hasta que no destile más líquido, quedando en el matraz el H2SO4 y el ácido acético que no ha reaccionado.
El destilado obtenido se introduce en un embudo de decantación y se agita con una disolución de carbonato sódico al 10 %, teniendo la precaución de abrir la llave inmediatamente al mezclar los dos líquidos, para permitir la salida del CO2 que se produce en la neutralización del ácido acético.[2] El acetato de etilo se continúa lavando hasta no observar reacción ácida.[3]
Se separa la capa orgánica (superior) y se lava con una disolución constituida por 20 g de CaCl2 en 25 ml de agua.[4] Nuevamente, se decanta en dos capas, desechándose la capa acuosa (inferior). La capa orgánica se transfiere a un Erlenmeyer seco al que se le añade Na2SO4 anhidro, para eliminar el agua que pueda contener. La mezcla se agita hasta obtener una disolución transparente.
Una vez seco el acetato de etilo, se separa el sólido (Na2SO4) por filtración por gravedad y el líquido obtenido se purifica mediante una destilación fraccionada. El destilado obtenido entre 75 y 78 ºC se mide con una probeta y se calcula la cantidad en peso obtenida sabiendo que la densidad es de 0.9 g·ml-1.
Propiedades físico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| Ácido acético | 60.05 | 16.2 | 118 | 1.049 |
| EtOH | 46.07 | -114.1 | 78.5 | 0.790 |
| Acetato de etilo | 88.11 | -84 | 77.1 | 0.902 |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| Ácido acético |   |
| EtOH |  |
| Acetato de etilo |   |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| Ácido acético | QTBSBXVTEAMEQO-UHFFFAOYSA-N |
| EtOH | LFQSCWFLJHTTHZ-UHFFFAOYSA-N |
| Acetato de etilo | XEKOWRVHYACXOJ-UHFFFAOYSA-N |
Referencias y notas
[1] Usualmente formando un complejo con el éter dietílico.
[2] La fase orgánica queda en la parte superior del embudo de decantación ya que el acetato de etilo es menos denso que el agua.
[3] Comprobar el pH de la disolución acuosa con un trozo de papel indicador. Este debe ser básico, señal de que no queda ácido en la fase orgánica.
[4] El calcio forma un complejo soluble en agua con el EtOH.
Volver a la página de prácticas de Operaciones Básicas de Laboratorio.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
