Written by J.A. Dobado | Last Updated on 1 año
Objetivo
El propósito de esta práctica es la obtención de un colorante azoico, el naranja de metilo, mediante la reacción de copulación de una sal de diazonio.
Índice
Antecedentes
Cada tipo de amina genera un producto diferente al reaccionar con el ácido nitroso, HNO2. Reactivo inestable que se forma in situ en presencia de la amina por acción de un ácido mineral sobre nitrito de sodio. Cuando una amina aromática primaria, disuelta o suspendida en un ácido mineral acuoso frío se trata con nitrito de sodio, se forma una sal de diazonio.
![]()
Puesto que estas descomponen lentamente, aún a la temperatura de un baño de hielo, se emplean sus soluciones de inmediato, una vez preparadas.
El gran número de reacciones que dan las sales de diazonio se pueden agrupar en dos tipos.
- Sustitución o reemplazo: en las que se pierde el nitrógeno en forma de N2, quedando en su lugar en el anillo otro grupo.
![]()
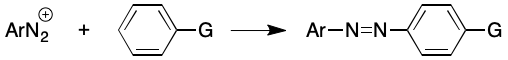
- Copulación: en las que el nitrógeno permanece en la molécula. La copulación de sales de diazonio con fenoles y aminas aromáticas genera azo-compuestos, los cuales son clave en la industria de los colorantes.
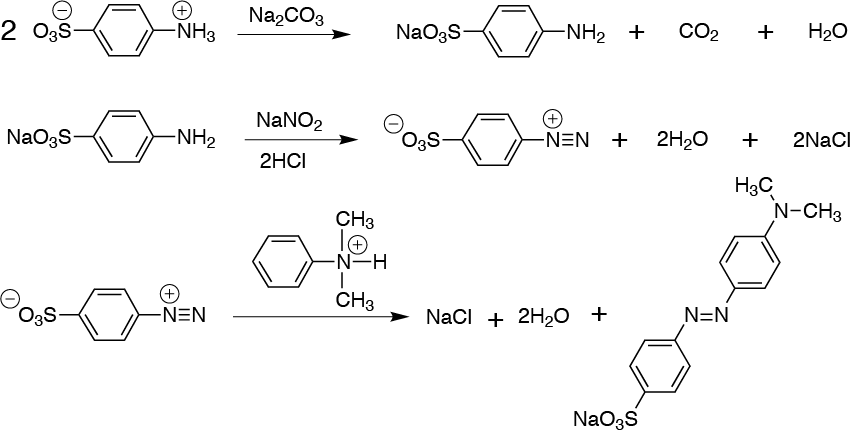
La obtención de un colorante diazoico consta de las siguientes operaciones:
- Diazotación de una sustancia aromática que contenga un grupo amino primario.
- Preparación de una disolución de algún compuesto amino-aromático en un ácido diluido o de una sustancia fenólica en un álcali diluido.
- Mezclado de las soluciones anteriores con la consiguiente formación del correspondiente colorante diazoico, en una reacción que se denomina copulación. Para que tenga lugar esa reacción, la solución debe estar alcalina o ligeramente ácida.
En nuestro caso, para la obtención del naranja de metilo, se comienza por la diazotación del ácido sulfanílico, se disuelve dimetilanilina en HCl diluido, y finalmente se mezclan ambas soluciones para que tenga lugar la reacción de copulación.
Procedimiento experimental
Preparar de forma independiente las siguientes disoluciones:
- 5 g de ácido sulfanílico (ácido 4-aminobencenosulfónico) y 2 g de carbonato sódico en 100 ml de agua.
- 2 g de nitrito sódico en 15 ml de agua.
- 4 ml de HCl concentrado en 25 ml de agua.
- 3 ml de dimetilanilina, 15 ml de agua y 3 ml de HCl concentrado.
Se enfrían las disoluciones (con un baño de hielo externo) y solo cuando estén frías se procede de la siguiente manera:
Sobre la disolución de ácido sulfanílico y carbonato se vierte la disolución de nitrito sódico. La mezcla se mantiene en un baño de hielo y se adiciona lentamente, con agitación, la disolución de HCl. Una vez finalizada la adición se sigue manteniendo fría toda la mezcla y se le añade lentamente la disolución de dimetilanilina. Se observará que la reacción adquiere un color rojizo.
Una vez finalizado el proceso se añaden unos 40 ml de NaOH al 10 %, con lo que la mezcla de reacción pasa a tener color naranja, debido a la formación de la sal sódica del colorante. Se adiciona álcali hasta que la disolución se hace levemente alcalina (controlar el pH con papel indicador).
Se transvasa el crudo de reacción a un vaso de precipitados de 500 ml y a continuación se agregan 30 g de sal común y se calienta el contenido del vaso a 50-60 ºC. Una vez enfriado a temperatura ambiente se procede a filtrar a vacío el sólido pastoso que se obtiene. Se pasa una corriente de aire, en el Büchner, durante 10 min. Una vez seco (está recomendado utilizar para este producto un desecador a vacío), pesar el sólido y calcular el rendimiento (rendimiento estimado 70 %).
Tomar una pequeña porción con la punta de una espátula y preparar una disolución acuosa. Comprobar qué ocurre cuando se adicionan una disolución de ácidos y bases.
Propiedades físico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| HCl | 36.46 | -30 | >100 | 1.200 |
| Naranja de metilo | 337.33 | >300 | - | - |
| N,N-dimetilanilina | 121.18 | 1.8 | 192.5 | 0.958 |
| Na2CO3 | 105.99 | 851 | - | 2.532 |
| NaNO2 | 69.00 | 271 | 320 | 2.164 |
| NaOH | 40.00 | 318 | 1,390 | 2.130 |
| Ácido sulfanílico | 173.19 | >300 | - | - |
| isocianuro de tert-butilo | 83.13 | - | 91 |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| HCl |   |
| Naranja de metilo |  |
| N,N-dimetilanilina |   |
| Na2CO3 |  |
| NaNO2 |    |
| NaOH |  |
| Ácido sulfanílico |  |
| isocianuro de tert-butilo |   |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| HCl | VEXZGXHMUGYJMC-UHFFFAOYSA-N |
| Naranja de metilo | STZCRXQWRGQSJD-UHFFFAOYSA-M |
| N,N-dimetilanilina | JLTDJTHDQAWBAV-UHFFFAOYSA-N |
| Na2CO3 | CDBYLPFSWZWCQE-UHFFFAOYSA-L |
| NaNO2 | LPXPTNMVRIOKMN-UHFFFAOYSA-M |
| NaOH | HEMHJVSKTPXQMS-UHFFFAOYSA-M |
| Ácido sulfanílico | HVBSAKJJOYLTQU-UHFFFAOYSA-N |
| isocianuro de tert-butilo | FAGLEPBREOXSAC-UHFFFAOYSA-N |
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
- Vogel, A.I., Furniss, B.S., Hannaford, A.J., Tatchell, A.R., and Smith, P.W.G. (1989). Vogel’s Textbook of Practical Organic Chemistry (Vogel’s Textbook series). Longman. ISBN: 9780470214145
- Phenolphthalein and methyl orange
Charles A. Peters and Bryan C. Redmon
Journal of Chemical Education 1940 17 (11), 525
DOI: 10.1021/ed017p525
