Written by J.A. Dobado | Last Updated on 1 año
A continuación se describen las reacciones más significativas en Química Orgánica de los grupos funcionales alcoholes, éteres y oxiranos.
Índice
Deshidratación de alcoholes
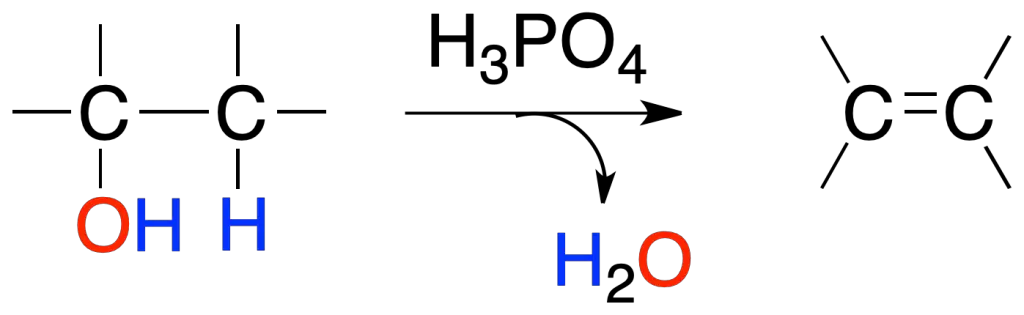
Los alcoholes en presencia de ácidos minerales como H2SO4 o H3PO4 dan alquenos por pérdida de una molécula de agua. El orden de reactividad del alcohol es:
terciario (3º) > secundario (2º) > primario (1º)
El proceso es regioselectivo en alcoholes secundarios y terciarios.
Las reacciones obedecen a la regla de Zaitsev que dice: «se forma mayoritariamente el alqueno más sustituido«.
La explicación radica en que éste es el alqueno más estable termodinámicamente.
Los alcoholes terciarios y secundarios reaccionan mediante un mecanismo E2, mientras que en los primarios es de tipo E1, debido a la inestabilidad del hipotético carbocatión primario que se daría.
En ocasiones se producen alquenos de la transposición de los carbocationes (como intermedios de reacción). En estas reacciones no se usan ácidos del tipo HX debido al carácter nucleófilo del anión, con lo cual se evitan reacciones de sustitución.
Conversión de alcoholes en éteres
Conversión de alcoholes en éteres en medio ácido
Los alcoholes primarios se transforman en éteres mediante catálisis ácida en caliente.
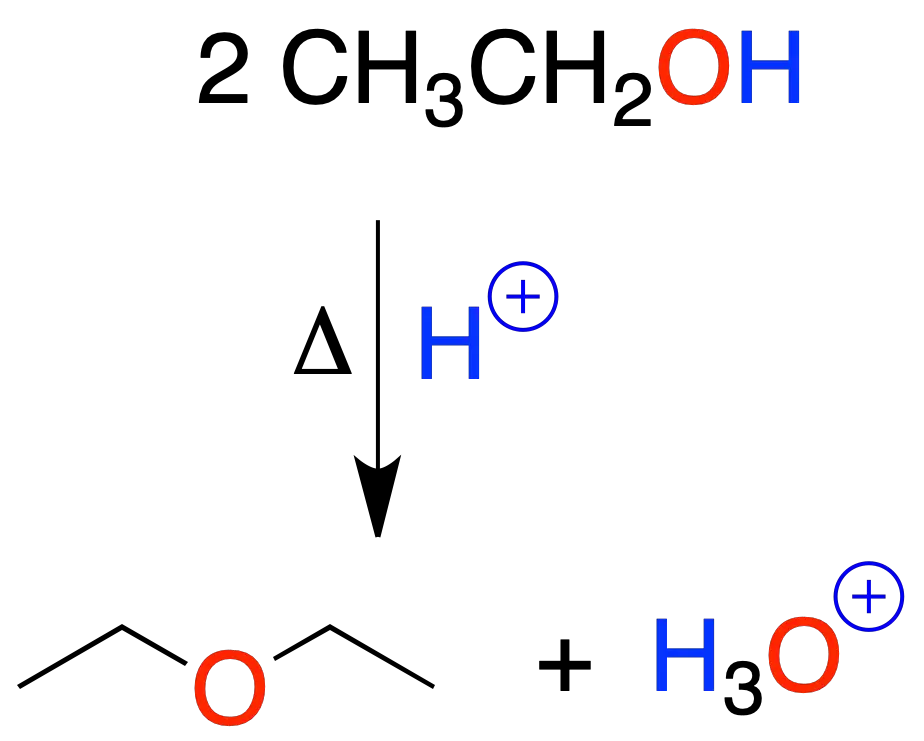
Generalmente, se emplea ácido sulfúrico. La reacción comienza por la protonación del hidroxilo del alcohol.
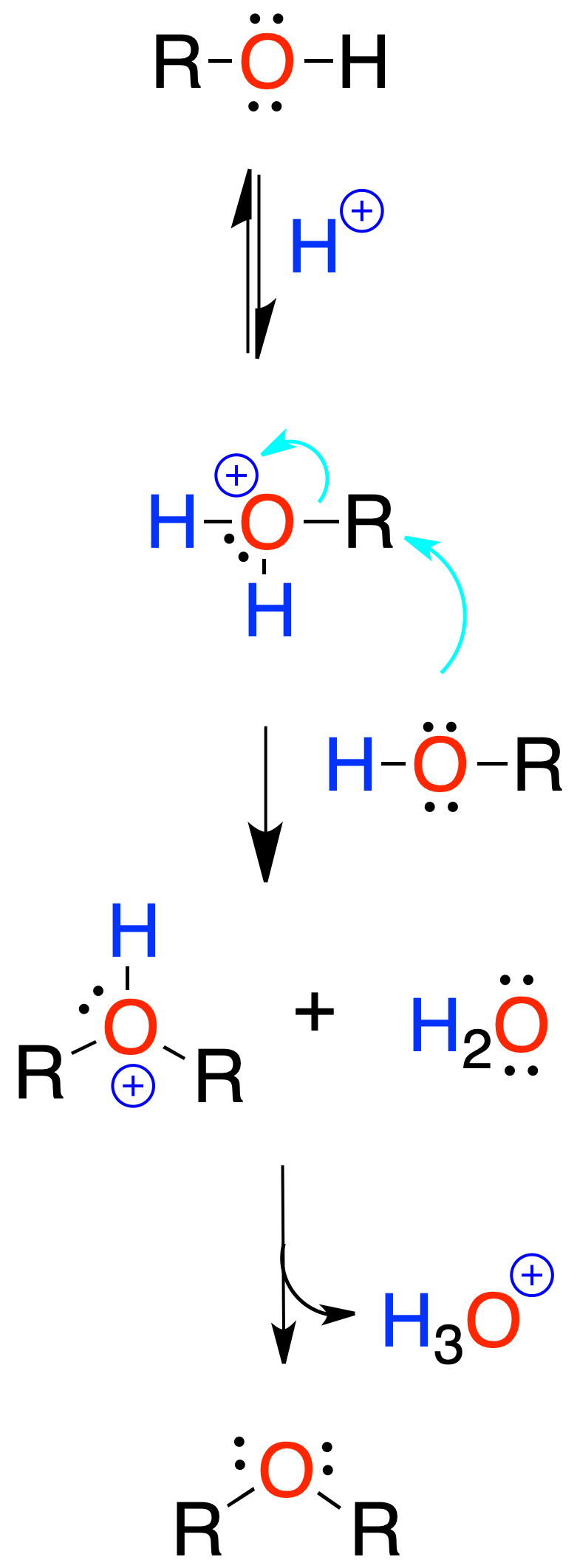
Está limitada a la preparación de éteres simétricos a partir de alcoholes primarios.
En estas condiciones los alcoholes secundarios y terciarios dan preferentemente alquenos.
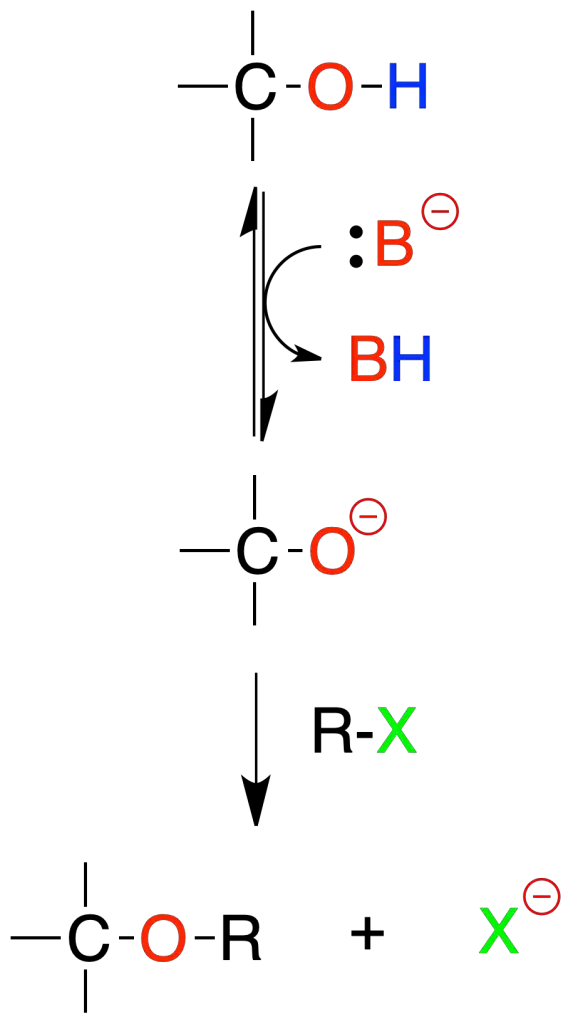
Conversión de alcoholes en éteres mediante alcóxidos (síntesis de Williamson)
El tratamiento de un alcohol con una base adecuada genera un alcóxido que por desplazamiento nucleofílico en un haluro de alquilo produce un éter. La base que se usa con el alcohol es Nao.
El alcohol puede ser primario, secundario o incluso terciario. Sin embargo, el haluro de alquilo debe ser de metilo o primario puesto que el mecanismo de esta reacción es de tipo SN2.
En haluros secundarios y terciarios predomina la reacción de eliminación para dar alquenos, por lo que el procedimiento no es aplicable.
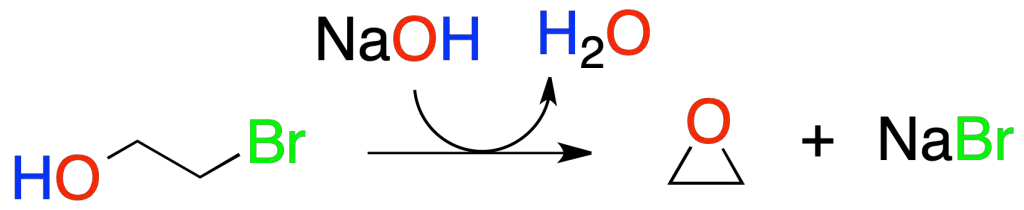
Si se realiza esta reacción de forma intramolecular, da lugar a éteres cíclicos, por ejemplo, una halohidrina forma el correspondiente epóxido.
Conversión de alcoholes en éteres de sililo
Los alcoholes reaccionan con cloruros de trialquilsililo para dar ésteres de sililo, en presencia de una amina terciaria como la trietilamina, piridina o imidazol que actúa como base y que neutraliza el HCl que se libera.
Estos compuestos son estables en condiciones muy diversas, como por ejemplo en presencia de oxidantes, reductores, o ácidos y bases en medios apróticos.
Se rompen con facilidad con ión fluoruro en forma de sal de tetralquil amonio. Los derivados de sililo (TMSO-, TESO-, TIPSO- o TBDMSO-), se emplean como grupo protector de hidroxilos en multitud de síntesis.
Conversión de alcoholes en ésteres
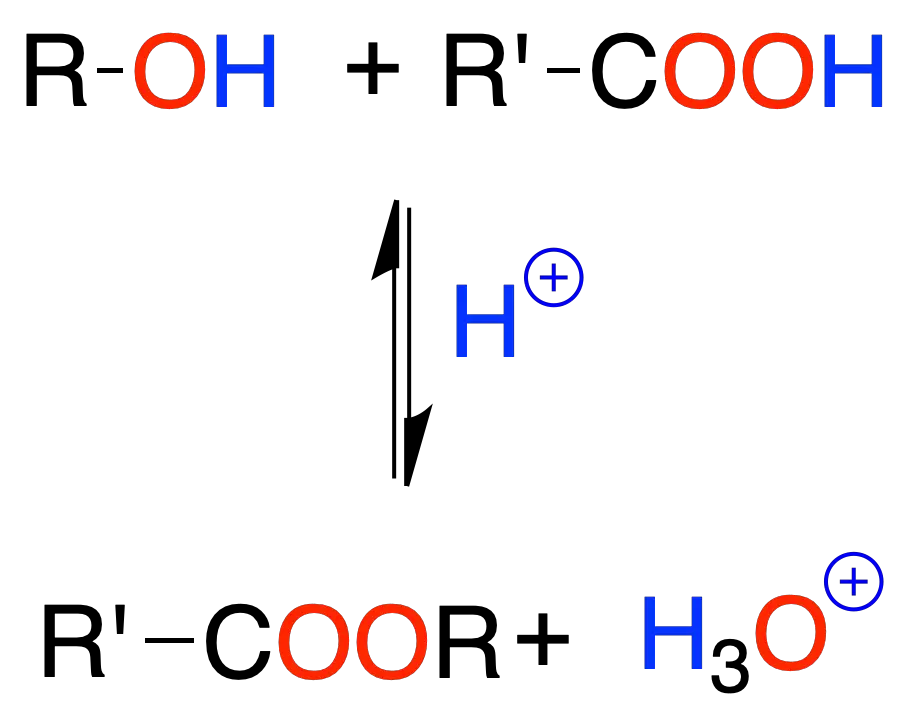
Ésteres de ácidos carboxílicos (esterificación de Fischer)
Los alcoholes con los ácidos carboxílicos reaccionan para dar ésteres, en presencia de un ácido mineral.
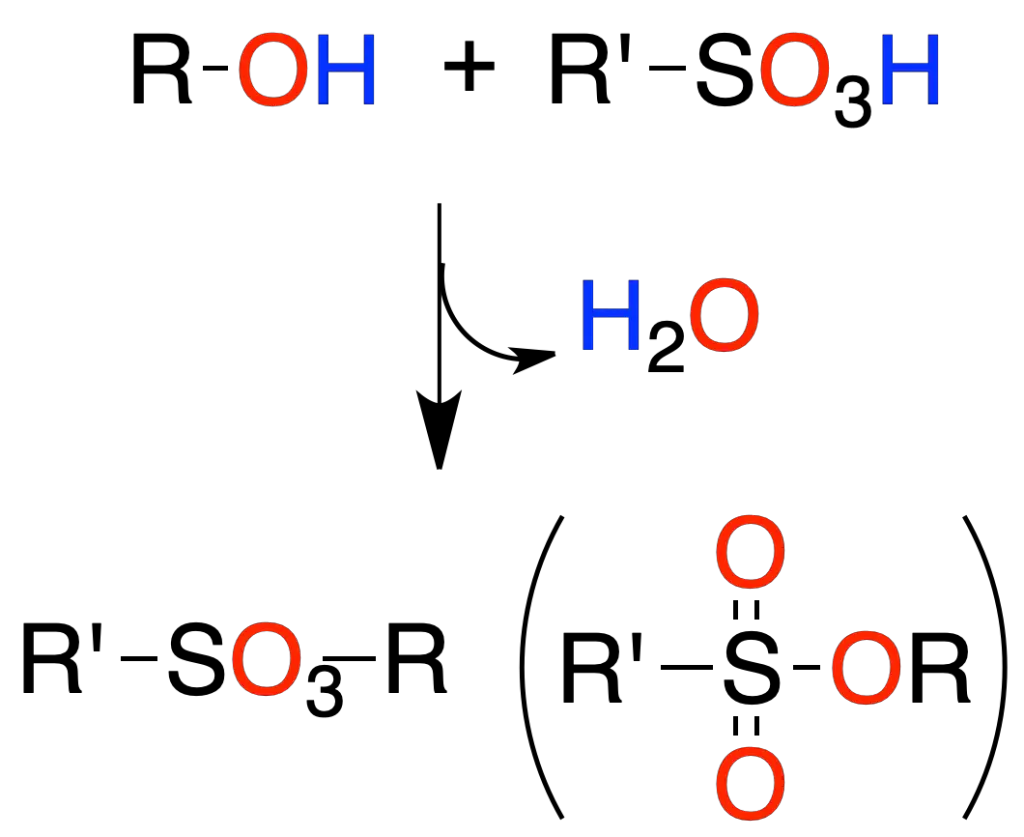
Ésteres de ácidos sulfónicos
La reacción de un alcohol con ácidos sulfónicos lleva a la formación de un éster sulfónico.
Conversión de alcoholes en haloalcanos
Reacciones de los alcoholes con HX
Los alcoholes reaccionan con HX para dar haluros de alquilo.
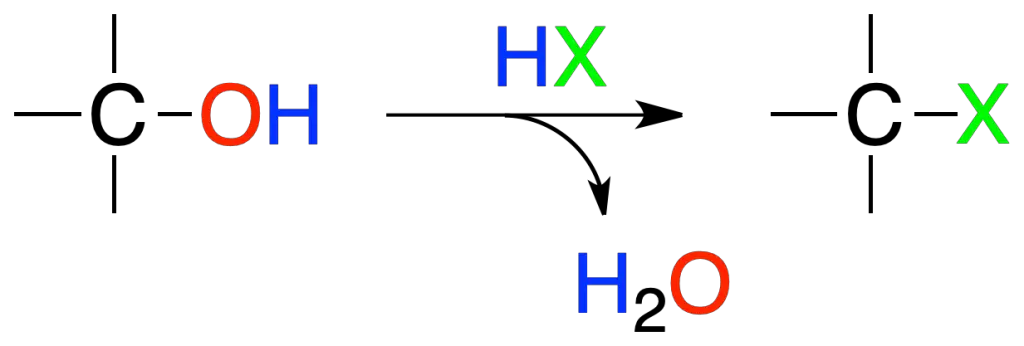
El orden de reactividad para el haluro de hidrógeno es HI > HBr > HCl > HF, mientras que para los alcoholes es:
terciario (3º) > secundario (2º) > primario (1º) > metilo
La reacción transcurre generalmente por un mecanismo de tipo SN1, por lo que en algún caso se pueden producir transposiciones en los carbocationes intermedios.
Para los alcoholes primarios o metanol el mecanismo de la reacción es de tipo SN2.
Los alcoholes primarios y secundarios no reaccionan con HCl a la velocidad necesaria para dar buenos rendimientos. Los alcoholes secundarios (2º) que no reaccionan con HCl, sí lo hacen cuando se utiliza una solución de ZnCl2 en HCl concentrado (reactivo de Lucas).
Con HBr, en alcoholes secundarios se obtienen rendimientos aceptables o buenos si se eleva la temperatura. El mejor resultado se obtiene con alcoholes terciarios.
Reacciones de los alcoholes con cloruro de tionilo (SOCl2)
Los alcoholes reaccionan con cloruro de tionilo (SOCl2) para dar cloruros de alquilo y como subproductos, dióxido de azufre (SO2) y cloruro de hidrógeno HCl.
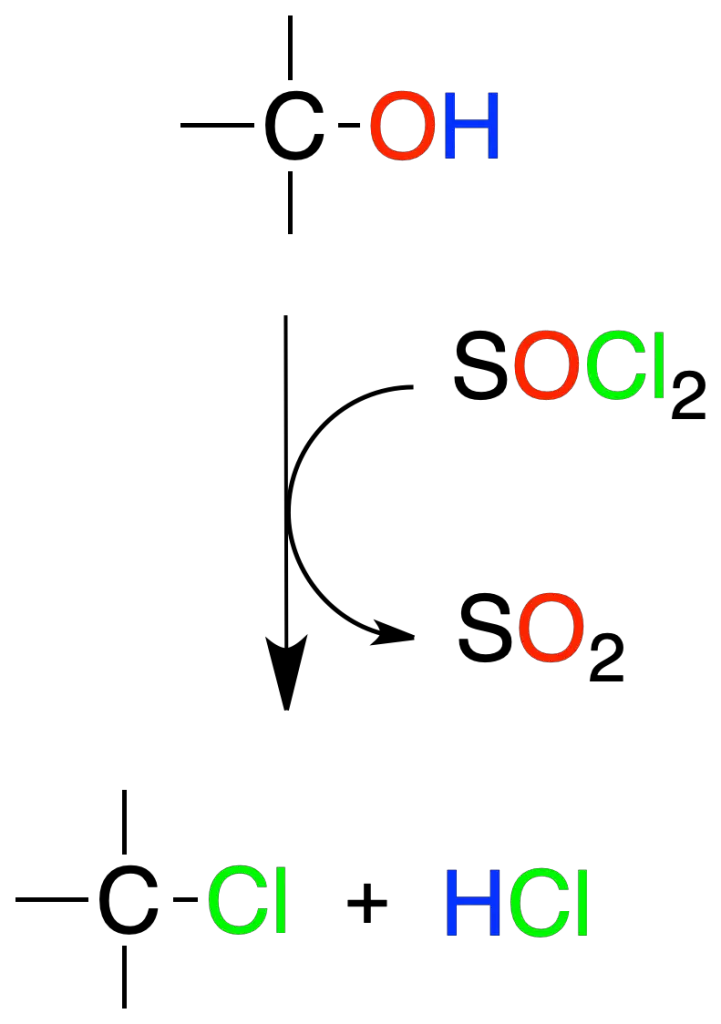
Esta reacción se aplica, fundamentalmente, en alcoholes primarios y secundarios, y transcurre mediante un intermedio clorosulfito (R-O-SO–Cl).
Según se utilice o no una base como la piridina, la reacción transcurre con inversión o con retención de la configuración.
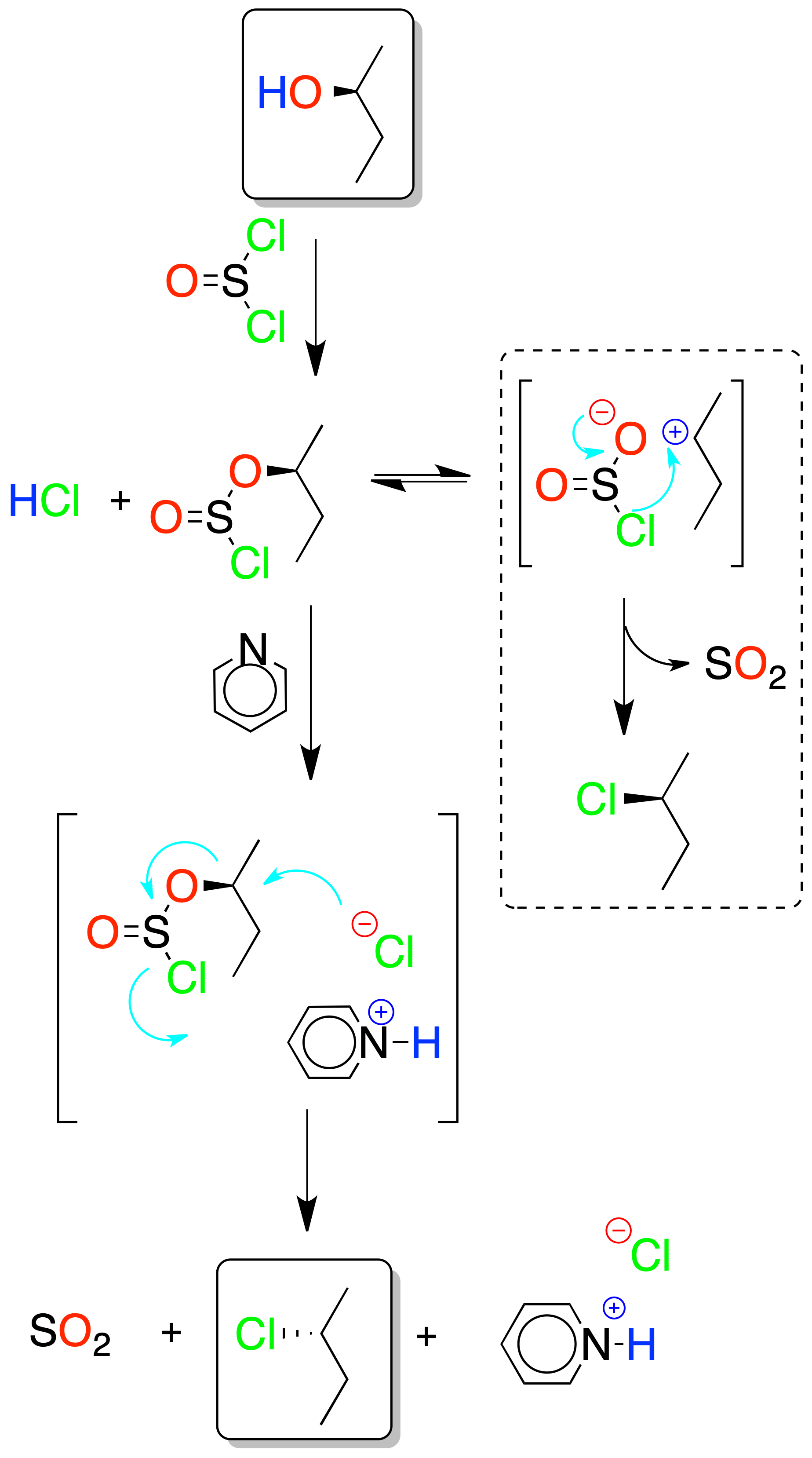
Con base se dispone de una concentración de Cl⊕ (en forma de cloruro de piridinio) suficiente para que se produzca el desplazamiento del clorosulfito mediante un mecanismo SN2. Si no hay base, la reacción transcurre con retención de la configuración mediante un proceso intramolecular (sin).
Reacción de alcoholes con tricloruro o tribromuro de fósforo
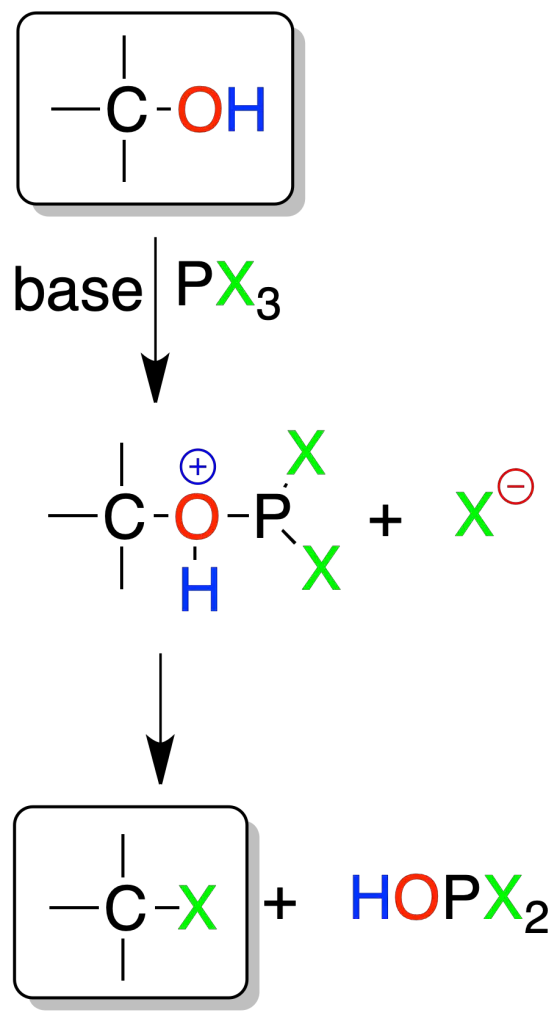
Los alcoholes se transforman en haluros de alquilo con tricloruro o tribromuro de fósforo. La reacción se da preferentemente en alcoholes primarios y el mecanismo es SN2. En alcoholes secundarios compite el SN1 y se obtienen productos de transposición del esqueleto. Un mol de PX3 reacciona con tres de alcohol.
Reacción de alcoholes con CX4/PPh3 (reacción de Appel)
Los alcoholes reaccionan con tetrahalometanos (X = Cl o Br) y trifenilfosfina para dar, con buenos rendimientos, el correspondiente haluro de alquilo con inversión de la configuración. Las condiciones de reacción son suaves y compatibles con multitud de funciones.
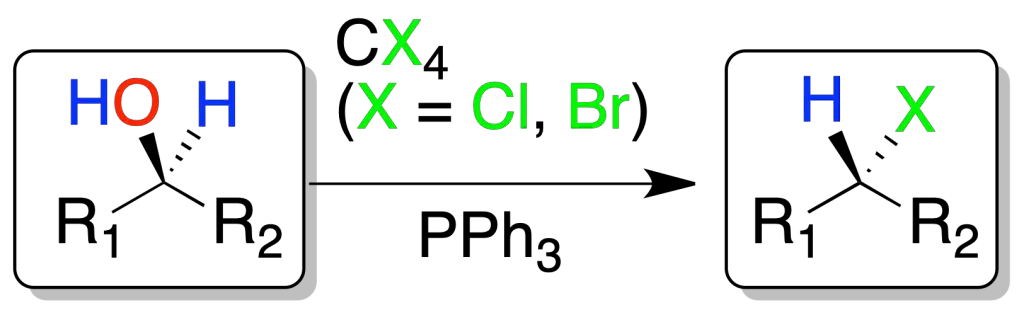
| Sustrato | Estereoquímica / mecanismo | Reactivo / condiciones de reacción |
| Alcohol 2º y sobre todo 3º | Racemización / SN1 | XH |
| Alcohol 1º | Inversión de la configuración / SN2 | PX3 / en presencia de base |
| Alcohol 1º y 2º | SOCl2 / en presencia de base | |
| CX4 / PPh3 | ||
| Retención de la configuración / SNi | SOCl2 / en ausencia de base |
Desoxigenación de alcoholes (reducción)
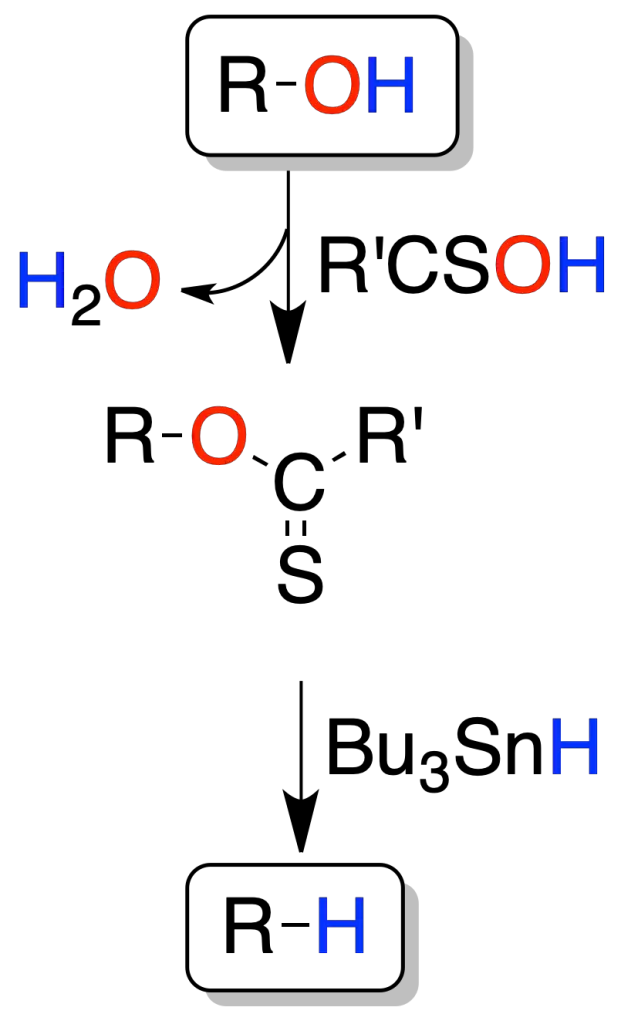
Mediante derivados de tiocarbonilo (reacción de Barton-McCombie)
Normalmente, los alcoholes no pueden transformarse de forma directa en los correspondientes compuestos saturados. Generalmente, es necesario llevar a cabo la transformación en dos pasos.
En primera instancia se obtiene un derivado del alcohol, y sobre este derivado se produce la transformación en el compuesto saturado.
En este método de desoxigenación un alcohol se transforma en derivado de tiocarbonilo, que posteriormente reacciona con hidruro de tri-butilestaño (Bu3SnH) mediante un proceso radicalario.
Mediante sulfonatos
El alcohol se transforma primero en un sulfonato (tosilato o mesilato) que, por tratamiento con LiAlH4 se transforma en el compuesto saturado.
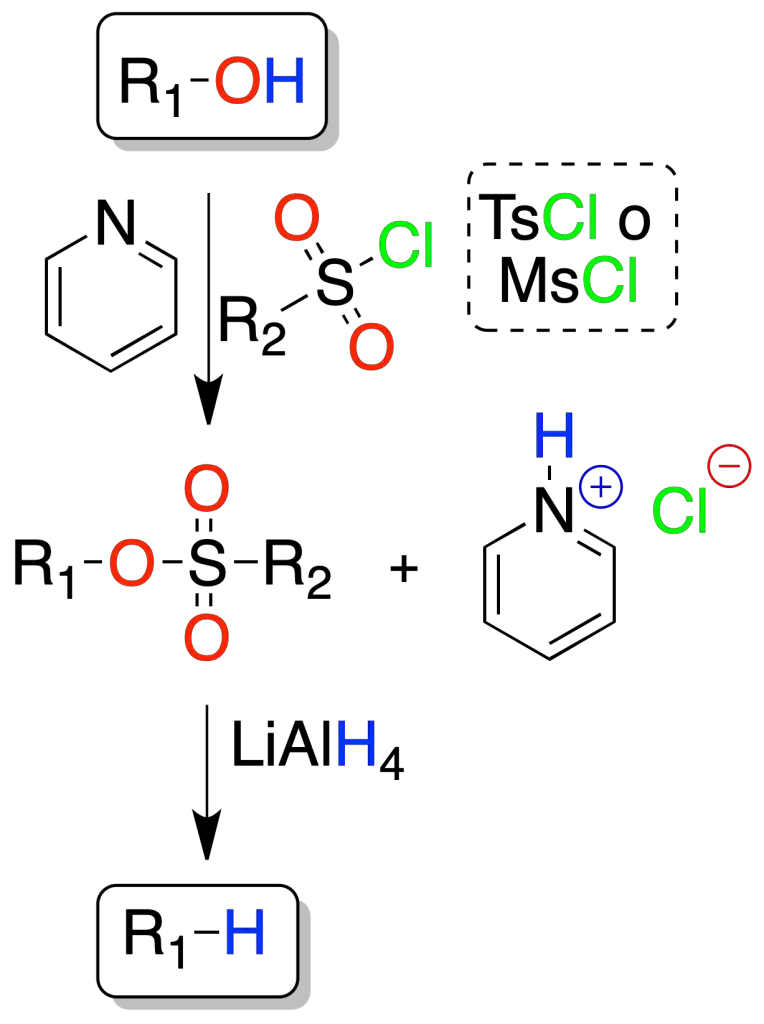
La reacción transcurre con buenos rendimientos a partir de alcoholes primarios (1º) y secundarios (2º).
Oxidación de alcoholes
Los alcoholes se pueden oxidar mediante las reacciones indicadas en el esquema general. Para que se produzca la oxidación es necesario que, al menos, haya un átomo de hidrógeno sobre el carbono que se va a oxidar (alcohol primario 1º o secundario 2º), para que se pueda formar un doble enlace C=O. Por tanto, los alcoholes terciarios no reaccionan.
| Alcohol 2º → cetonas y Alcohol 1º → aldehídos | |
| Oxidante [O] | Disolvente |
| PCC | CH2Cl2 |
Reactivo de Collins (CrO3 2 piridina) | |
Reactivo de Swern ((ClCO)2 / DMSO) | CH2Cl2 o éteres |
| Alcohol 2º → cetonas y Alcohol 1º → ác. carboxílicos | |
Reactivo de Jones(H2CrO4) | acetona / H2SO4 |
| KMnO4 en medio básico | H2O con mezcla de disolventes |
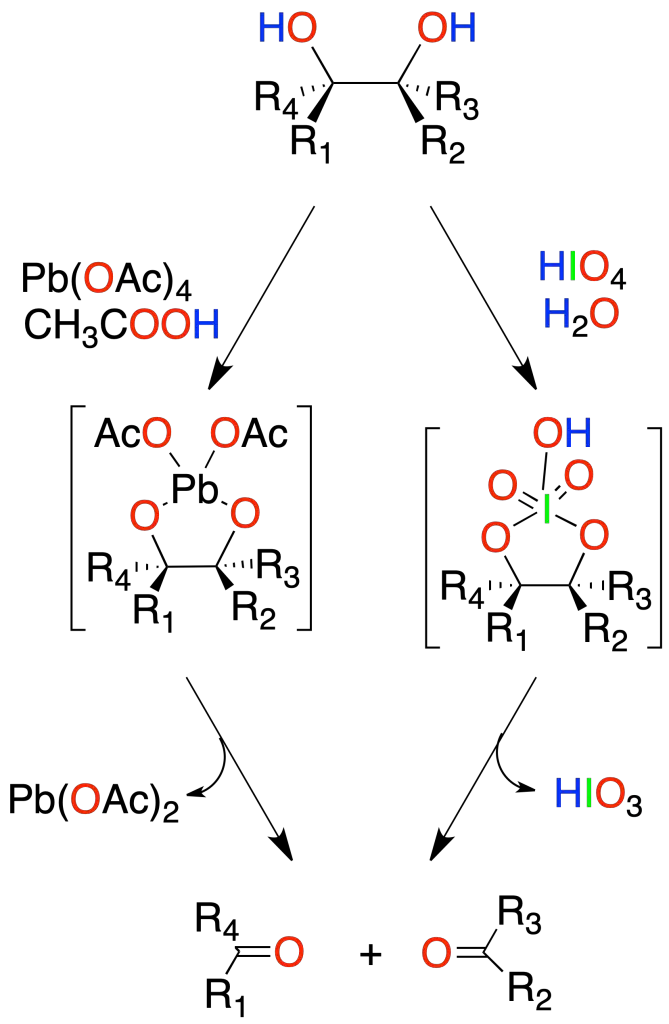
Oxidación de 1,2-dioles
Los dioles vecinales se pueden someter a un proceso de rotura oxidativa con ácido peryódico (HIO4) o con tetra-acetato de plomo para dar dos compuestos carbonílicos.
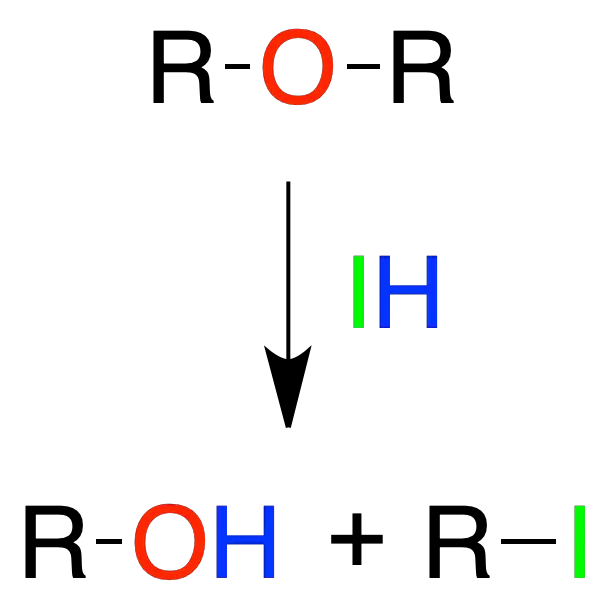
Rotura de éteres
La rotura de éteres con ácidos del tipo HX se da a temperatura ambiente cuando X = I. Para el Br es necesario aumentar la temperatura hasta los 100 ºC aproximadamente, mientras que en el caso del Cl se requieren temperaturas incluso mayores.
Apertura de oxiranos
Catalizada por ácidos
Cuando un oxirano (epóxido, oxaciclopropano) se trata con un ácido mineral se produce la protonación del átomo de oxígeno, que facilita la apertura del anillo por ataque de un nucleófilo.
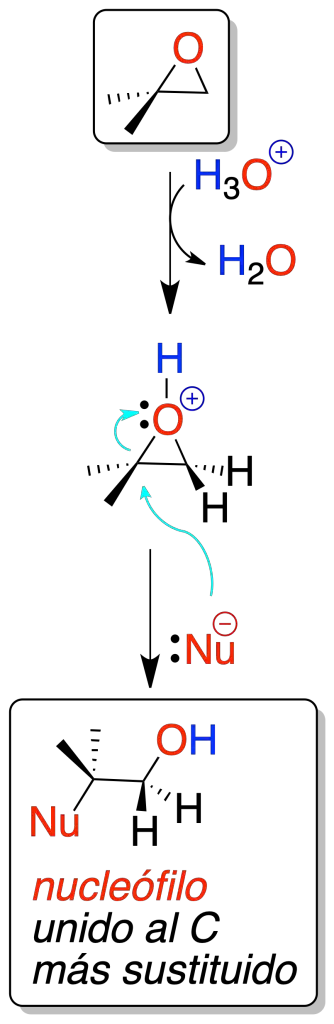
En todos los casos, el ataque del nucleófilo es regioselectivo, ya que se produce sobre el carbono más sustituido. El mecanismo de la reacción es del tipo de los procesos SN1.
Las reacciones principales son las tres que se indican en el esquema:
- Apertura en medio acuoso para obtener 1,2-glicoles.
- Apertura en presencia de alcoholes para obtener hidroxiéteres.
- Apertura con haluros de hidrógeno para obtener halohidrinas.
Nucleofílica
Los nucleófilos pueden abrir los oxiranos por ataque sobre el carbono menos sustituido (reacción regioselectiva).
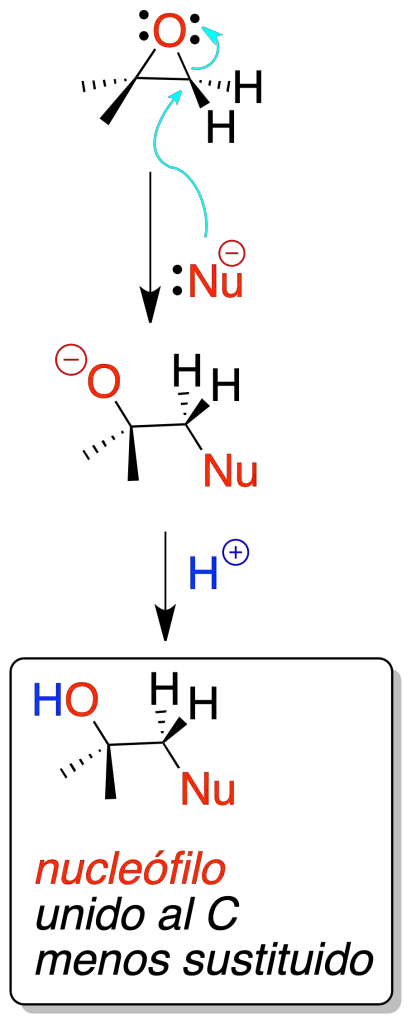
En el caso de dos epóxidos diasterómeros, cuando se tratan con un mismo nucleófilo en las mismas condiciones de reacción se obtienen, a su vez, dos diasterómeros (reacción diastereospecífica). Es un procedimiento muy versátil porque pueden usarse una gran variedad de nucleófilos distintos.
Volver a la página de Síntesis y Reactividad de Compuestos Orgánicos.
