Written by J.A. Dobado | Last Updated on 5 meses
Conversión de alquenos en alcanos
Hidrogenación catalítica
La adición de un mol de H2 a un doble enlace conduce a la formación de un compuesto saturado (alcano). Las condiciones (temperatura, presión, etc) de la hidrogenación son relativamente suaves, siendo imprescindible la presencia de un catalizador, ya que la mezcla del hidrógeno y el alqueno no reacciona espontáneamente debido a la elevada energía de activación del proceso.
Índice
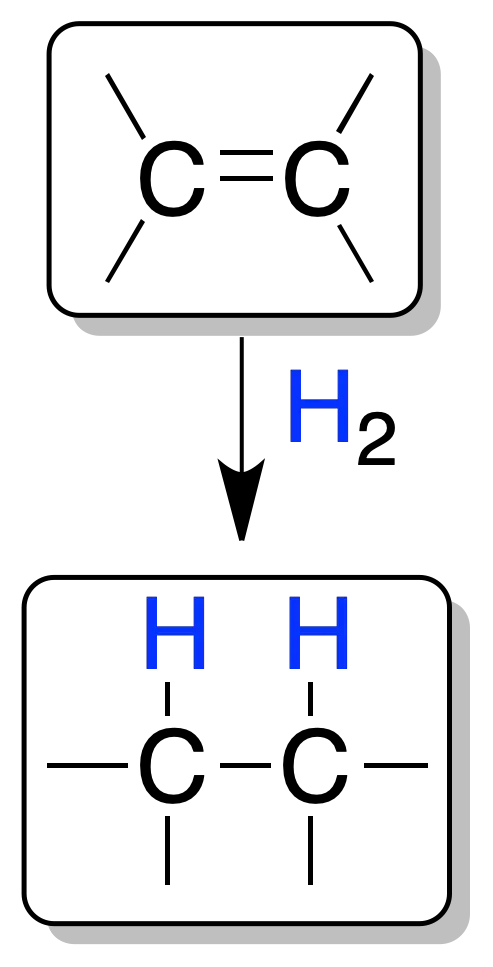
Los catalizadores más empleados son metales de transición (Pd, Pt, Ni, etc) sobre un soporte inerte como carbón o sales iónicas. Los disolventes más usados para esta reacción son etanol, hexano o ácido acético.
En estas condiciones los catalizadores son totalmente insolubles en el medio de reacción, por lo que se trata de un fenómeno de catálisis heterogénea.
También, se pueden emplear catalizadores solubles en disolventes orgánicos (catálisis homogénea). Suelen ser complejos metálicos formados por un metal de transición (Rh, Ru o Ir) con ligandos orgánicos, como por ejemplo, Ph3P.
La transformación es estereoselectiva ( y puede ser estereoespecífica): los dos átomos de hidrógeno que se incorporan a la molécula lo hacen por la misma cara del doble enlace (adición-sin).
Reducción hasta alcanos con borano
La reacción del borano con un alqueno es un proceso concertado y estereoespecífico.
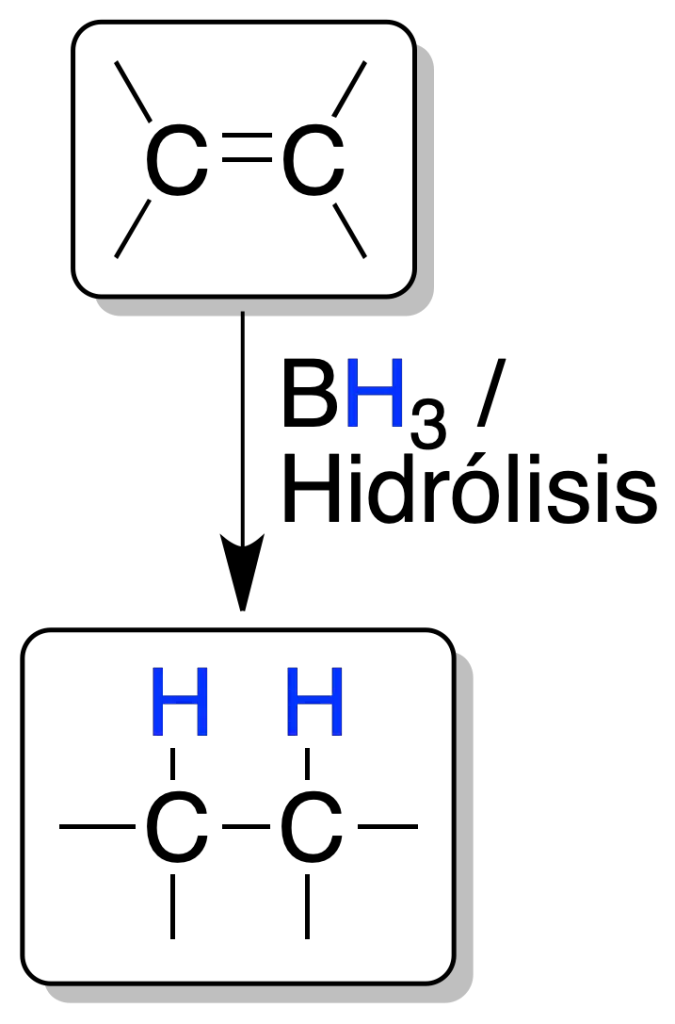
El boro se enlaza al carbono menos sustituido (véase la reacción de hidroboración-oxidación). La hidrólisis con una disolución acuosa de ácido del alquilborano intermedio, produce un alcano.
Una alternativa al borano es el uso de 9-BBN.
Adiciones electrofílicas de alquenos
Los alquenos al poseer los electrones π del doble enlace son capaces de reaccionar con compuestos con deficiencia electrónica (electrófilos), dependiendo de la naturaleza de dichos compuestos se obtendrán productos diferentes.
En la Tabla 1, se muestra un resumen de dicha reactividad.
| Reactivo Electrófilo | Tipo de ataque (Estereo-selectividad) | |
| H2O / H3O⊕ | H-OH | Markovnikov (-) |
| BH3 / oxidación | H2B–H | Anti-Markovnikov (Adición-sin) |
| Acetato de mercurio | Hg(OAc)2 | Markovnikov (Adición-anti) |
| Cloruro de sulfenilo | RS-Cl | Markovnikov (Adición-anti) |
| X-H (sin iniciadores de radicales) | X-H | Markovnikov (-) |
| X2 | X-X | – (Adición-anti) |
| X2 / H2O (XOH) | XOH | Markovnikov (Adición-anti) |
Hidratación catalizada por ácidos
Un alqueno tratado con una disolución acuosa de un ácido con un anión poco nucleófilo (SO42-, PO43-) adiciona una molécula de agua.
Se produce una protonación inicial que genera un carbocatión, sobre el que ataca, posteriormente, una molécula de agua.
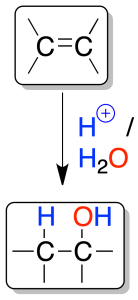
Debido a la formación de carbocationes, a veces se observan transposiciones del esqueleto carbonado.
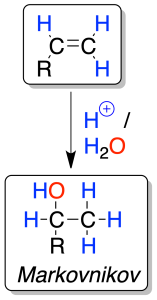
La reacción es regioselectiva ya que el protón H⊕ (electrófilo) se une al carbono menos sustituido y el grupo HO⊖ al más sustituido.
A este tipo de ataque (en el que el electrófilo se une al carbono menos sustituido y el nucleófilo al más sustituido) se le conoce como regla de Markovnikov.
Esta reacción revierte a los reactivos de partida mediante la deshidratación de alcoholes.
La deshidratación de alcoholes se favorece con ácidos concentrados y en caliente, mientras que la hidratación de alquenos se favorece con un exceso de agua y temperaturas bajas.
El ácido sulfúrico (H2SO4) concentrado se puede adicionar a algunos alquenos generando un alquilhidrogenosulfato.
La reacción es una adición electrófila de tipo Markovnikov.
Cuando se calienta en agua, el alquinilhidrogenosulfato se hidroliza fácilmente, dando un alcohol (sólo en alquenos monosustituidos).
En alquenos polisustituidos se producen polímeros.
Oximercuriación-desmercuriación
Los alquenos reaccionan con acetato de mercurio (II) (H2O / THF) para dar un intermedio (mercurial), que por reducción con NaBH4 en medio básico, genera un alcohol.
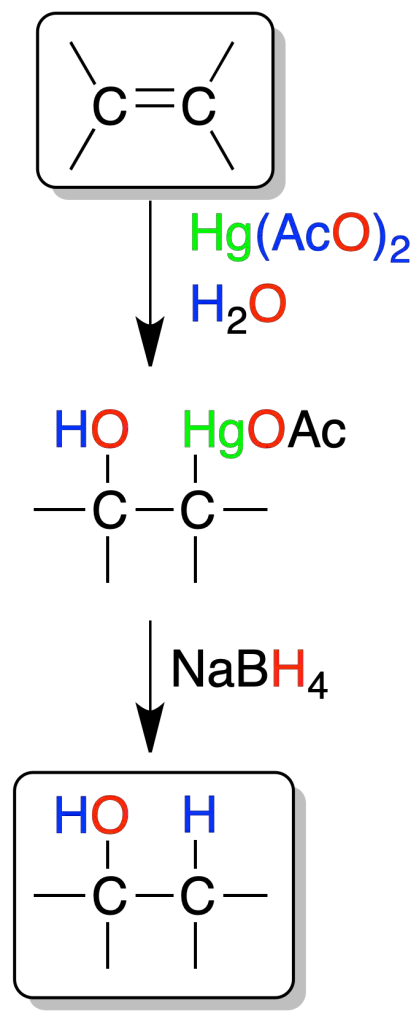
La regioselectividad es la misma que la de la hidratación anterior catalizada por ácidos, pero posee la ventaja de que no se producen transposiciones en ella. Sólo se obtiene un producto de regioselectividad inversa a la de la reacción de hidroboración-oxidación.
El mercurio se enlaza al carbono menos sustituido, y un –OH al más sustituido (regla de Markovnikov). Además, es estereoespecífica, porque la adición del mercurio y el hidroxilo es una adición-anti.
El mecanismo de reacción se explica por el ataque al doble enlace del ión mercurinio ⊕HgOAc (disociación del acetato de mercurio). Se forma un complejo cíclico que posteriormente se abre del agua, y finalizando con la pérdida de un protón. En la útima etapa de reducción con NaBH4, el mercurio se reemplaza por hidrógeno.
Hidroboración / oxidación
Permite adicionar una molécula de agua a un alqueno con regioselectividad opuesta al proceso de hidratación de alquenos vista en el apartado anterior.
El proceso es un tándem de dos reacciones. Primero se forma un trialquilborano, que no se aísla, y posteriormente, se oxida con peróxido de hidrógeno.
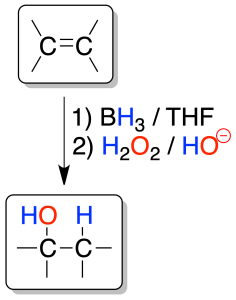
Cada molécula de borano BH3 puede reaccionar con tres moléculas de alqueno. La reacción es regioselectiva, ya que el boro se enlaza al carbono menos sustituido (el grupo -OH se genera a partir del alquilborano por oxidación de éste) y el hidrógeno al carbono más sustituido (anti-Markovnikov).
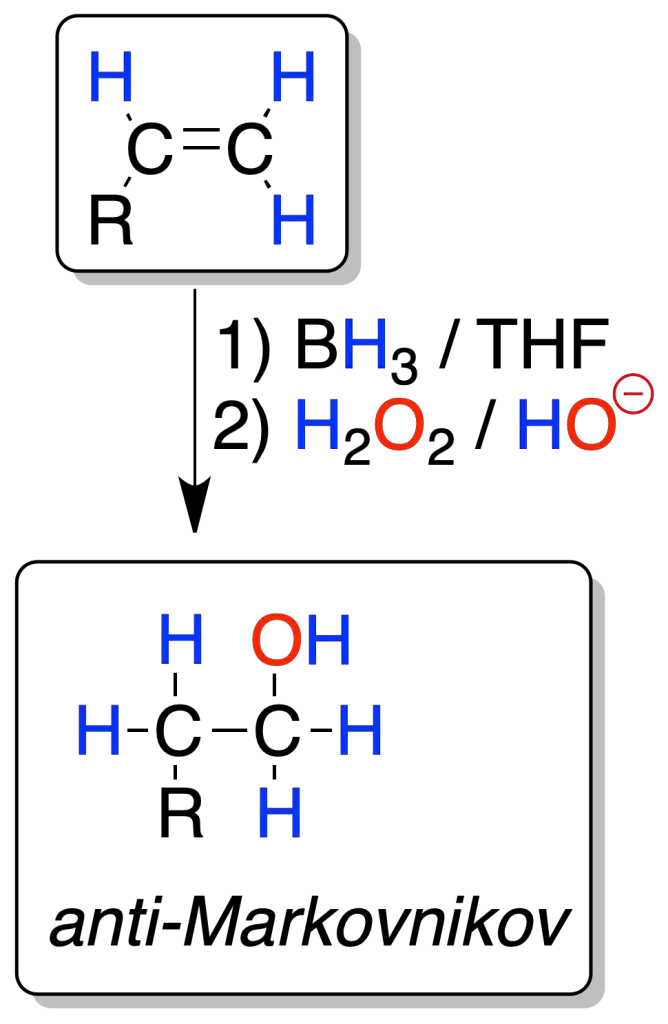
La reacción es también estereoespecífica, ya que la adición del boro y del átomo de hidrógeno se producen por la misma cara del alqueno (adición-sin).
Adición de HX electrófila (en ausencia de iniciadores de radicales)
La reacción de un alqueno con un haluro de hidrógeno en ausencia de iniciadores de radicales produce un haluro de alquilo.
El protón H⊕ se enlaza sobre el carbono menos sustituido y genera el carbocatión más estable, que es atacado por el halógeno que se encuentra como X⊖.
El proceso sigue la regla de Markovnikov, ya que los carbocationes terciarios 3º y secundarios 2º son más estables que los primarios, pudiéndose dar transposiciones.
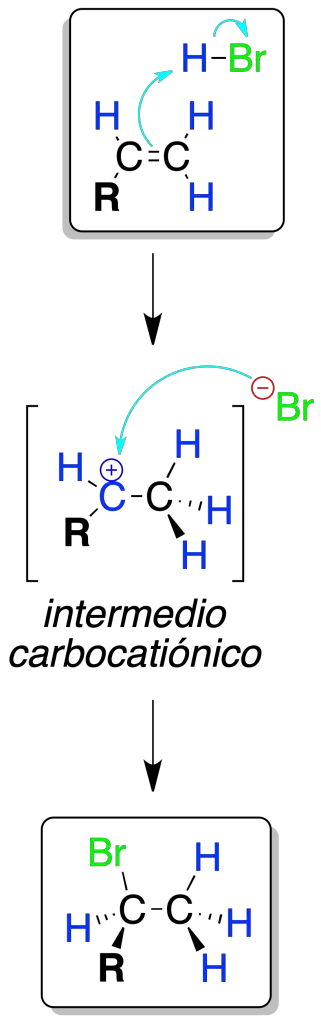
Si hay otros nucleófilos en el medio, distintos a X⊖, se producen mezclas de productos como consecuencia del ataque de dichos nucleófilos sobre el intermedio carbocatiónico.
La reactividad del haluro de hidrógeno frente a alquenos sigue el orden HI > HBr > HCl >> HF.
Por otra parte, se mejora el rendimiento en ausencia de luz.
Adición de halógenos
El cloro y el bromo se adicionan con buenos rendimientos a alquenos dando un compuesto dihalogenado vecinal.

La velocidad de la reacción aumenta con la polaridad del disolvente, debido al carácter polar del intermedio de reacción.
Los disolventes usados son apróticos como Cl2CH2, Cl4C, o Cl3CH o bien, próticos de baja nucleofilia (ácido acético).
El intermedio de la reacción es un ión halonio cíclico (cloronio, Cl⊕, o bromonio, Br⊕).
La adición se produce por caras diferentes del doble enlace (adición-anti), es por tanto, estereoespecífica. Según los sustituyentes y/o la estereoquímica del alqueno de partida se pueden generar mezclas de estereoisómeros.
La adición de halógenos a dobles enlaces seguida de una doble eliminación de dihaluros vecinales conduce a la formación de alquinos.
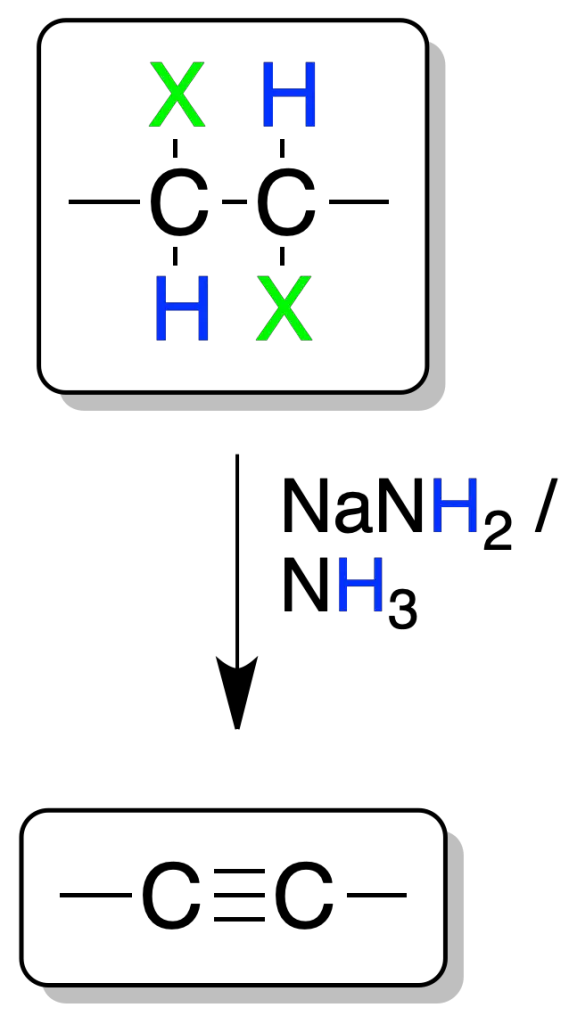
Para que se produzca la reacción de eliminación, es necesario el uso de una base fuerte como NaNH2 en NH3. La reacción se da sólo en alquenos mono- o di-sustituidos.
Formación de halohidrinas
En disolución acuosa, el cloro (Cl2) y el bromo (Br2) reaccionan con alquenos para dar halohidrinas (α-haloalcohol).
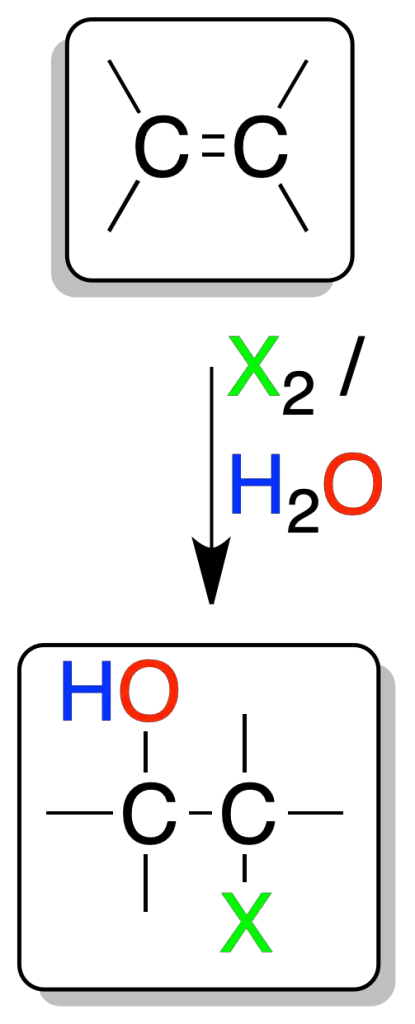
Estos compuestos son intermedios sintéticos útiles para la preparación de epóxidos.
Se forma un ión halonio intermedio, que es atacado por el agua por la cara opuesta al bromo (adición-anti).
Además, el ataque del agua es regioselectivo: se produce sobre el carbono más sustituido (con mayor densidad de carga positiva), es por tanto, una adición tipo Markovnikov.
Adición electrófila de cloruro de sulfenilo
La reacción de cloruro de sulfenilo (RSCl) sobre olefinas produce cloroalquilsulfuros. La reacción es regioselectiva.
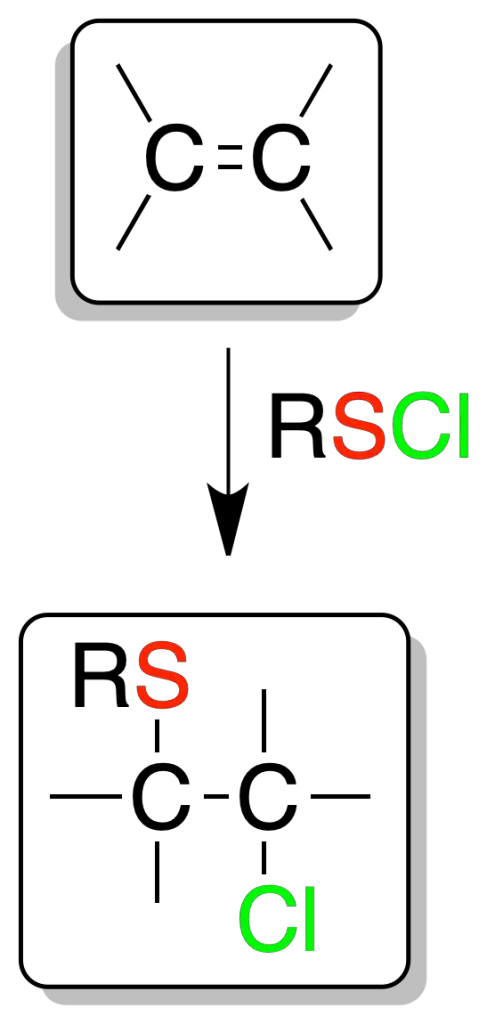
El azufre se fija sobre el carbono menos sustituido (Markovnikov) y además es una adición-anti.
Por otro lado, los cloroalquilsulfuros son intermedios sintéticos para la obtención de epóxidos.
Otras adiciones de alquenos
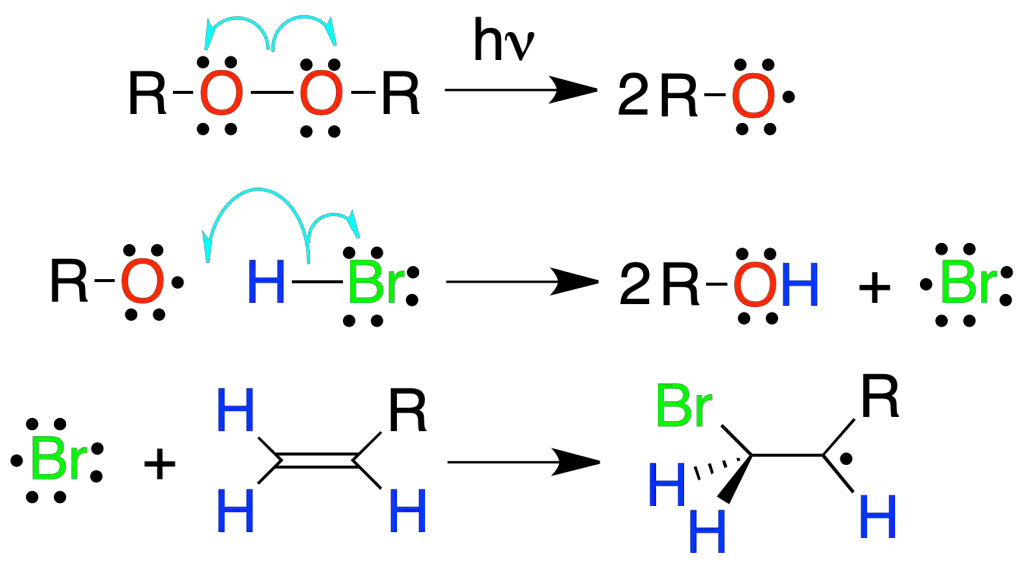
Adición de HBr radicalaria
La adición de HBr a alquenos en presencia de un iniciador como peróxidos, luz o calentando, conduce a un bromuro de alquilo con una regioselectividad inversa (anti-Markovnikov) a la de la reacción de adición de HBr electrofílica, debido a que se produce el radical más sustituido (más estable).
Adición de carbenos
Los carbenos se adicionan a dobles enlaces generando ciclopropanos. La adición de un carbeno a un doble enlace es estereoespecífica, produciéndose por una cara del doble enlace. Además, los carbenos son intermedios sintéticos divalentes altamente reactivos (RR’C:).
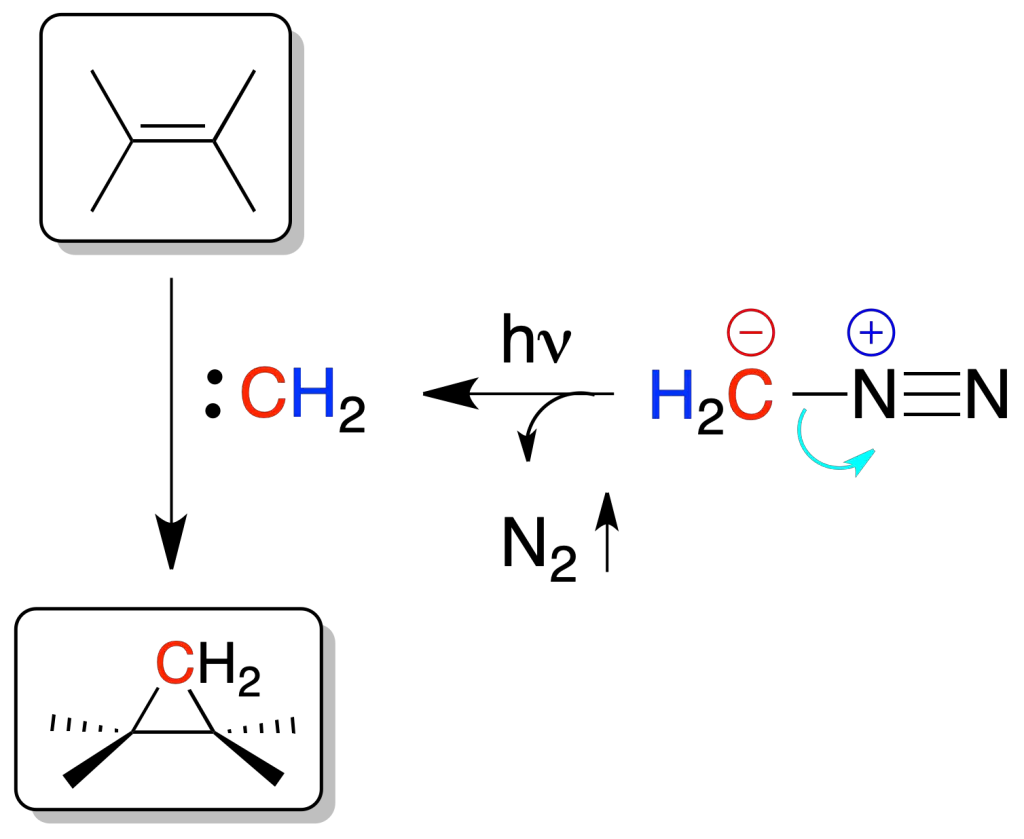
Se pueden generar a partir de un derivado de diazoalcano con luz o calor, a partir de cloroformo en medio fuertemente básico, o bien mediante la reacción de Simmons-Smith.
Oxidación de alquenos
La oxidación de los alquenos produce distintos compuestos en función del oxidante y las condiciones de reacción usadas.
Epoxidación
El tratamiento de una olefina con un perácido permite la síntesis de un epóxido u oxirano.
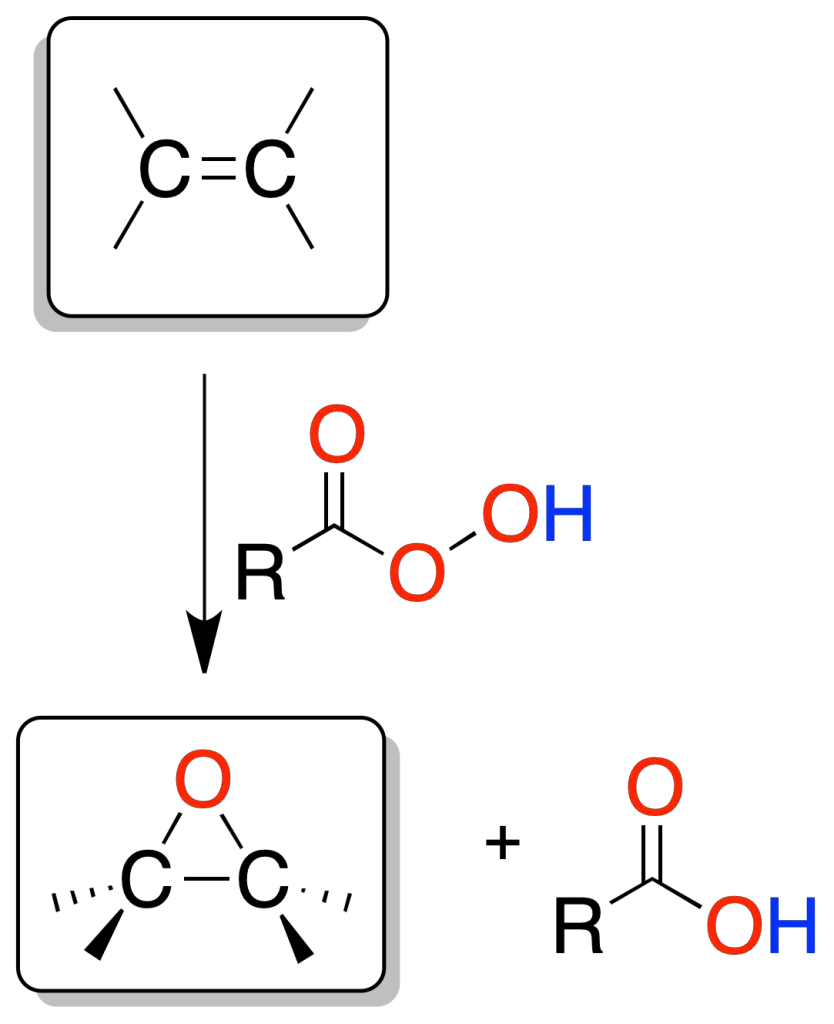
La reacción es un proceso concertado que da lugar a una adición de tipo sin. El perácido más empleado es el peroxiacético (Los perácidos más empleados son el peroxiacético y el ácido m-cloroperbenzoico) y el disolvente, el ácido acético.
Otros disolventes pueden ser Cl2CH2 o CHCl3. La estereoquímica relativa de los sustituyentes de los dobles enlaces (Z o E) se mantiene en el epóxido.
Oxidación de alquenos a dioles vecinales (glicoles)
Los dioles vecinales (glicoles) se pueden obtener a partir de alquenos por oxidación con permanganato MnO4⊖ en medio acuoso (pH > 8, condiciones básicas) a baja temperatura, o bien con OsO4 en disolución acuosa de bisulfito sódico. En ambos casos, se postula un intermedio cíclico de cinco miembros (osmato cíclico).
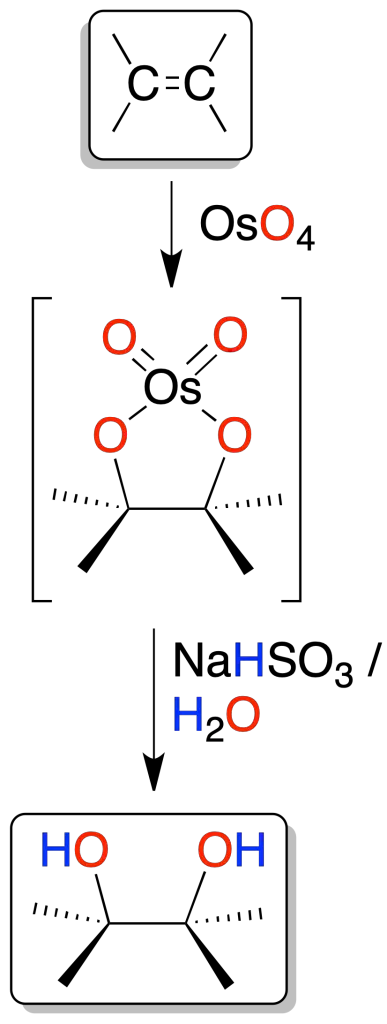
El óxido de osmio OsO4 se puede emplear en cantidades catalíticas en presencia de un oxidante, terc-butilhidroperóxido o peróxido de hidrógeno (H2O2), por lo que conforme se va consumiendo se regenera in situ.
Ozonólisis
La ozonólisis (reacción de alqueno con ozono) sobre alquenos también produce una rotura oxidativa del doble enlace, pero a diferencia del caso anterior, se obtienen aldehídos o formaldehído. Si el producto de la oxidación deseado es el aldehído en lugar del ácido carboxílico, elegiremos la ozonólisis.
El intermedio de la reacción se denomina ozónido, y su hidrólisis produce mezclas de compuestos carbonílicos: aldehídos y cetonas. El tratamiento con un reductor (Znº en ácido acético o sulfuro de dimetilo), permite aislar los productos de reacción.
El ozónido intermedio es explosivo, por lo que se debe trabajar a bajas temperaturas.
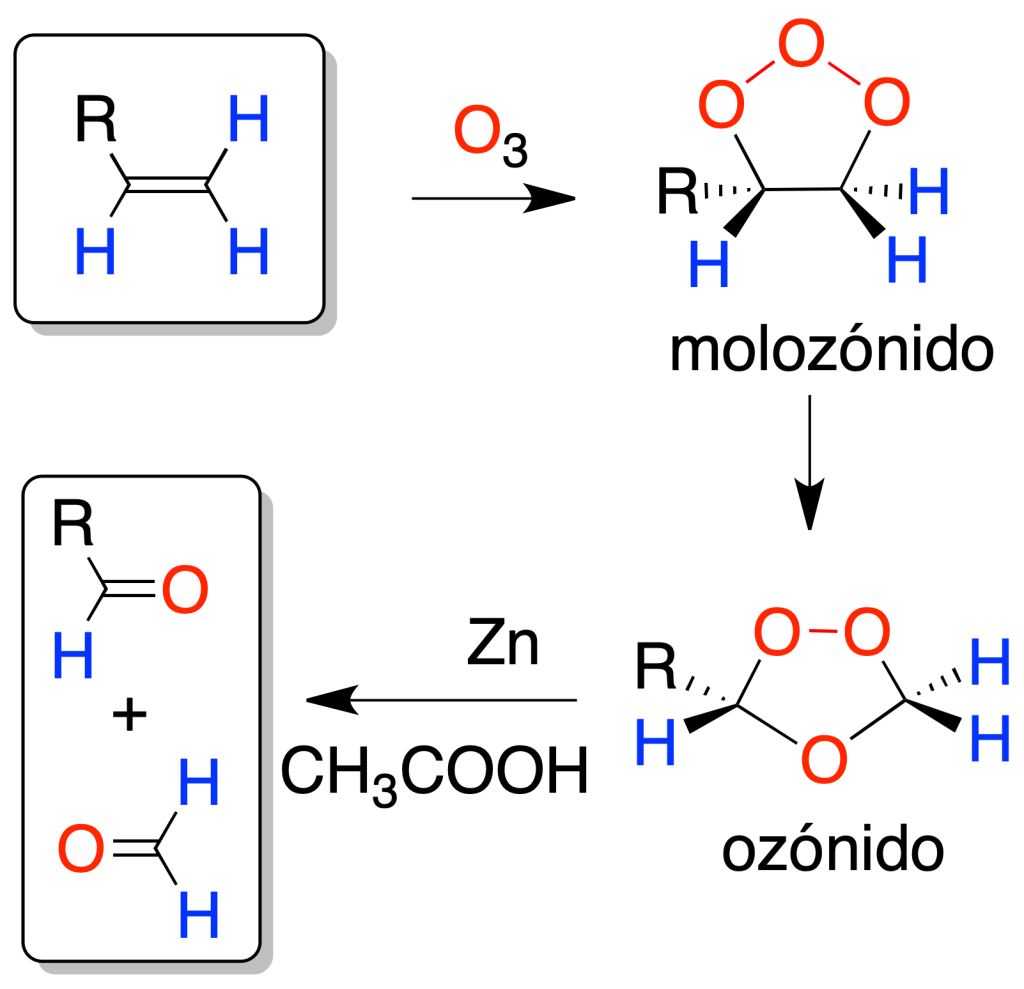
Tanto en este caso como en el siguiente, mediante el análisis de los fragmentos, es posible determinar la posición de un doble enlace en una molécula, aunque no su estereoquímica.
Si uno de los sustituyentes del doble enlace es hidrógeno, al menos uno de los compuestos carbonílicos obtenidos correspondería a un aldehído, pero si el doble enlace se encuentra en el extremo de una cadena (doble enlace terminal), se obtendría formaldehído.
Rotura oxidativa con permanganato
En la oxidación con permanganato, si no se controla la temperatura o el pH (altas temperaturas o condiciones ácidas o neutras) hay peligro de sobre-oxidación (rotura oxidativa del doble enlace), para dar ácidos carboxílicos o cetonas, o dióxido de carbono (caso de un alqueno terminal).
Al igual que en la ozonólisis, el análisis de los fragmentos nos permite conocer la localización del doble enlace.
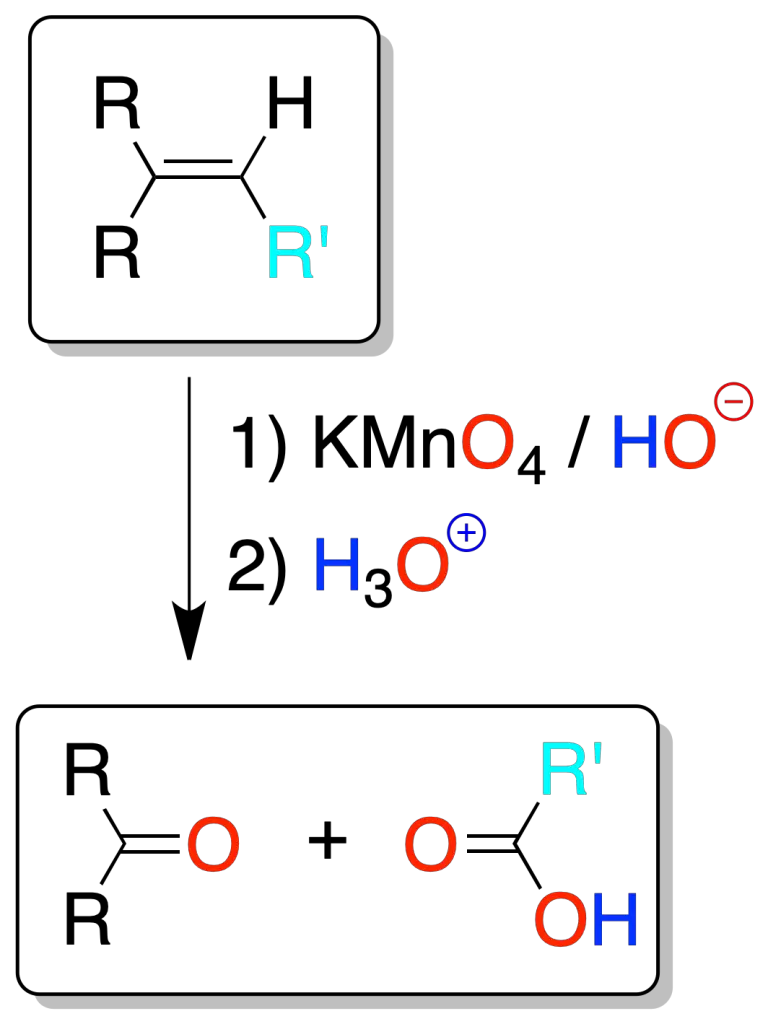
Si se forma una cetona uno de los carbonos que forma parte del doble enlace tiene dos sustituyentes. Si se desprende CO2, el doble enlace estaría en el extremo de una cadena.
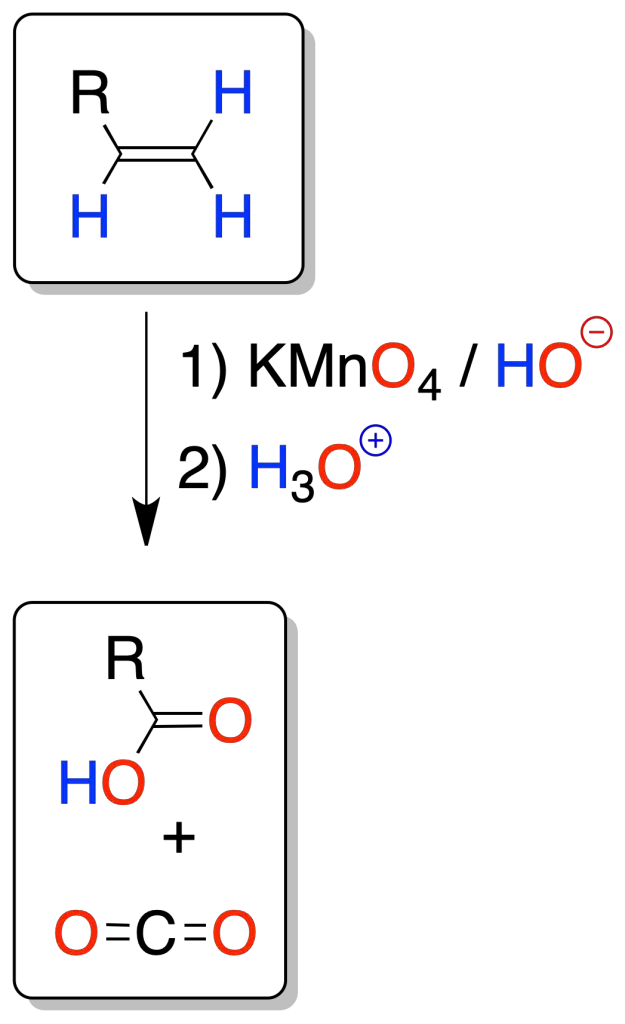
Para poder aislar los ácidos obtenidos es necesario acidificar, puesto que la reacción se lleva a cabo en medio básico formando iones carboxilato.
Reacciones de sustitución de alquenos (halogenación alílica)
La presencia de un doble enlace condiciona la reactividad en posiciones próximas al mismo, de forma que aparecen propiedades químicas nuevas.
En la cercanía de un doble enlace se pueden distinguir dos tipos de hidrógenos: vinílicos y alílicos.
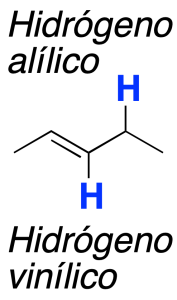
Resultan especialmente útiles las reacciones de halogenación radicalarias que se dan en las posiciones alílicas de los dobles enlaces, favorecidas por la estabilidad del radical alílico intermedio.
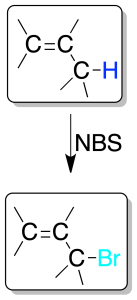
La halogenación en esta posición se puede realizar con Cl2 o Br2 calentando o irradiando con luz de frecuencia adecuada.
La bromación se suele hacer con NBS, que es una fuente de bajas concentraciones de radicales bromo.
La reacción tiene interés sintético cuando los hidrógenos en posición alílica son equivalentes.
Polimerización de alquenos
Los polímeros son macromoléculas (con masas moleculares altas, > 1000 uma) que se obtienen por la unión de muchas moléculas más pequeñas entre sí, que reciben el nombre de monómeros.
La mayoría de los polímeros naturales o sintéticos provienen de la unión de monómeros que son alquenos. Hay tres tipos de polimerización:
Polimerización catiónica
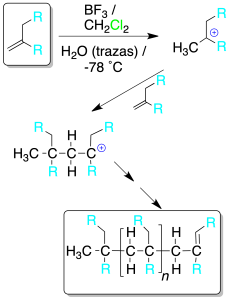
El tratamiento de un alqueno con ácido fuerte (de Brønsted en medio acuoso o de Lewis con trazas de agua) genera un carbocatión, que actúa como electrófilo sobre una nueva molécula de alqueno.
El proceso continúa de forma reiterada hasta la obtención de una cadena que deja de crecer por la pérdida de un protón o por la adición de alguna molécula con tal fin.
Polimerización radicalaria
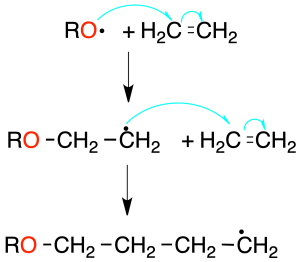
Las moléculas de monómero reaccionan en presencia de un iniciador de radicales (peróxido de benzoílo o AIBN). El iniciador genera un radical que ataca a una molécula de monómero, produciendo un nuevo radical (etapa de iniciación).
Los radicales producidos en esta etapa atacan a nuevas moléculas de monómero (etapa de propagación) hasta formar una cadena. El crecimiento del polímero finaliza por combinación de radicales, o reacciones de desproporcionamiento (transferencia de H·, con formación de una olefina y un compuesto saturado).
Polimerización aniónica
Se genera un anión a partir del monómero, por tratamiento con una base fuerte como LiBu, y este anión ataca a otra molécula de monómero. El proceso continúa hasta la adición de alguna molécula que aporta protones e impide que siga creciendo la cadena (quench).
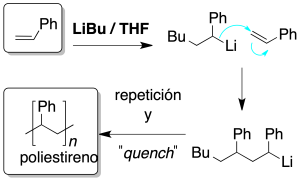
Es imprescindible para que se produzca la reacción que los sustituyentes del doble enlace sean capaces de estabilizar la carga negativa.
