Written by J.A. Dobado | Last Updated on 1 año
Hidrocarburos aromáticos
Aunque formalmente la estructura del benceno sería la correspondiente al 1,3,5-ciclohexatrieno (es decir, la correspondiente a un polieno conjugado) sus propiedades no se corresponden a las del polieno.
Índice
Por ejemplo, no sufre reacciones de adición en ninguna de las condiciones especificadas en reacciones de alquenos y dienos, su calor de hidrogenación es anormalmente bajo (unas 30 kcal/mol menos del esperado), su geometría indica que todos los enlaces son equivalentes, en RMN los protones resuenan a campos anormalmente bajos respecto a los de los alquenos, etc.
Algunas de dichas características se podrían explicar considerando la estructura del benceno como un híbrido de resonancia entre varias estructuras resonantes:
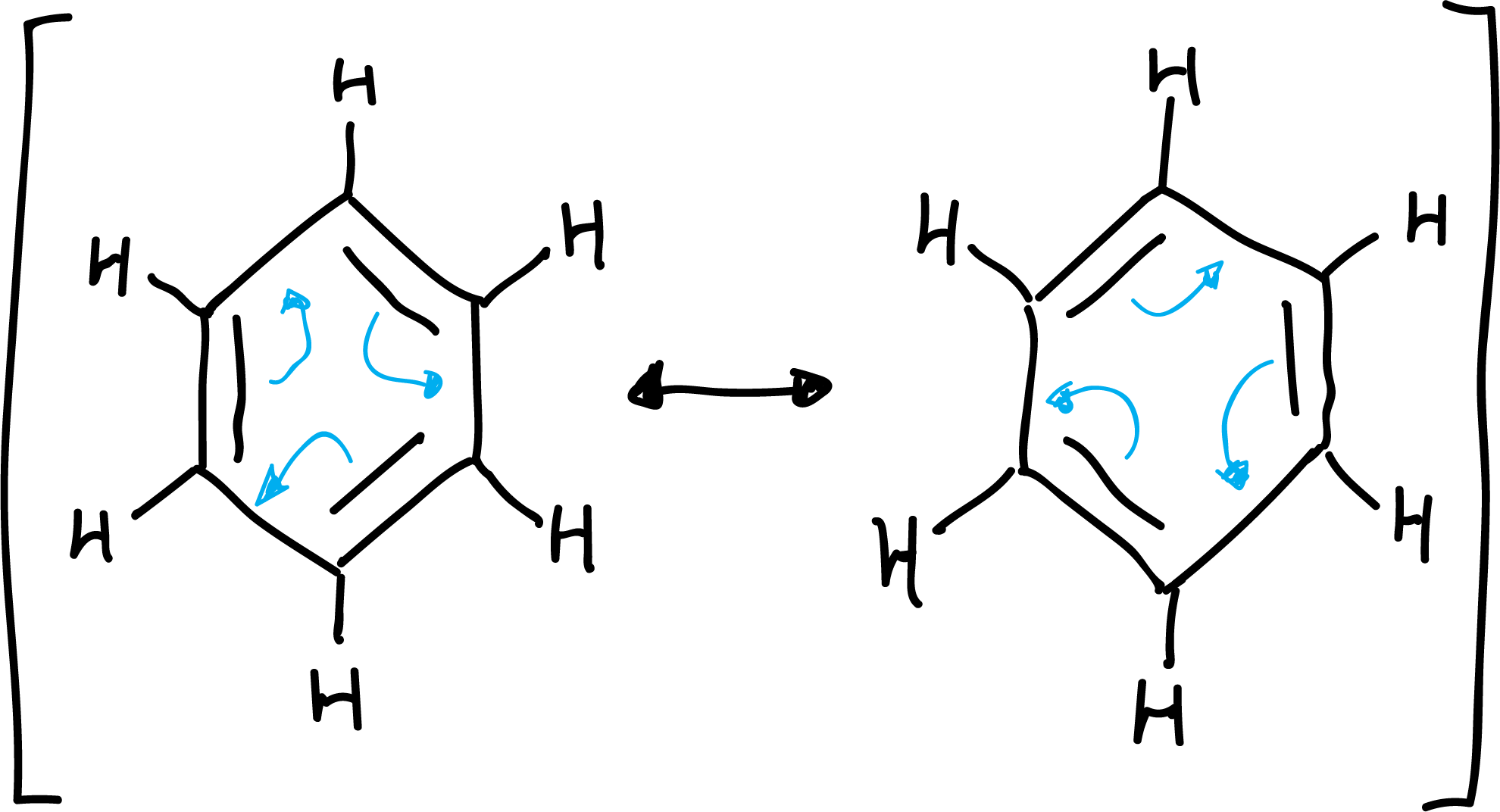
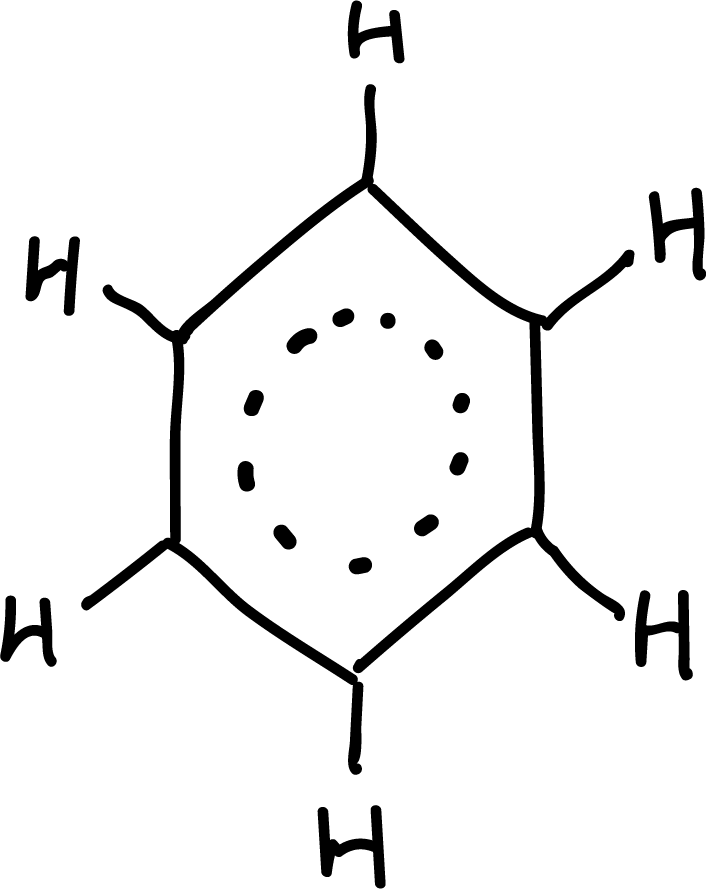
Aromaticidad
A la propiedad responsable de todas estas propiedades excepcionales la denominamos aromaticidad y no sólo se presenta en el benceno.
Para que una estructura sea aromática, en principio debe cumplir tres condiciones:
- Tratarse de un sistema poliénico conjugado cíclico.
- Ser una estructura plana.
- Debe cumplirse la regla de Hückel: el número de electrones implicados en el sistema conjugado debe corresponder a la formula:
nº electrones = 4n + 2 para sistemas aromáticos o 4n para sistemas antiaromáticos.
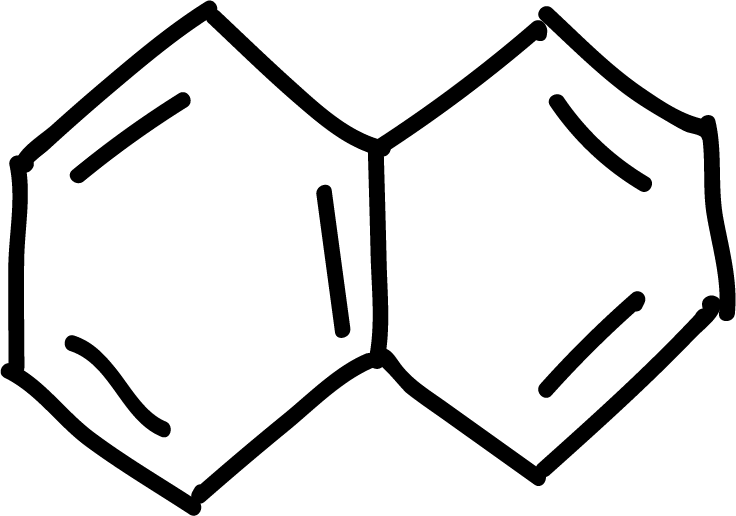
donde n es un número entero (0, 1, 2, etc). A continuación se ilustran algunos ejemplos de compuestos aromáticos:
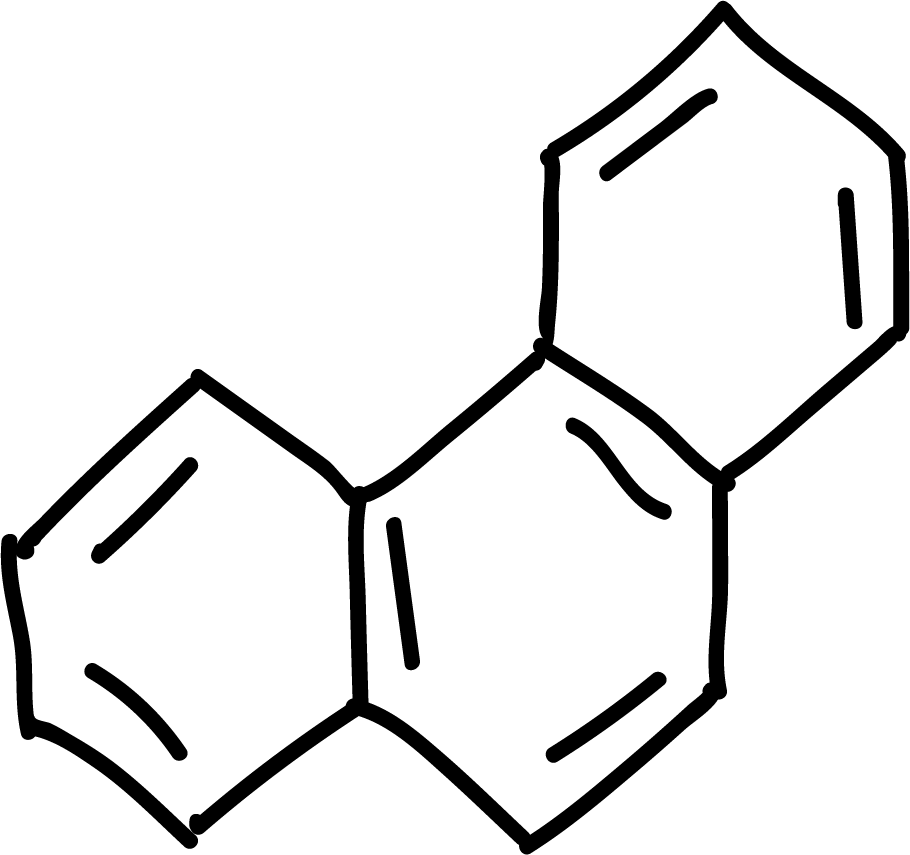
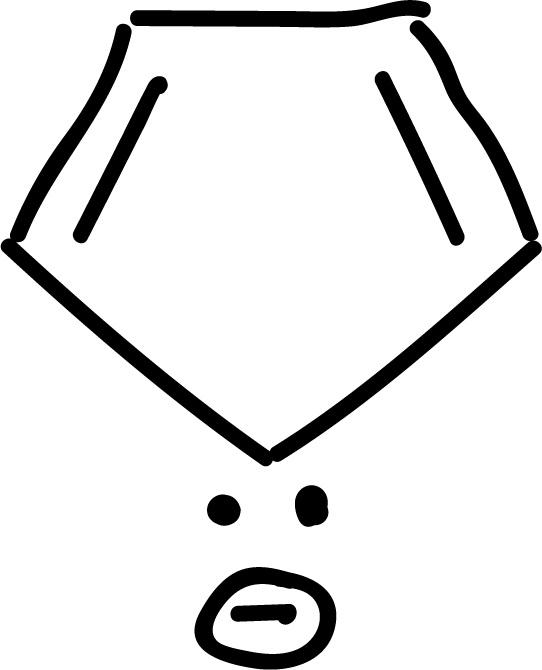
y otros antiaromáticos:

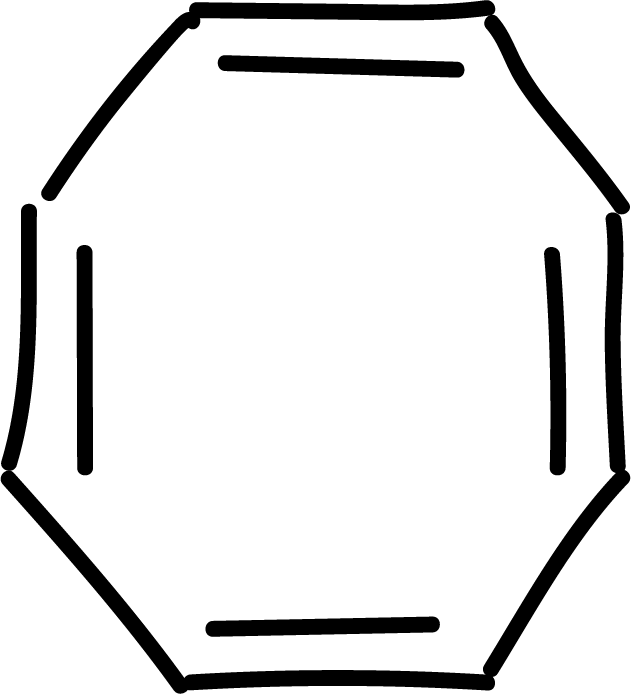
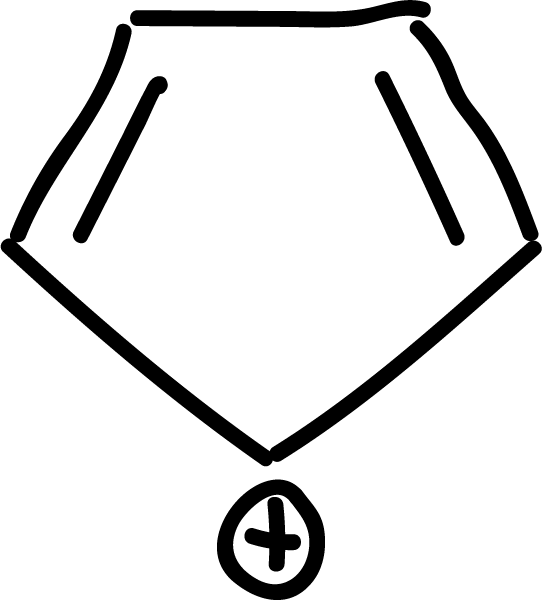
Sustitución electrofílica aromática (SEAr) en el benceno
Las reacciones de sustitución electrofílica aromática (SEAr) permiten el reemplazo de un hidrógeno de un anillo aromático por un reactivo electrófilo, E⊕. Para una descripción del mecanismo de reacción véase enlace.
Condiciones de reacción
Dependiendo de la naturaleza del electrófilo se pueden obtener una gran variedad de derivados aromáticos. Generalmente, las reacciones se catalizan con ácidos de Lewis o ácidos minerales.
| Tipo de Reacción | Reactivos | Electrófilo (producto) |
| Halogenación | X2 / FeX3 | X⊕ (Ar-X) |
| Nitración | HNO3 / H2SO4 | NO2⊕ (Ar-NO2) |
| Sulfonación | H2SO4 / SO3 | SO3 (Ar-SO3H) |
| Alquilación | R-Cl / AlCl3 o R-OH / H⊕ o C=C / H⊕ | R⊕ (Ar-R) |
| Acilación | R-COCl o (RCO)2O / H⊕ | RCO⊕ (Ar-COR) |
Halogenación
La reacción se lleva a cabo tratando el compuesto aromático con el halógeno en presencia de un ácido de Lewis (Feº que se transforma en FeX3 in situ por reacción con el halógeno).
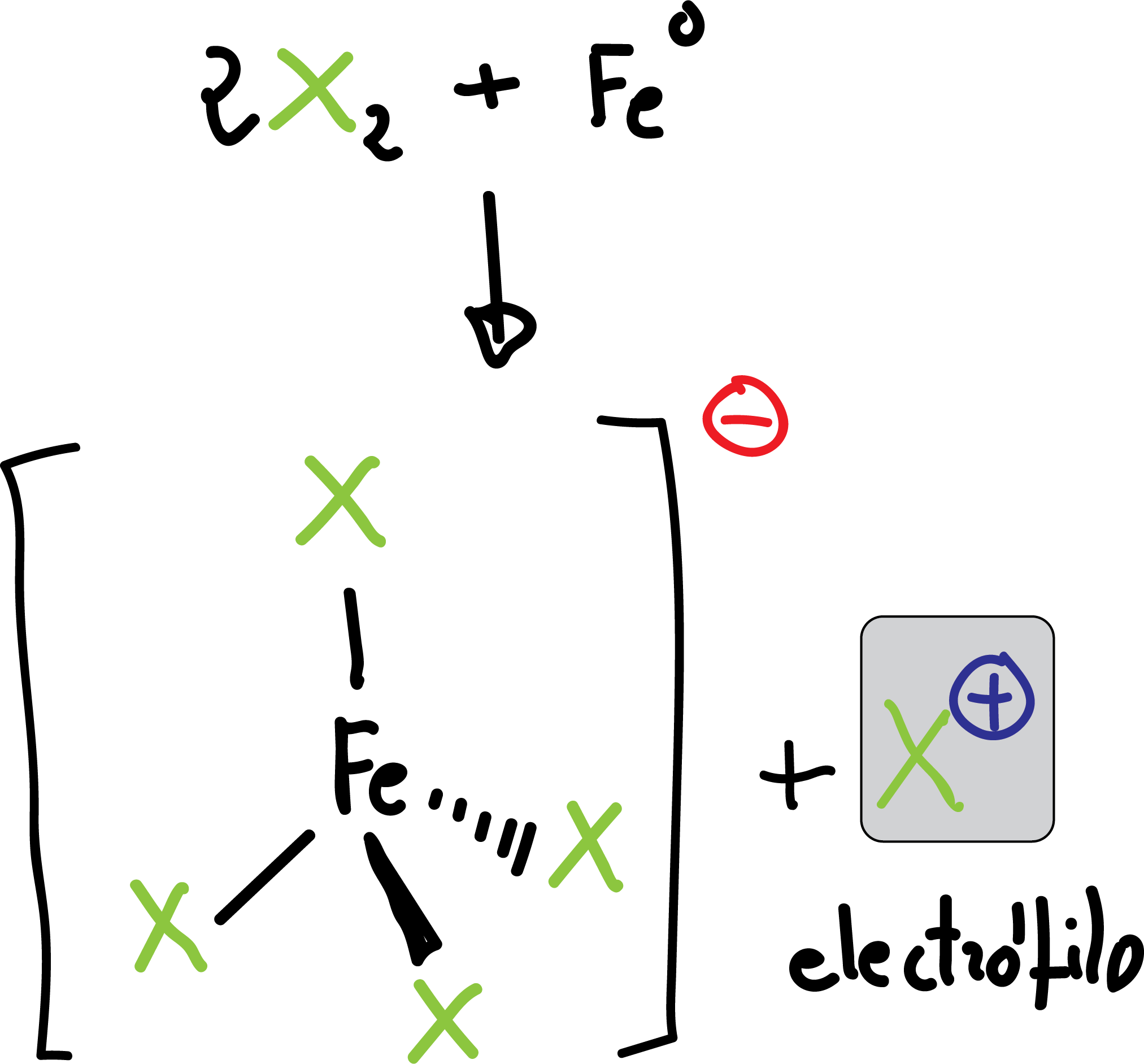
El FeX3 actúa como ácido de Lewis, liberando el electrófilo X⊕.
La reacción es aplicable para el caso de Cl⊖ y Br⊖. Para introducir I⊖ o F⊖ se utilizan otros métodos que se verán más adelante (véase Síntesis y reactividad de las sales de diazonio).
Nitración
En este caso el electrófilo, ⊕NO2 (ión nitronio), se obtiene por pérdida de una molécula de agua del HNO3, por la acción del ácido sulfúrico H2SO4, que es un buen agente deshidratante. El H2SO4 actúa de ácido frente al HNO3 que actúa de base (ácido mucho mas débil que el H2SO4). Se trata de una reacción de equilibrio ácido-base.
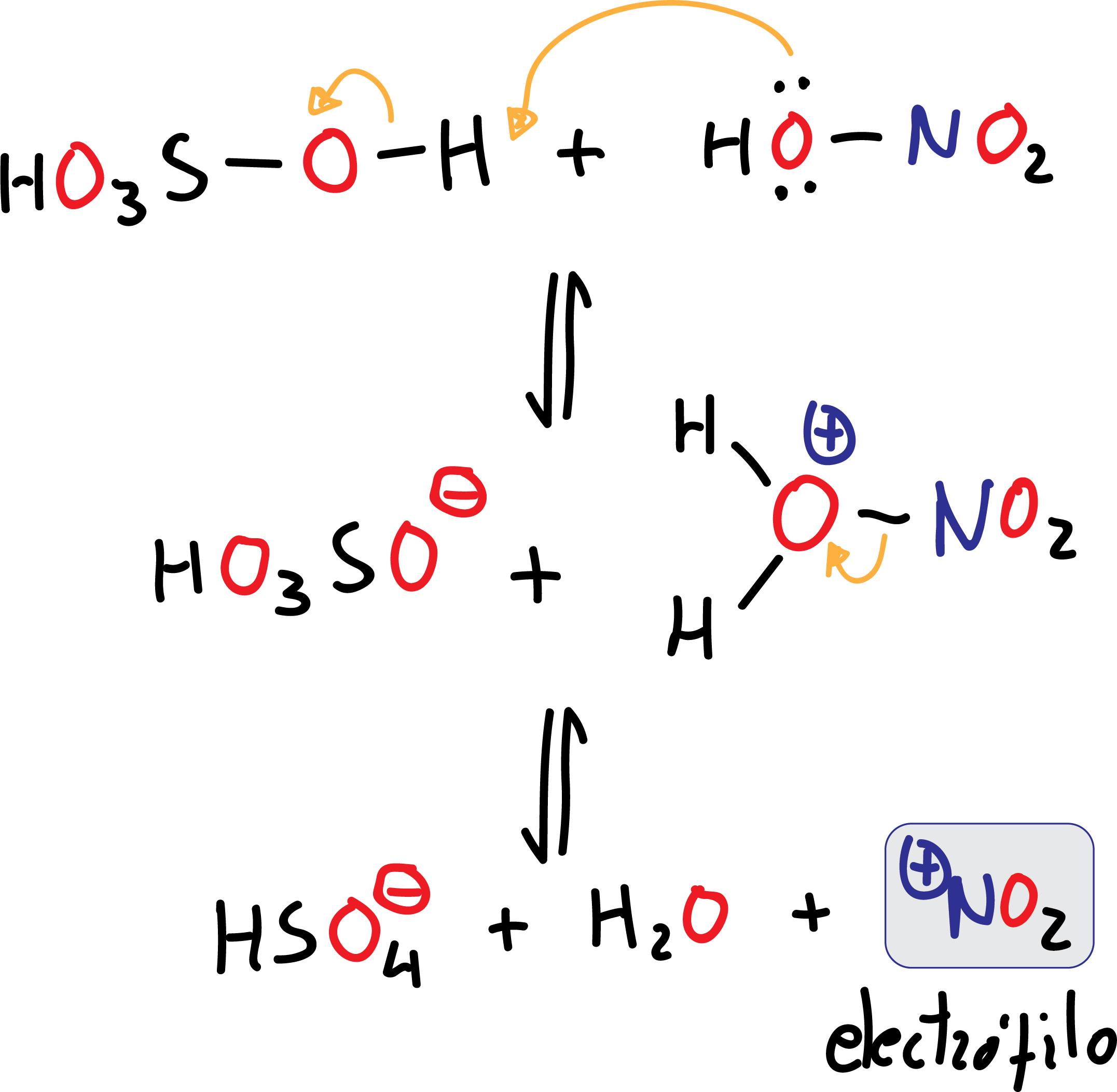
El ión nitronio ⊕NO2 se conoce ampliamente ya que existen las sales como el fluoroborato de nitronio (NO2BF4) o el perclorato de nitronio (NO2ClO4). Estas sales de nitronio estables disueltas (en nitrometano o ácido acético) son capaces de nitrar ligeramente a compuestos aromáticos a temperatura ambiente y con altos rendimientos.
Sulfonación
El electrófilo es el SO3, que se obtiene por pérdida de una molécula de agua del propio ácido sulfúrico H2SO4 cuando éste se calienta.
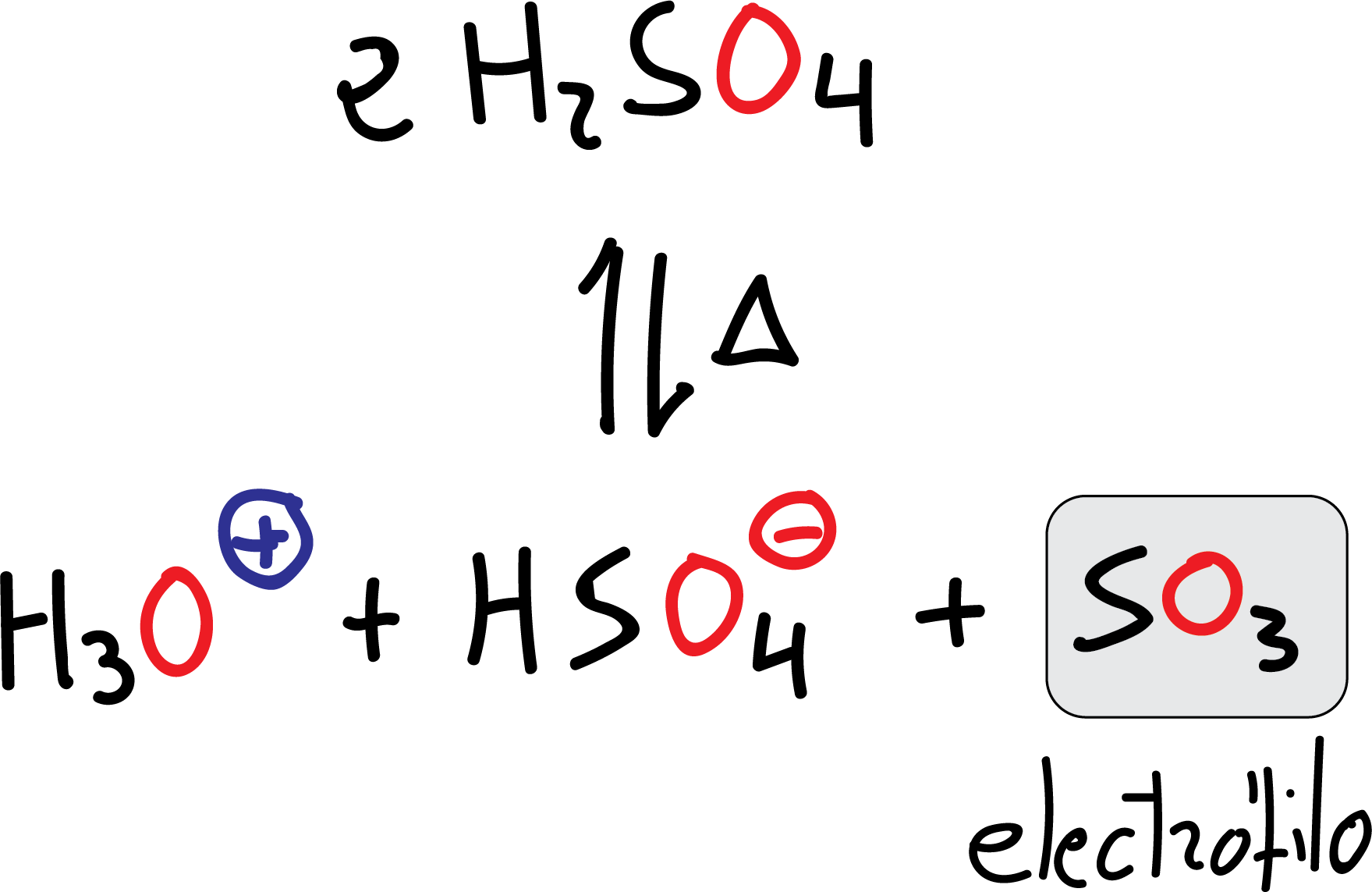
Aunque el SO3 está presente en concentraciones próximas al 20 % en el denominado ácido sulfúrico fumante, que es el reactivo que se utiliza con el benceno o con sustratos poco reactivos. A diferencia de otros electrófilos, el la molécula de SO3, es neutra y no presenta carga formal.
El mecanismo de la reacción de sulfonación en benceno transcurre según el siguiente esquema:
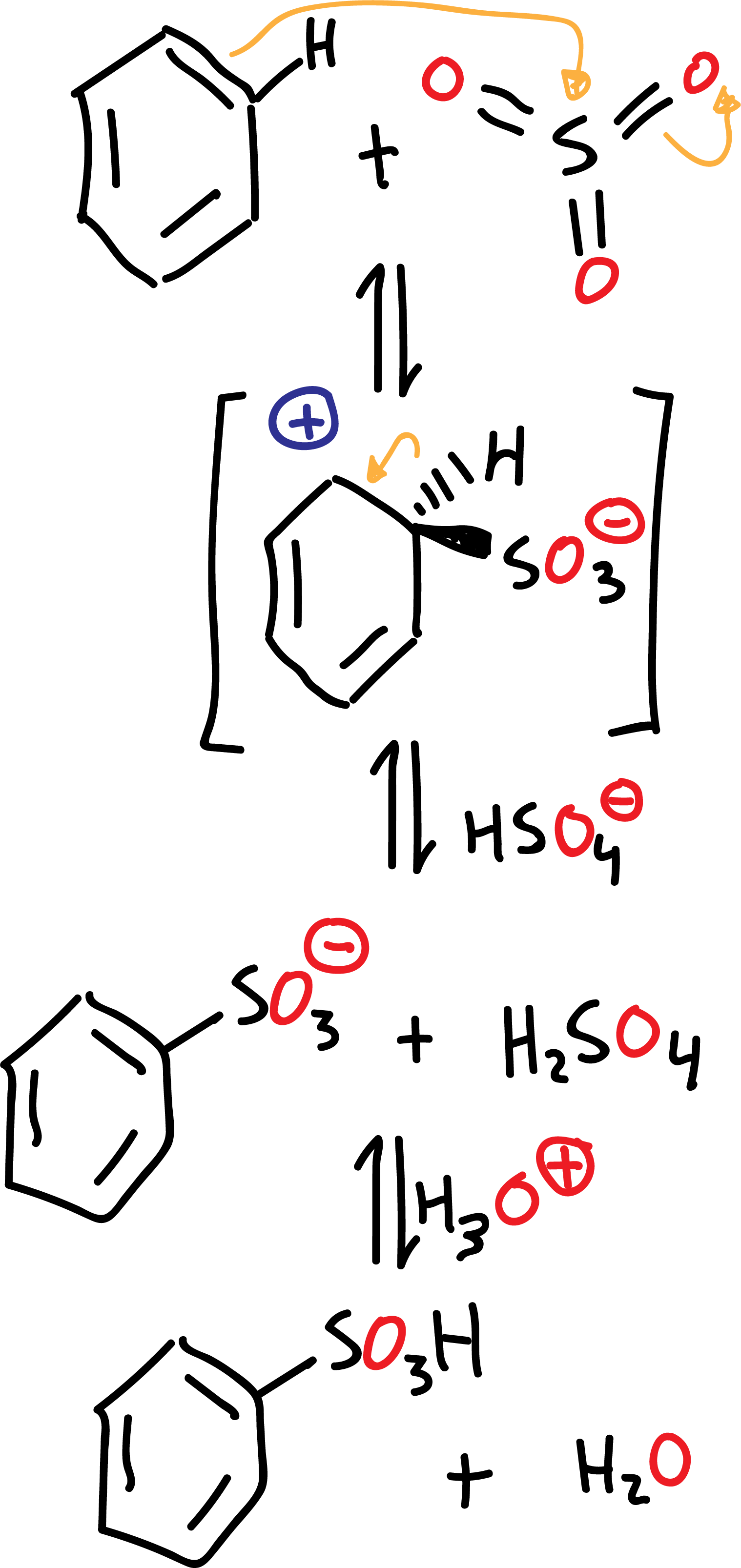
La reacción de sulfonación se diferencia con respecto al resto de reacciones de sustitución aromática electrofílica, en que es un proceso de equilibrio y, por tanto, reversible. Se favorece la formación del producto de sulfonación eliminando el agua de la reacción.
Alquilación Friedel-Crafts
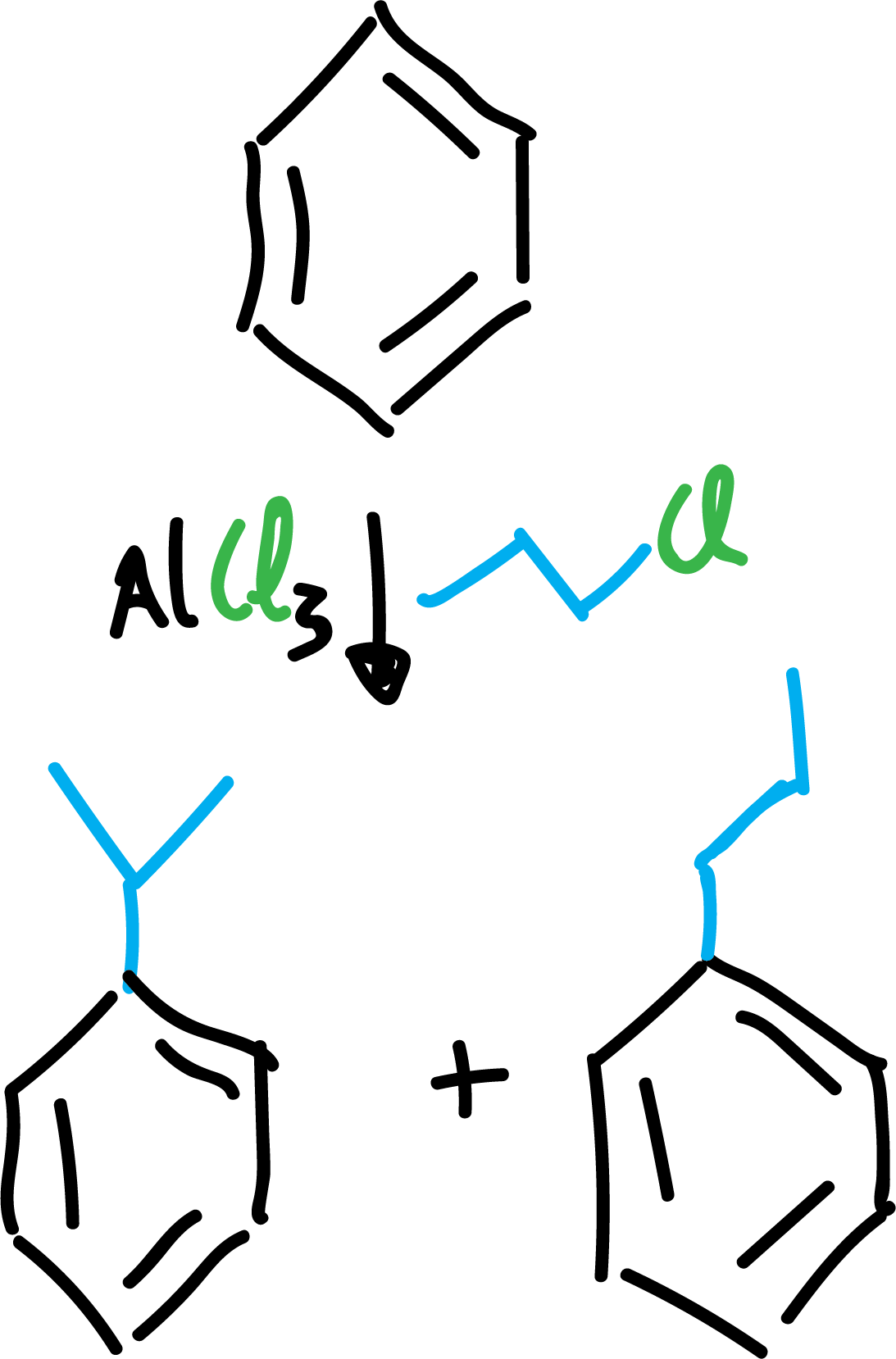
La reacción de alquilación, conocida también como alquilación Friedel-Crafts, consiste en la reacción de un haluro de alquilo (cloruro o bromuro) con un compuesto aromático en presencia de un ácido de Lewis del tipo AlX3. Los haluros de vinilo o arilo no reaccionan en estas condiciones.
El electrófilo que se forma es un carbocatión que se produce por la acción del catalizador.
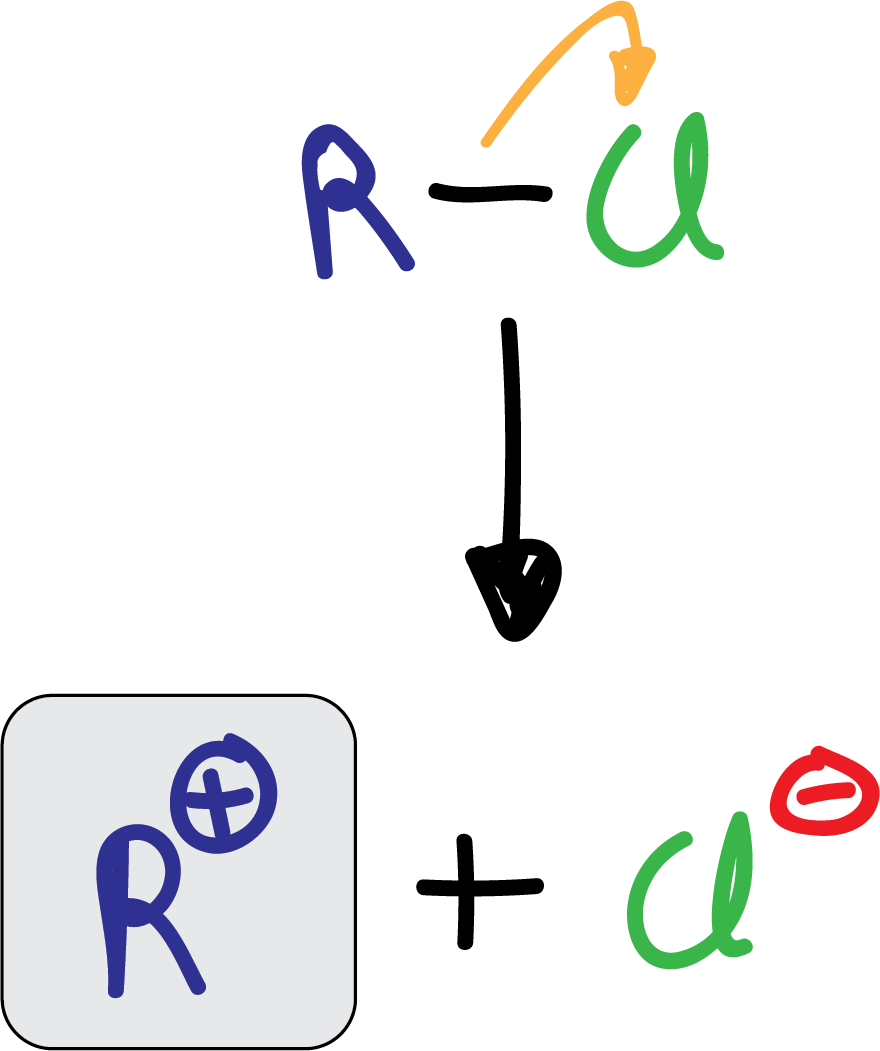
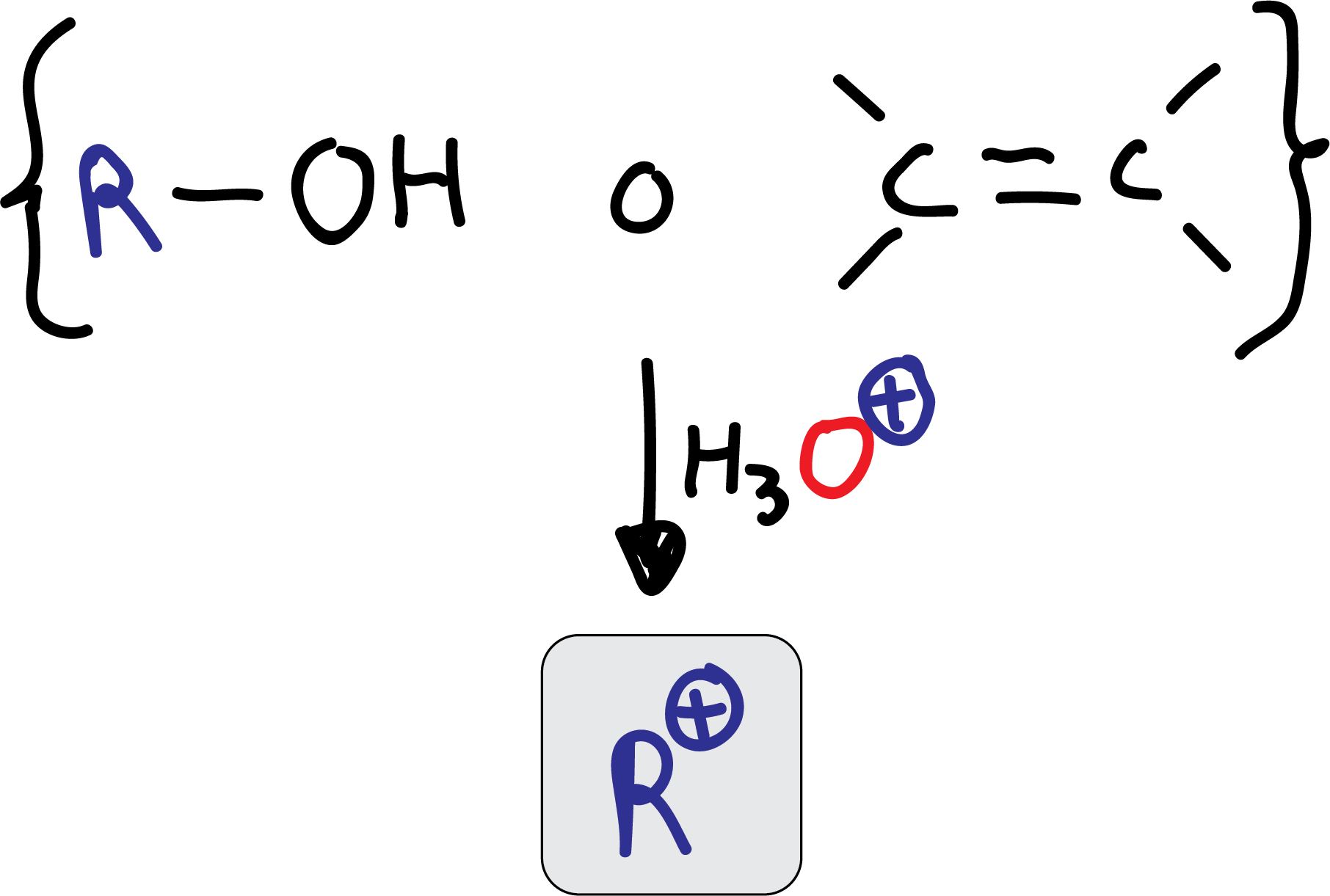
Como alternativa al uso de un haluro de alquilo para generar el electrófilo, se pueden emplear alcoholes o alquenos, que en presencia de ácido, forman igualmente carbocationes.
La reacción presenta una serie de limitaciones.
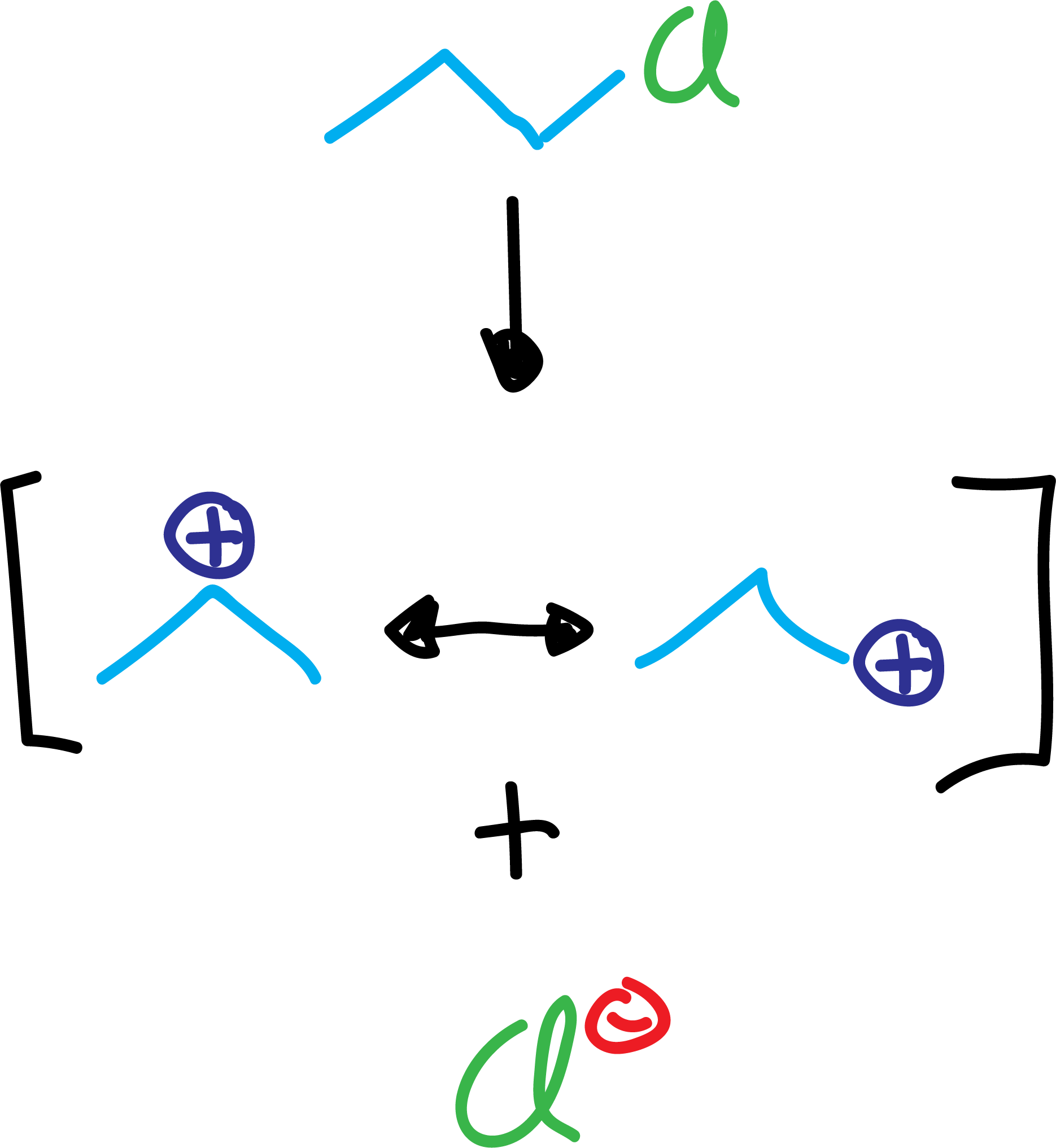
Por un lado, al generarse carbocationes, éstos suelen sufrir reacciones de reagrupamiento, obteniéndose productos diferentes a los que en principio se deberían esperar.
Por otro lado, la introducción de grupos alquilo convierte a los anillos aromáticos en moléculas más reactivas que el propio benceno, por lo que es difícil aislar el producto de monosustitución, obteniéndose, en muchas ocasiones, derivados polisustituidos.
Acilación Friedel-Crafts
En la acilación Friedel-Crafts se obtiene una cetona aromática por reacción del anillo aromático con un cloruro de acilo en presencia de un ácido de Lewis, que suele ser AlCl3.
El electrófilo que se genera es un catión acilio (R-CO⊕), relativamente estable, debido a que se encuentra estabilizado por resonancia.
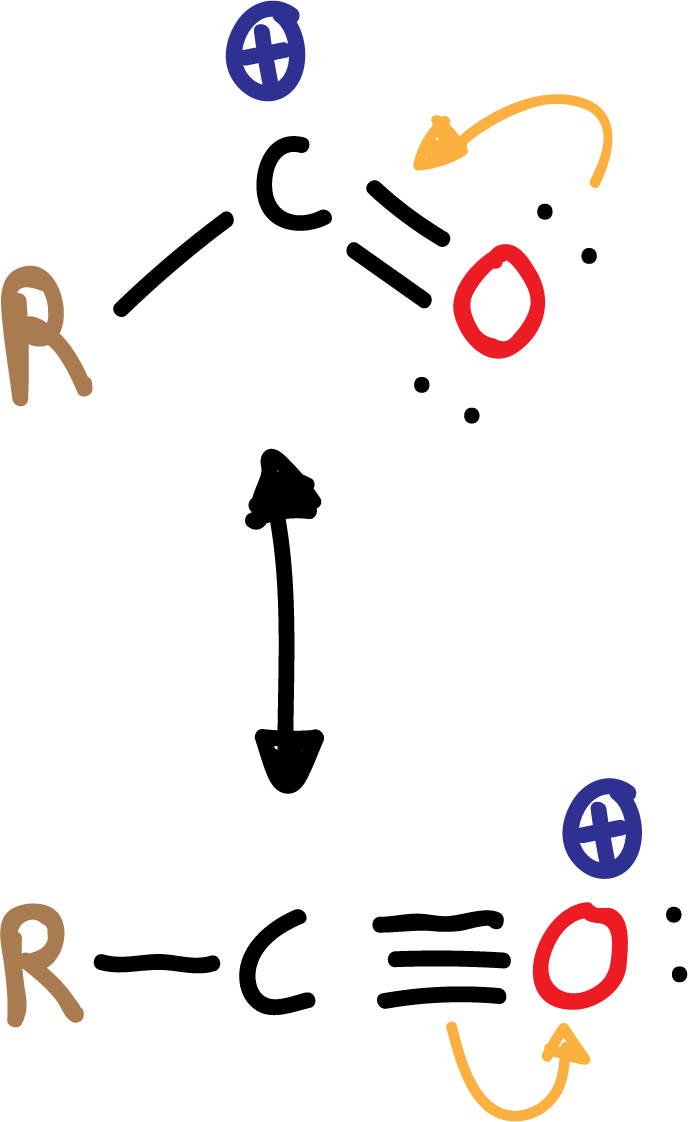
En la reacción de acilación no se producen reagrupamientos, como en el caso de la alquilación.
Sustitución electrofílica aromática (SEAr) en bencenos sustituidos
Bencenos monosustituidos
Cuando se lleva a cabo una reacción de sustitución electrofílica aromática (SEAr) sobre un anillo de benceno con una o más posiciones del anillo con sustituyentes diferentes al hidrógeno, hay que considerar dos factores que intervienen en la reacción:
- Que el o los grupos unidos al anillo aromático aumente/n o disminuya/n la velocidad de reacción con respecto al benceno.
- La posición de entrada del nuevo sustituyente.
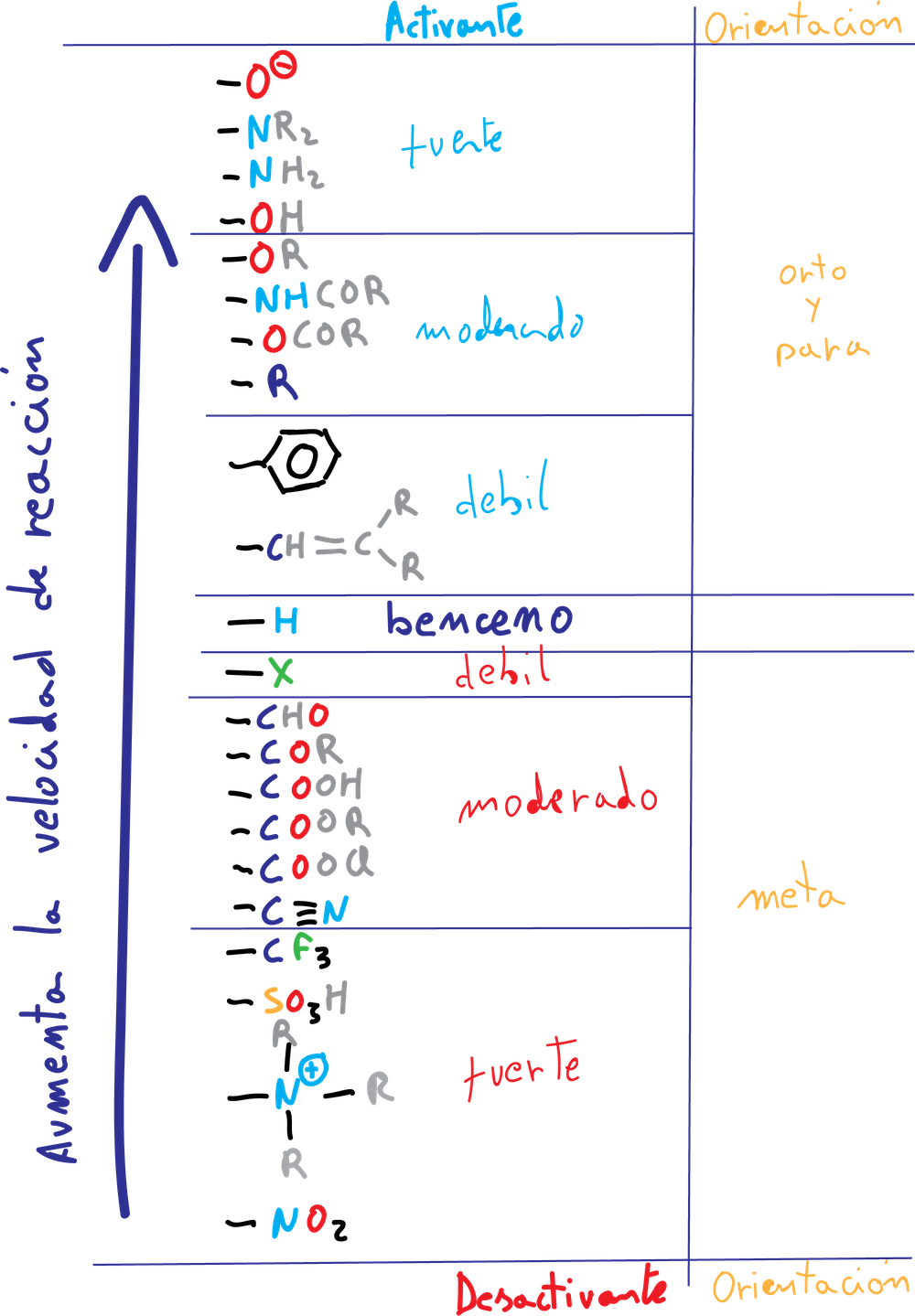
Los grupos que aumentan la velocidad de reacción de sustitución aromática electrofílica con respecto al benceno se denominan activantes, y los que la disminuyen, desactivantes. Cuando se introduce un electrófilo sobre un benceno monosustituido se pueden dar tres isómeros:
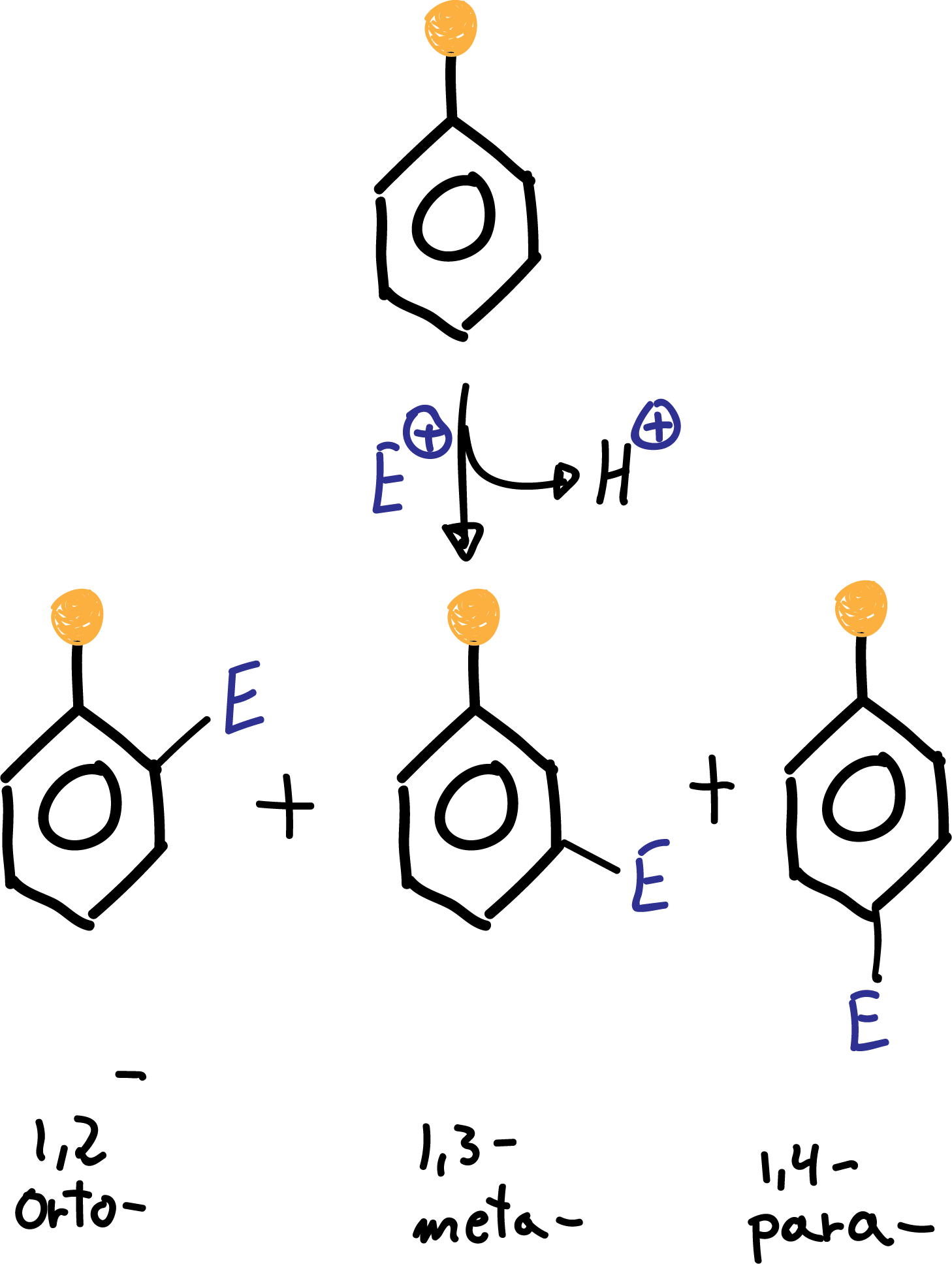
Se puede predecir la formación del producto mayoritario de la reacción de sustitución en derivados del benceno monosustituidos de acuerdo con la siguiente clasificación:
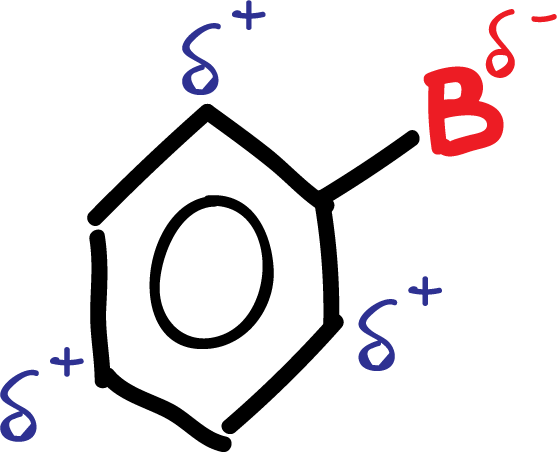
A.- Los grupos activantes A (-NH2, –OR, etc) y los halógenos producen un aumento de la densidad electrónica en las posiciones orto– y para–, por la influencia de los pares de electrones no enlazantes que poseen este tipo de sustituyentes.
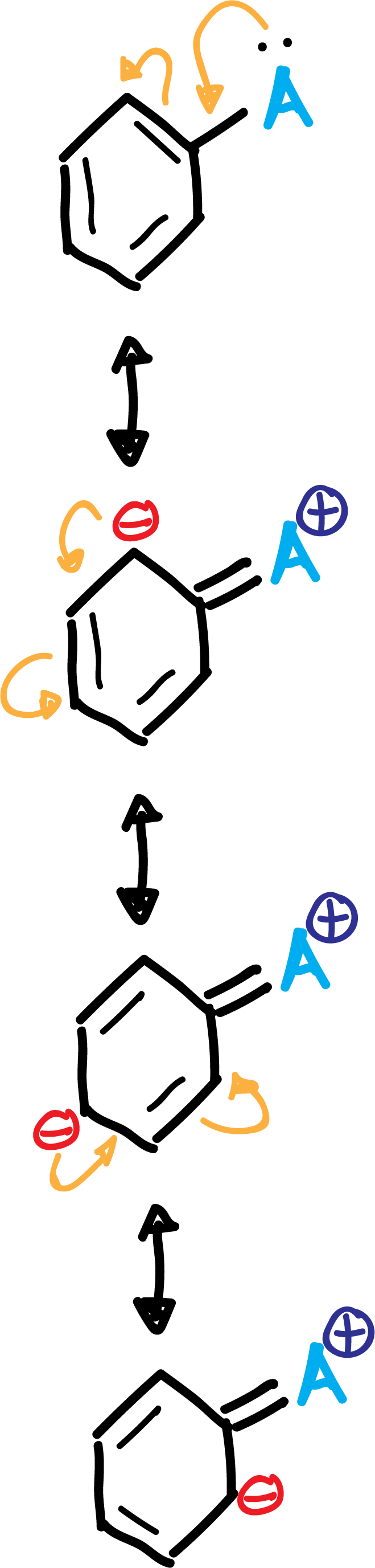
En resumen, el grupo activante A queda con una carga parcial positiva, mientras que en el anillo, en posiciones orto- y para- aparecen cargas parciales negativas, como se indica en el esquema:
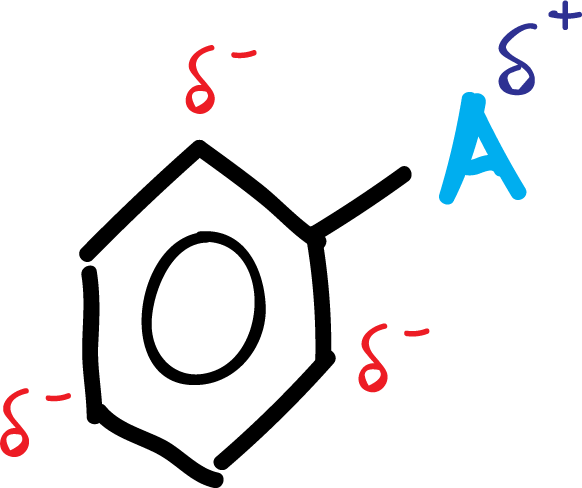
B.- Los grupos desactivantes B (-NO2, -CN, –COO-, etc), excepto los halógenos son meta-dirigentes en una nueva reacción de sustitución, ya que producen un aumento de la densidad de carga positiva sobre las posiciones orto- y para-, por lo que las posiciones meta- no quedan tan desfavorecidas.
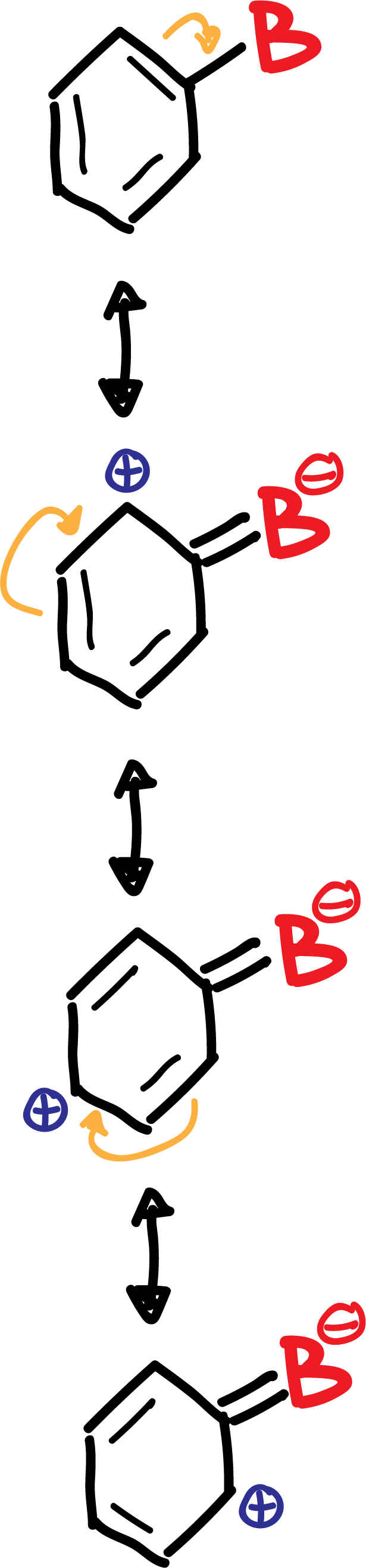
En resumen, el grupo desactivante B queda con una carga parcial negativas, mientras que en el anillo, en posiciones orto- y para- aparecen cargas parciales positivas, como se indica en el esquema:
Estas variaciones de la densidad electrónica en el anillo aromático de los derivados del benceno se pueden predecir en base a las estructuras resonantes de los compuestos que aportan o retiran electrones al sistema π del anillo aromático.
Bencenos disustituidos
Cuando hay más de un sustituyente, la activación del anillo de benceno y la orientación en el ataque del nuevo electrófilo se puede predecir con bastante exactitud ya que el resultado de una nueva reacción de sustitución aromática electrofílica se debe a la suma de los efectos individuales de los grupos unidos al anillo aromático.
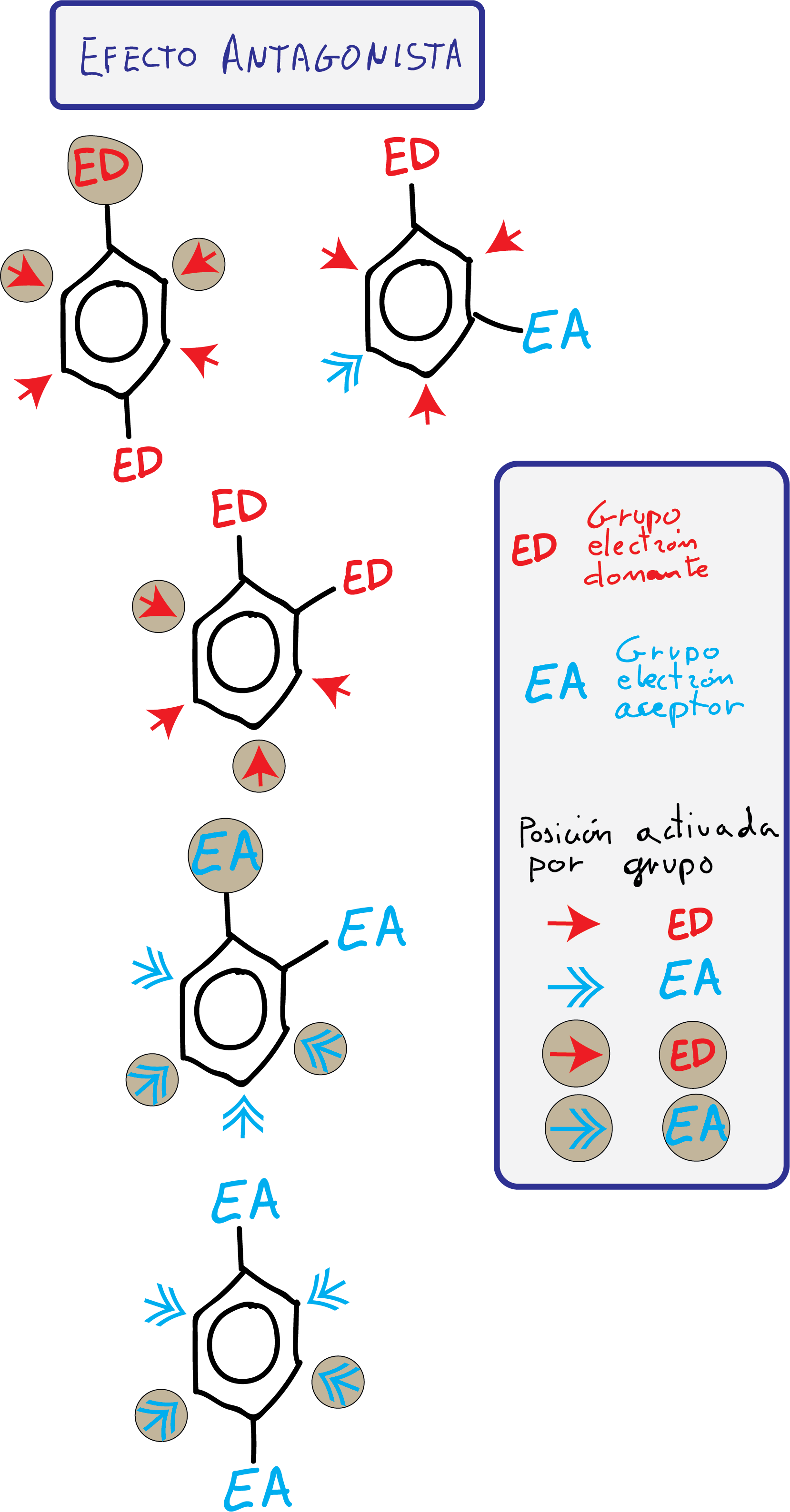
Para predecir la orientación del ataque del electrófilo, se consideran dos casos:
- Grupos con efecto cooperativo: Se favorece el ataque de un electrófilo en una o más posiciones del anillo.
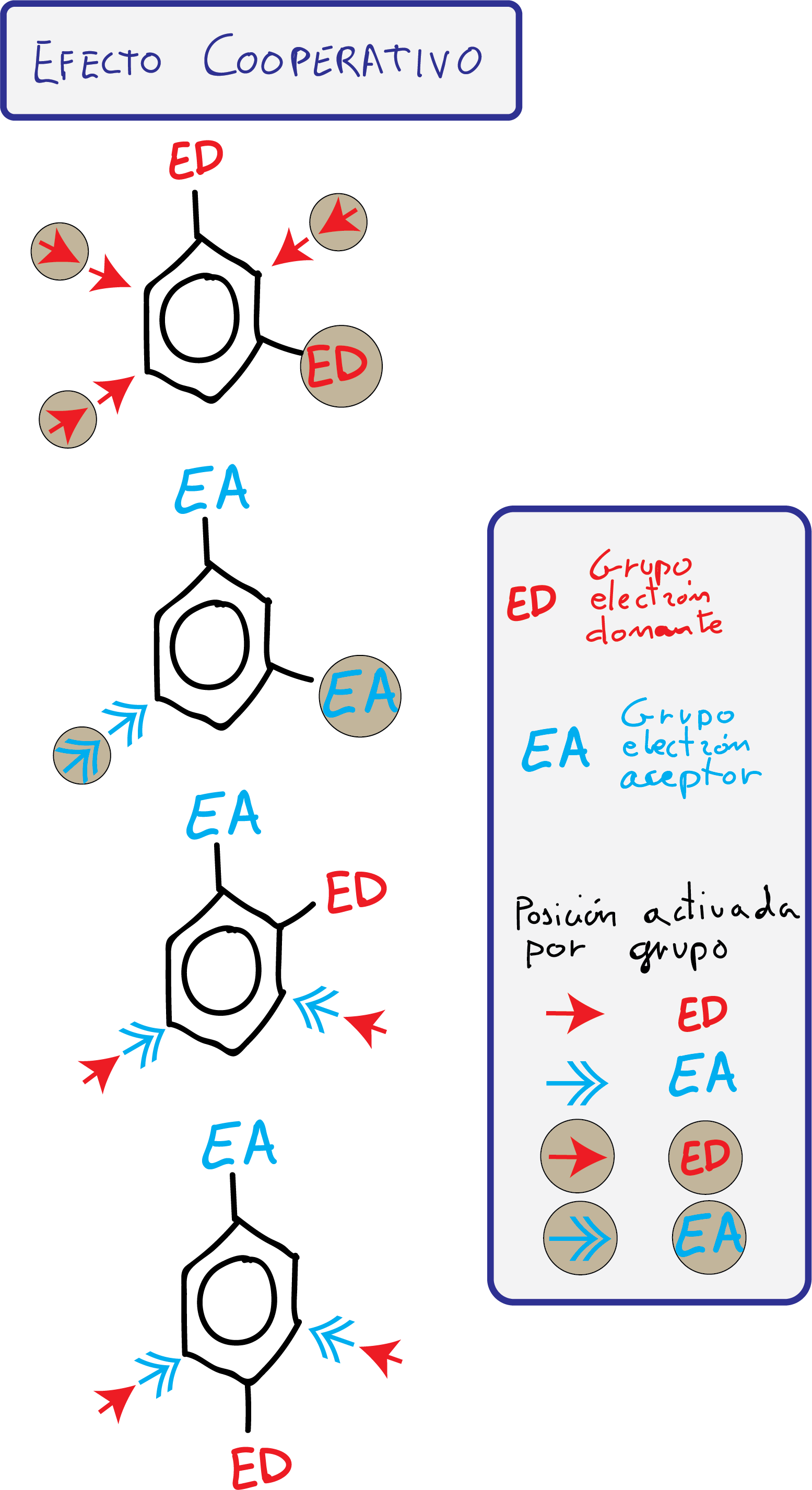
- Grupos con efecto antagonista: Los sustituyentes presentan efectos contrapuestos o siendo efectos del mismo tipo, no hay posiciones que presenten una reactividad diferenciada.
Hidrocarburos aromáticos policíclicos
Los hidrocarburos aromáticos policíclicos como el naftaleno, el antraceno y el fenantreno pueden dar las reacciones de sustitución aromática electrofílica de tipo halogenación, sulfonación o acilación. La posición 1 del naftaleno es la más reactiva, mientras que en el antraceno y el fenantreno la posición 9 es la más reactiva.
En condiciones normales, se obtienen este tipo de productos. Sin embargo, con la sulfonación, al ser una reacción reversible, evoluciona hacia el producto termodinámicamente más estable, que en el naftaleno es el sustituido en la posición 2.
La mayor reactividad de estas posiciones se justifica mediante las estructuras resonantes de los estados de transición.
Con frecuencia se obtienen productos disustituidos y mezclas de productos, por lo que se requiere un estudio detallado para cada caso.
Sustitución nucleofílica aromática (SNAr)
En anillos aromáticos con grupos desactivantes, es posible realizar la reacción de sustitución de halógenos por nucleófilos.
Para que la reacción sea viable es necesario que en las posiciones orto- o para- con respecto al halógeno exista un grupo desactivante como el grupo -NO2 (si es en ambas simultáneamente, mejor), y que el reactivo utilizado sea un buen nucleófilo.
Este tipo de reacción se puede dar mediante dos mecanismos:
a) Adición-eliminación
La presencia de un grupo electrón-atrayente en las posiciones orto– o para– es imprescindible para la estabilización de la carga negativa del anión. Sin estos grupos la reacción no es posible.
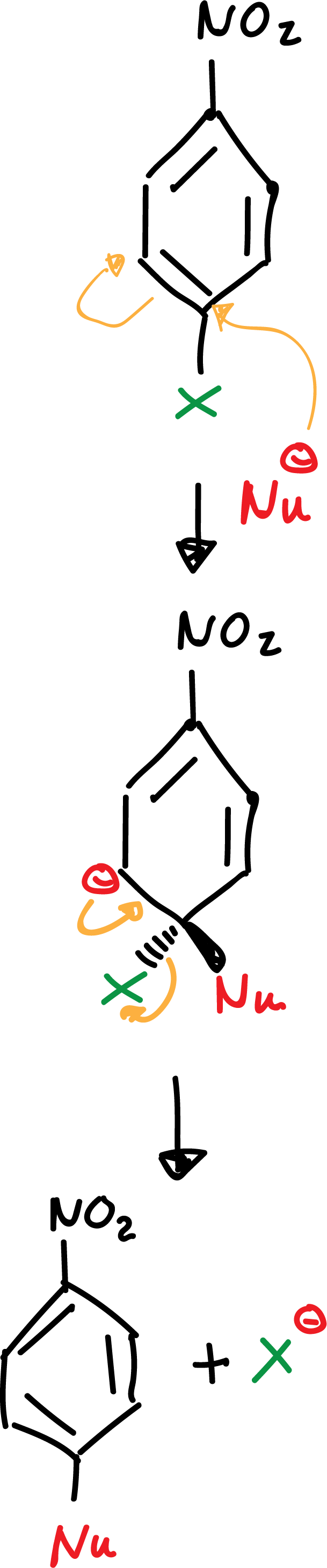
El grupo -NO2 favorece la deslocalización de la carga negativa en los intermedios que se forman en la reacción como se indica:
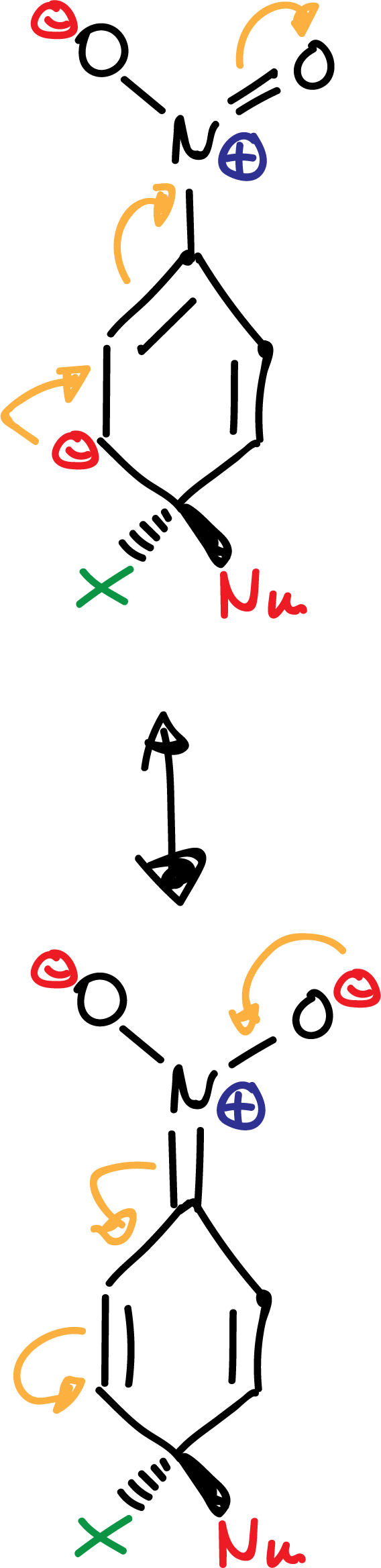
El orden de reactividad para los halógenos es F > Cl > Br > I, justo el contrario al que en las reacciones SN2.
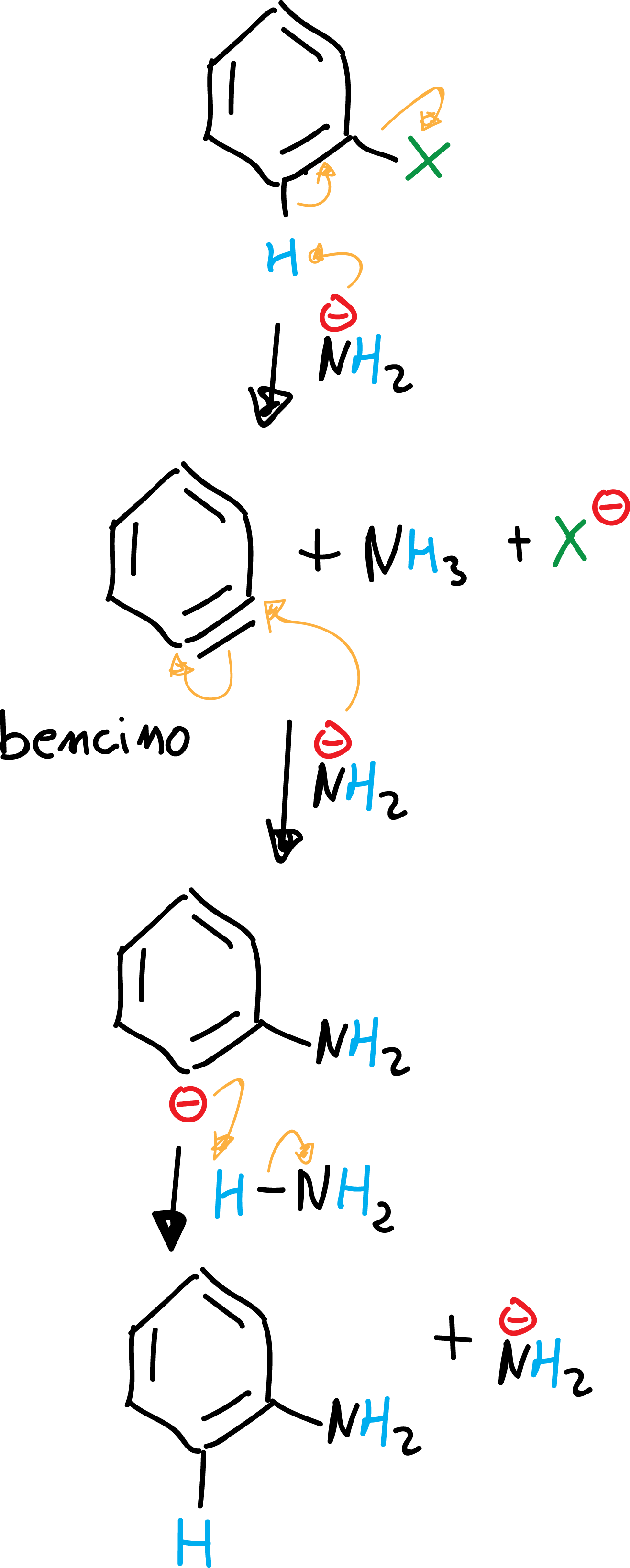
b) Eliminación-adición (mediante el intermedio bencino)
Bases muy fuertes como el amiduro sódico o potásico son capaces de reaccionar con haluros de arilo para dar el producto de sustitución del halógeno por la base. Además, este producto de sustitución que se obtiene es, a su vez, un nucleófilo. La reacción transcurre mediante un mecanismo de eliminación-adición a través de un intermedio que se denomina bencino.
Adiciones al anillo aromático
Hidrogenación catalítica
A pesar de la estabilidad del benceno, bajo determinadas condiciones de reacción puede sufrir reacciones de adición a alta presión y en presencia de Pt, Pd o Ni.
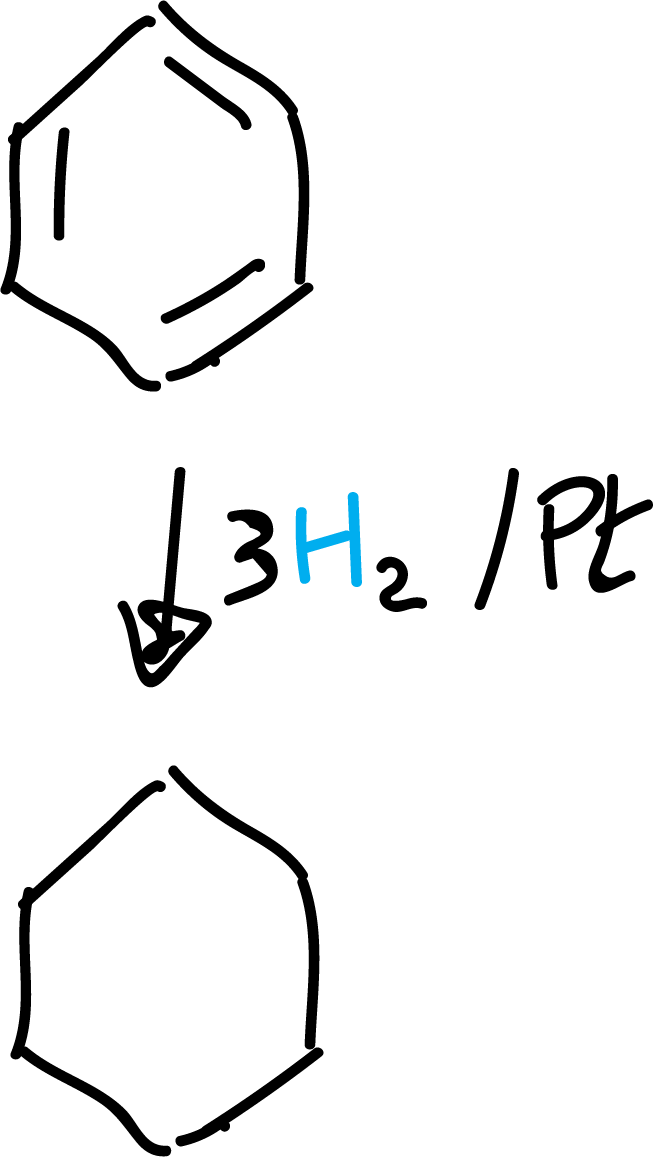
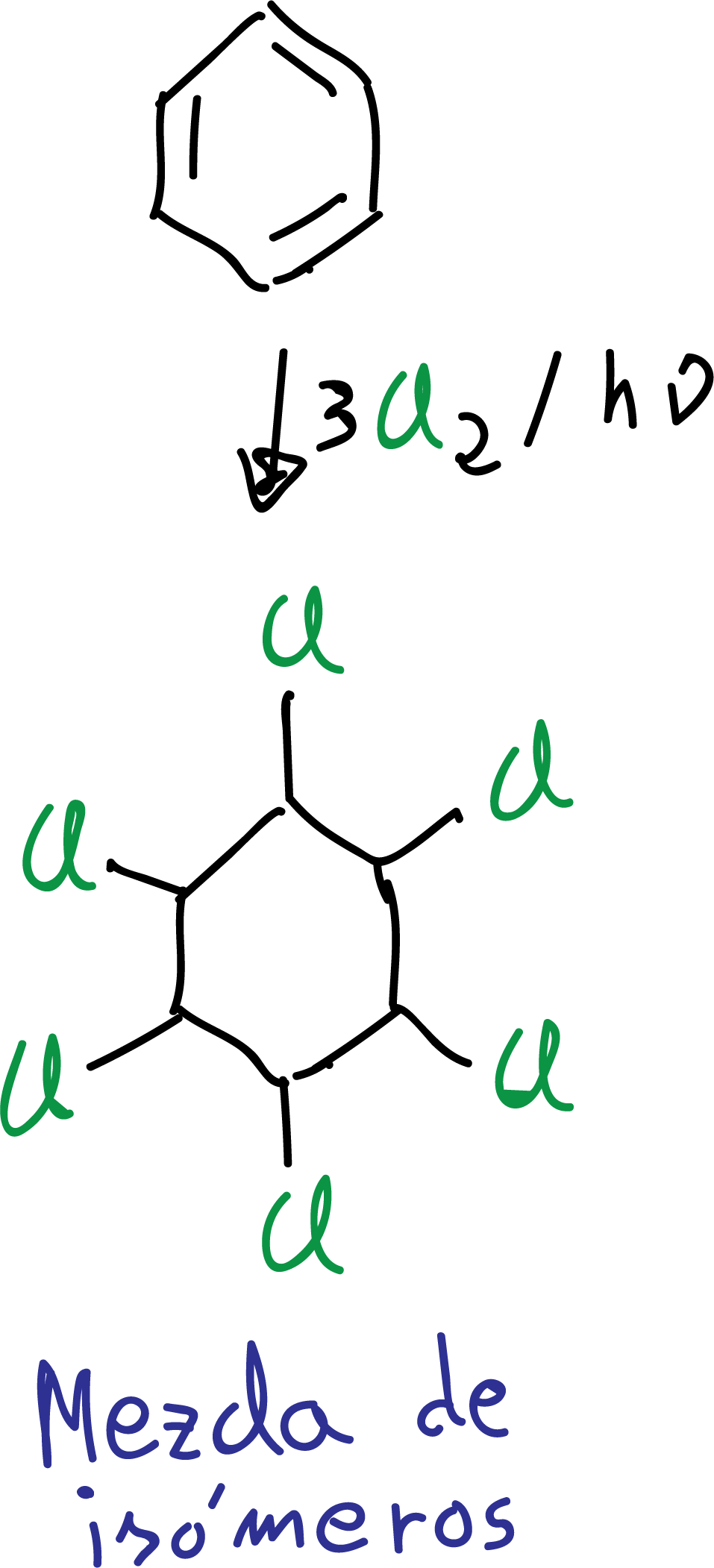
Adición de cloro
El benceno tratado con cloro en presencia de luz ultravioleta conduce a la formación de 1,2,3,4,5,6-hexaclorociclohexano como una mezcla de estereoisómeros.
Reducción de Birch
Permite la preparación de 1,4-ciclohexadienos a partir de arenos. El agente reductor es el sodio, que transfiere un electrón al sistema π del anillo aromático.
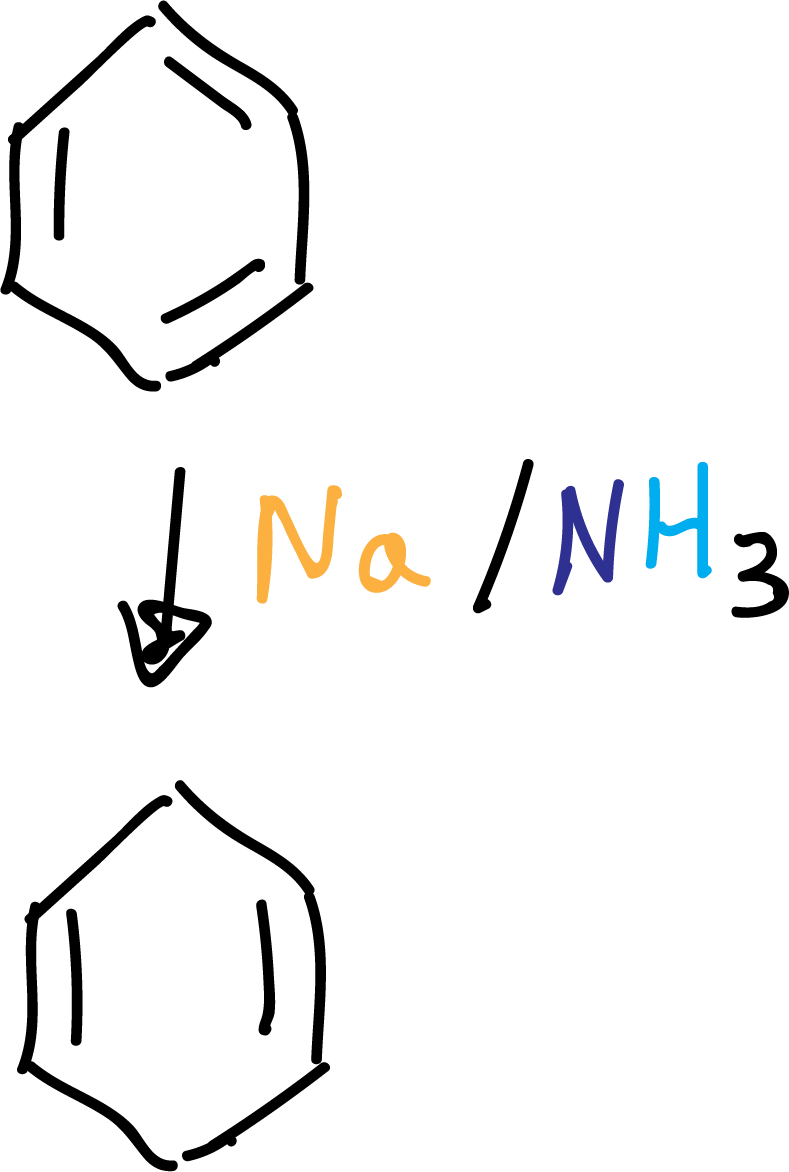
En arenos con sustituyentes que presenten efecto +I se obtienen alquenos más sustituidos.
Volver a la página de Síntesis y Reactividad de Compuestos Orgánicos.
