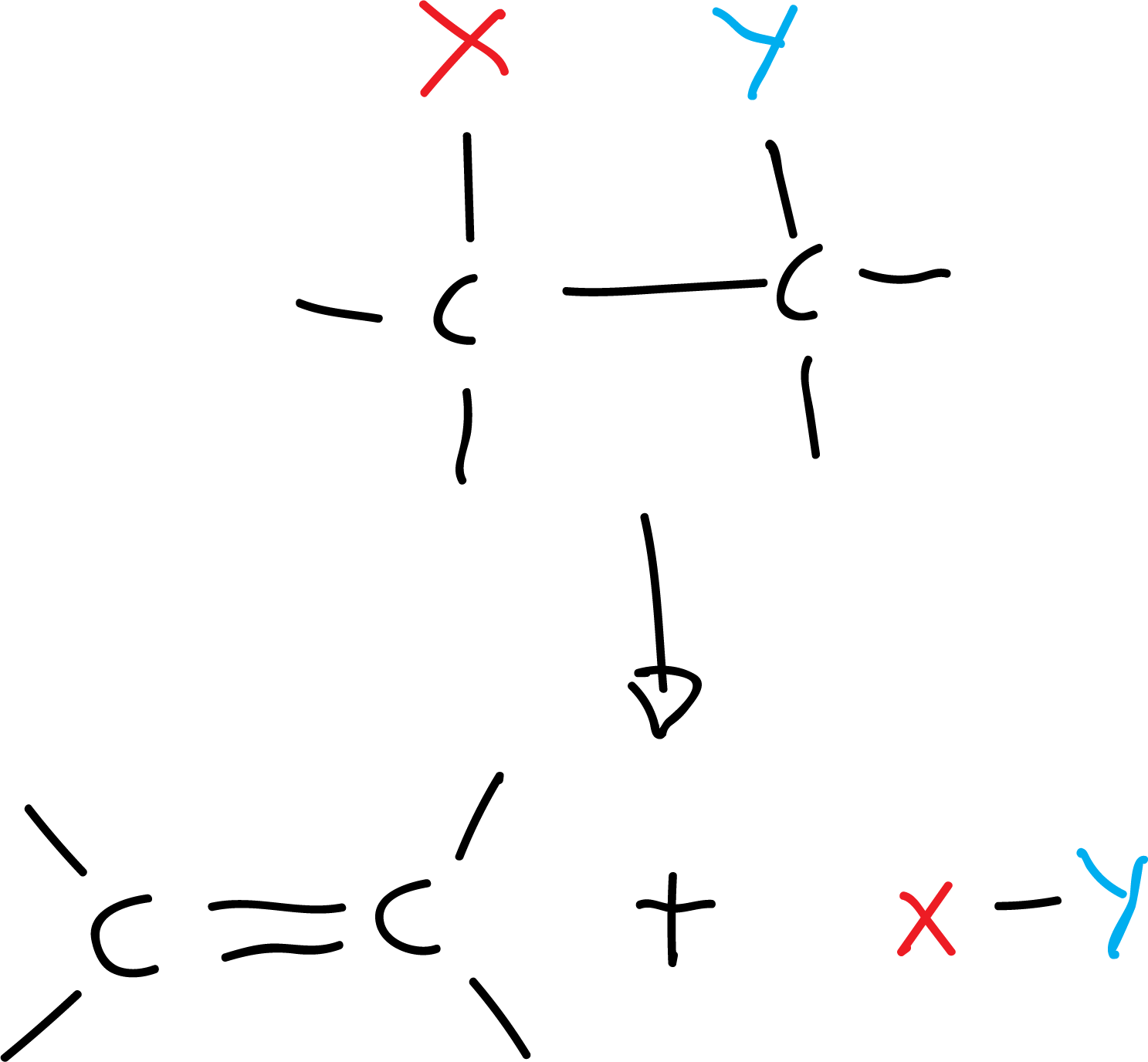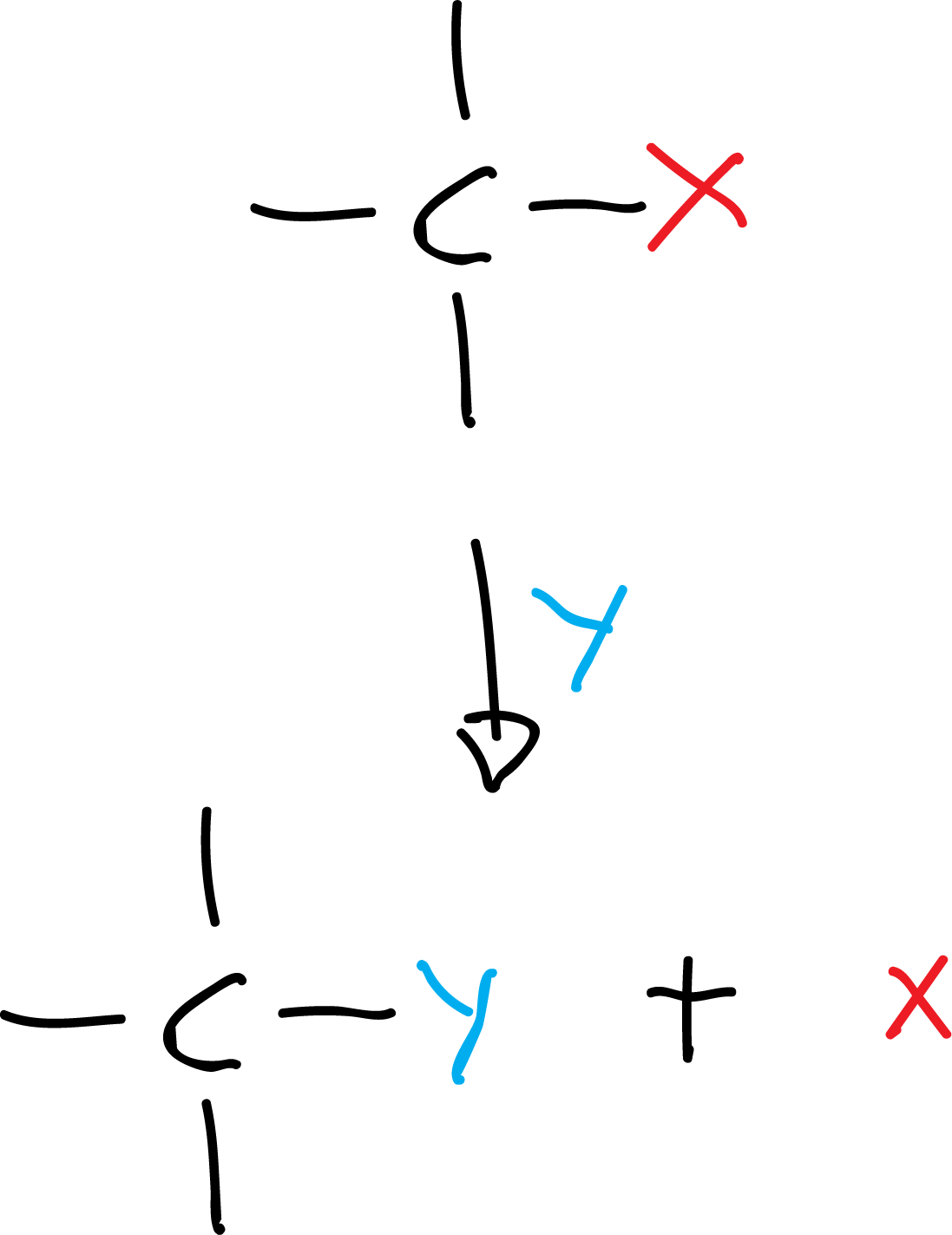Índice
Generalidades
A continuación se definen algunos conceptos básicos para la descripción de los mecanismos de las reacciones orgánicas.
Velocidad de Reacción
La velocidad de reacción es el cambio que experimenta la concentración de un reactivo o producto a lo largo del tiempo, y se expresa con la siguiente ecuación:
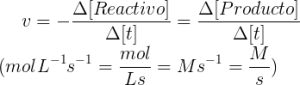
Hay que tener en cuenta el signo menos si lo que se trata es de la velocidad a la que se consume un reactivo, y en el caso de un producto será positivo, ya que se refiere a la velocidad a la que se forma dicho producto.
La ecuación general que describe la velocidad en una reacción sería:
aA +bB → cC + dD
donde a, b, c, y d son los coeficientes estequiométricos de la reacción.
Se puede calcular la velocidad media de la reacción con cualquiera de los componentes de la siguiente manera:
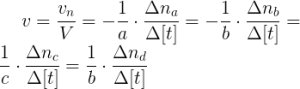
La velocidad media debe ser siempre positiva. Si la reacción transcurre a volumen constante, por ejemplo cuando las especies están todas disueltas, la ecuación se puede expresan mediante concentraciones:
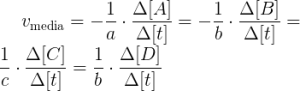
Reactivo nucleófilo y electrófilo
Reactivo nucleofílico (o nucleófilo): especie capaz de donar electrones (base de Lewis), ya que presenta pares de electrones sin compartir, carga negativa, o enlaces múltiples.
Reactivo electrofílico (o electrófilo): especie capaz de aceptar electrones (ácido de Lewis), debido a que tiene carga positiva, o bien carga formal positiva, con orbitales vacíos susceptibles de aceptar electrones.
Hay que tener en cuenta que los conceptos ácido/base de Lewis están relacionados con equilibrios (punto de vista termodinámico) mientras que reactivo nucleófilo/electrófilo son conceptos cinéticos.
Rotura y formación de enlaces
En los compuestos orgánicos las reacciones transcurren mediante rotura y formación de enlaces. Los enlaces se pueden romper o formar de dos modos distintos:
Rotura de enlace homolítica: se produce cuando el enlace covalente se rompe de manera que cada átomo conserva un electrón, generando normalmente radicales (especies químicas con un número impar de electrones).
![]()
Asimismo, la formación de enlaces a partir de radicales se produce al reaccionar dos especies radicalarias que aportan cada una de ellas un electrón al enlace.
![]()
Rotura de enlace heterolítica: cuando la rotura del enlace no es simétrica, uno de los fragmentos conserva los dos electrones del enlace covalente.
Este proceso origina, normalmente, una especie cargada negativamente (la que conserva los dos electrones) y otra cargada positivamente (se indican en la figura por ⊕ y ⊖).
![]()
Asimismo, la formación de enlaces a partir de iones se produce al reaccionar dos especies cargadas, una de ellas aportando el par de electrones y la otra con carga positiva.
![]()
Flechas curvadas: se utilizan en los mecanismos de reacción para indicar el flujo de electrones. Este tipo de flechas curvadas se utiliza sólo para este fin. El origen de la flecha se asocia con los electrones y la punta con el destino de los mismos.
Se utilizan dos tipos de flechas (indicadas en color en las figuras): una de doble punta para indicar el movimiento de un par de electrones, comúnmente asociada a los procesos con rotura y formación de enlaces heterolítica, y otra flecha con una sola punta (tipo anzuelo) para mostrar el movimiento de un único electrón cuando hay rotura o formación de enlace homolítica (por ejemplo, reacciones radicalarias, formación de radicales, etc.).
Mecanismo de una reacción química
Tipos de reacciones químicas
Una reacción química se puede definir como el proceso de interacción entre especies químicas en el que, como consecuencia de la rotura y formación de enlaces, se origina una nueva entidad química.
Las reacciones orgánicas se clasifican según diferentes criterios resultando los seis tipos de reacciones que se indican a continuación:
- Reacción de adición: dos o más moléculas se combinan para formar otra más grande.
Por ejemplo:
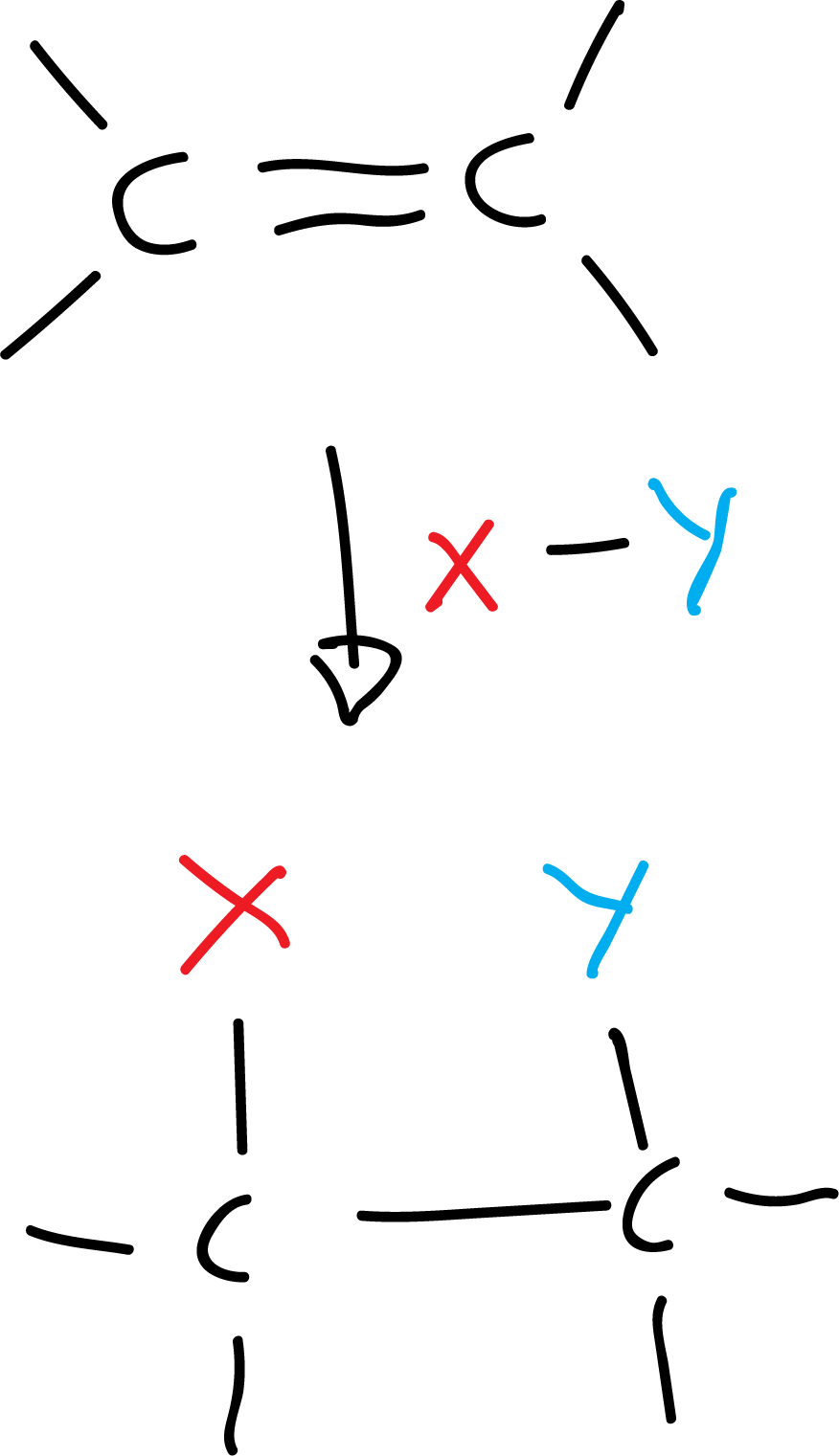
Hay tres tipos de reacciones de adición (nucleófila, electrófila y radicalaria).
- Reacción de eliminación: es el proceso inverso a la reacción de adición y consiste en la pérdida de un átomo (o grupos de átomos) de una molécula, para formar enlaces múltiples o anillos. Puede ocurrir en una o dos etapas. Por ejemplo:
- Reacción de sustitución: consiste en el reemplazo de un átomo (o grupo de átomos) por otro. Por ejemplo:
Hay tres tipos de reacciones de sustitución (nucleófila, electrófila y radicalaria). En las siguientes figuras se ilustra un ejemplo de reacción de sustitución radicalaria y su mecanismo:
fig-7
- Reagrupamiento o transposición: son reordenaciones del esqueleto de una molécula para dar lugar a un isómero estructural de la molécula de partida. Por ejemplo:
fig-8
- Reacciones pericíclicas: transcurren de una manera concertada (los enlaces se rompen y se forman al mismo tiempo) a través de un estado de transición cíclico.
fig-9
- Reacciones redox (oxidación y reducción): Son reacciones en las que se produce un cambio en el número de oxidación de algunos átomos en los reactivos. No son, en el sentido más estricto, un tipo nuevo de reacciones, sino más bien cambios que pueden acompañar a los otros tipos de reacciones descritas. Por ejemplo:
fig-10
La reacciones de oxidación pueden identificarse en muchos casos por la ganancia de oxígeno y halógenos y/o la pérdida de hidrógeno en la molécula de partida, mientras que las reacciones de reducción suelen llevar asociadas la pérdida de oxígeno o halógeno y/o la ganancia de hidrógeno sobre el sustrato de partida (véase número de oxidación).
Rendimiento de una reacción química
Antes de calcular el rendimiento de una reacción es necesario conocer la estequiometría (el ajuste de la reacción química de manera que haya el mismo número y tipo de átomos en los reactivos que en los productos) que presenta la reacción y saber cuál es el reactivo limitante (aquel que expresado en mol está en una menor cantidad según la estequiometría).
Rendimiento de una reacción sencilla: cantidad de producto obtenido en una reacción química. Se expresa como rendimiento relativo (en tanto por ciento, %), y resulta de dividir los moles obtenidos de producto entre los moles teóricos de producto(cantidad máxima que se obtendría de producto si reaccionase toda la cantidad de reactivo limitante). Para su cálculo hay que tener en cuenta el reactivo limitante y la estequiometría de la reacción.
A → B
Rendimiento (%) = [(mol obtenido de producto) / (mol teórico de producto)]×100
Rendimiento de una transformación que consta de varias reacciones: el rendimiento global de una transformación que transcurre con varias reacciones químicas se calcula multiplicando los rendimientos parciales (expresados en tanto por uno) de cada una de las reacciones de que consta.
A → B → C → D → etc.
Rendimiento global (%) = (rendimiento 1ª reacción × rendimiento 2ª reacción × rendimiento 3ª reacción, … etc) × 100
Por ejemplo: una transformación química consta de 3 reacciones y los rendimientos parciales de cada una de ellas son del 25%, 50% y 75% para calcular el rendimiento global se aplica la ecuación anterior (expresando los rendimientos parciales en tanto por uno) y nos quedaría:
Rendimiento global (%) = 0,25 × 0,50 × 0,75 × = 9,4%
Termodinámica y cinética química
La termodinámica estudia básicamente los cambios de energía asociados a los procesos de equilibrio y su evolución en las reacciones químicas.
Constante de equilibrio (Keq): gobierna las concentraciones de reactivos y productos en el equilibrio. Por ejemplo:
fig-11
A partir de la Keq se puede calcular el cambio de energía libre (ΔG) de una reacción. Se expresa mediante la ecuación (ΔG = Gproductos – Greactivos). Se suele utilizar el cambio de energía libre de Gibbs (ΔGº), cuando los reactivos y productos están en sus estados estándar (25 ºC y 1 atm). La relación entre ΔGº y Keq viene dada por la siguiente ecuación (ΔGº = –RT log Keq), donde R= 1,99·10-3 kcal·kelvin-1·mol-1; T = temperatura absoluta en kelvin. RT a 25 ºC = 0,593 kcal· mol-1.
Las reacciones con valores altos de Keq están favorecidas, si presentan ΔGº negativo (se libera energía). Sin embargo, si presentan valores positivos de ΔGº estarán desfavorecidas y por tanto, es necesario suministrar energía al sistema para que tenga lugar dicha reacción. Además, ΔGº es función de la entalpía (ΔHº), que es el calor desprendido o consumido en una reacción química, de la entropía (ΔSº), que mide la libertad de movimiento del sistema, y de la temperatura (T) según la ecuación:
ΔGº = ΔHº – T·ΔSº
Normalmente, la entalpía gobierna la reacción química, siendo la contribución del cambio de entropía por la temperatura despreciable. El cambio de entalpía es una medida de la fuerza de los enlaces de los reactivos y productos. Las reacciones tienden a favorecer los productos con menor entalpía (enlaces más fuertes). Si se rompen enlaces más débiles y se forman otros más fuertes se desprende calor en la reacción y se dice que es exotérmica (ΔHº negativo). Sin embargo, si se rompen los enlaces más fuertes y se forman los más débiles, entonces se consume energía siendo la reacción endotérmica (ΔHº positivo).
Se puede calcular, de forma aproximada, el valor de la entalpía de reacción a partir de valores tabulados de energía de disociación de enlaces (véase Tabla 1). Cuando se forman enlaces se desprende energía, mientras que para que se rompan se requiere energía.
| Enlace | ΔHº |
| H-H | 104 |
| H-F | 138 |
| H-Cl | 103 |
| H-Br | 88 |
| CH3-H | 105 |
| CH3-F | 110 |
| CH3-Cl | 85 |
| CH3-Br | 71 |
| CH3CH2-H | 98 |
| CH3CH2–F | 107 |
| CH3CH2–Cl | 80 |
| CH3CH2–Br | 68 |
| CH3CH2CH2-H | 98 |
| CH3CH2CH2–F | 107 |
| CH3CH2CH2–Cl | 81 |
| CH3CH2CH2–Br | 68 |
| (CH3)2CH2-H | 95 |
| (CH3)2CH2–F | 106 |
| (CH3)2CH2–Cl | 81 |
| (CH3)2CH2–Br | 68 |
| (CH3)3C-H | 93 |
| (CH3)3C-F | 110 |
| (CH3)3C-Cl | 81 |
| (CH3)3C-Br | 67 |
| F-F | 38 |
| Cl-Cl | 58 |
| Br-Br | 46 |
Ejemplo: la entalpía de fluoración del etano se calcula a partir de los valores de energías de disociación de enlaces de la siguiente forma:
fig-12
se hace un recuento de los enlaces que se forman o se rompen en dicho proceso, en este caso se rompe un enlace F-F (+38) y otro C-H (+98) y se forma uno H-F (-138) y otro C-F (-107). Por tanto, el balance total de entalpía se calcula de la siguiente forma: ΔHº =(+38+98) + (-138-107) = +136 + (-245) = –109 kcal·mol-1 y la reacción es exotérmica.
La cinética estudia la velocidad de las reacciones químicas. La velocidad de una reacción se determina midiendo las concentraciones de los productos y reactivos a través del tiempo. La forma en que depende de las concentraciones de reactivos y productos se denomina ecuación de velocidad. Cada reacción tiene su propia ecuación de velocidad que hay que determinar experimentalmente.
Por ejemplo: en la reacción de fluoración del etano la velocidad de la reacción viene expresada por:
v = k [CH3CH3]·[F2]
se dice que es de primer orden con respecto a cada uno de los reactivos, porque es proporcional a la primera potencia de sus concentraciones. Además, es de segundo orden general porque es la suma de las dos potencias de las concentraciones. Dicha ecuación hay que determinarla experimental-mente y no se puede predecir a partir de la estequiometría de la reacción, aunque a veces coincida.
La ecuación de Arrhenius expresa la dependencia de la constante de velocidad (característica de cada reacción) con las condiciones de reacción.
K = A·e–Ea/RT
donde, A es una constante. (factor preexponencial), Ea es la energía de activación , R es la constante de los gases 1,99·10-3kcal·kelvin-1·mol-1 y T la temperatura absoluta.
Los conceptos anteriores se entienden mejor de forma gráfica mediante diagramas de reacción que relacionan la energía que se pone en juego en un proceso químico para pasar de los reactivos a los productos con alguna magnitud que indique que efectivamente la reacción tiene lugar (variaciones en la concentración, longitud de un enlace, etc.):
fig-13
En la figura anterior, se ilustra un perfil de energía genérico para dos reacciones, una exotérmica y la otra endotérmica. El eje vertical indica la energía potencial total de todas las especies químicas implicadas en la reacción. El eje horizontal es la coordenada de reacción y representa el progreso de dicha reacción, a la izquierda estarían situados los reactivos y a la derecha los productos. El estado de transición (ET) es el punto máximo de la gráfica, y se sitúa, lógicamente, entre los reactivos y productos. La energía de activación (Ea) es la diferencia de energías entre el estado de transición y los reactivos. ΔHº es la diferencia entre la energía de los reactivos y productos.
El postulado de Hammond–Leffer dice que en el perfil de energía para una reacción química exotérmica, el estado de transición estará cercano a los reactivos (estructuras y energías similares). Por el contrario, para reacciones endotérmicas, el estado de transición estará próximo a los productos.
Intermedios de una reacción química
Son especies con un tiempo de vida media muy corto, y que no están presentes en altas concentraciones, debido a que evolucionan rápidamente. Gráficamente, se identifican como mínimos relativos de energía en la coordenada de reacción.
En Química Orgánica, los intermedios de reacción más comunes son las especies con carbonos trivalentes y según su carga se denominan:
fig-15
Carbocationes: especies químicas cargadas positivamente (el carbono con la carga positiva presenta todos los electrones de valencia formando enlaces). La estabilidad aumenta con el grado de sustitución del carbono trigonal, ya que los grupos alquilo ceden ligeramente electrones, estabilizando el carbocatión (efecto inductivo).
Presentan una estructura trigonal plana en el carbono con hibridación sp2.
fig-16
Radicales (o radicales libres): especies químicas neutras, en las que el carbono trivalente presenta un electrón sin compartir. El carbono presenta hibridación sp2, con un electrón sin compartir en un orbital p. Al igual que los carbocationes son especies deficientes en electrones y la estabilidad aumenta con el grado de sustitución.
fig-17
Carbaniones: especies químicas con carga negativa, en las que el átomo de carbono trivalente presenta un par de electrones sin compartir. A diferencia de los casos anteriores el carbono presenta una hibridación sp3, con disposición piramidal de los sustituyentes.
fig-18
Carbenos: especies químicas sin carga pero con un átomo de carbono divalente, que presenta dos electrones sin compartir. El más sencillo de la especie es :CH2 y se denomina metileno. El carbono presenta una hibridación sp2; dependiendo de cómo estén situados los electrones se puede hablar de metileno singlete o triplete.
fig-19
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.