Written by José | Last Updated on 2 meses
Objetivos
Para producir un compuesto β-dicarbonílico, en este caso la 2-acetilciclohexanona a partir de ciclohexanona, usando una enamina como intermedio sintético.
Índice
Antecedentes
Los compuestos organometálicos y los carbaniones no son las únicas especies utilizadas en síntesis orgánica con átomos de carbono nucleofílicos.
El carbono en la posición β de una enamina tiene un carácter nucleófilo y puede alquilarse o acilarse con un reactivo electrófilo apropiado.
Esta reactividad de enaminas, que se puede preparar fácilmente a partir de compuestos de carbonilo, se debe a la reubicación del par de electrones no enlazantes del nitrógeno a través del doble enlace de carbono en la posición β. La alquilación o acilación de una enamina conduce a la formación de un ion iminio, que por hidrólisis regenera el compuesto carbonílico.
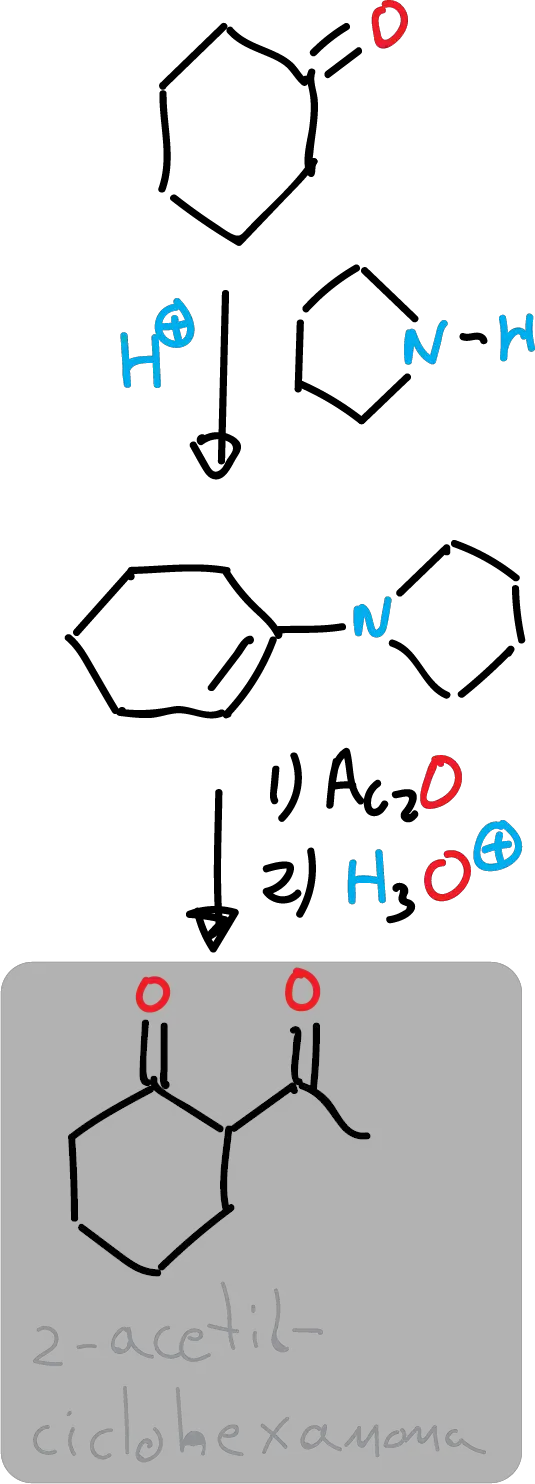
En este experimento, se acetila la ciclohexanona a través de pirrolidinamina. En un primer paso, la ciclohexanona se convierte en la enamina correspondiente por reacción con pirrolidina en presencia de un ácido como catalizador. La reacción se lleva a cabo en tolueno y a reflujo usando un aparato Dean-Stark para eliminar el agua formada dentro de la reacción.
La enamina producida no se aísla sino que se hace reaccionar inmediatamente con anhídrido acético para producir la acetilación correspondiente. El tratamiento con agua del material de partida produce una hidrólisis a 2-acetilciclohexanona. En un paso final, el crudo de reacción se purifica mediante destilación a vacío. El compuesto generado existe como una mezcla de formas ceto y enol, y el porcentaje de cada tautómero puede estimarse mediante 1H-NMR.
Procedimiento experimental
Se añaden 40 ml de tolueno, 5 ml de ciclohexanona, 4 ml de pirrolidina y 0.1 g de ácido p-toluensulfónico a un matraz de fondo redondo de 100 ml. Se conecta el matraz a un aparato Dean-Stark y éste a su vez a un condensador de reflujo con una torre de desecante. La mezcla se calienta a reflujo durante 1 hora y luego se deja enfriar a temperatura ambienta.
El montaje se modifica para llevar a cabo una destilación azeotrópica (para eliminar la pirrolidina y el agua que puedan quedar) hasta un máximo de 108-110 ºC. En este punto, retire la fuente de calor y deje que el matraz se enfríe a temperatura ambiente. Retirar el equipo de destilación y agregar una solución de 4.5 ml de anhídrido acético en 10 ml de tolueno. Ponga esto en el tapón del matraz y deje que la mezcla repose a temperatura ambiente durante al menos 24 h.
Después, vierta lentamente 5 ml de agua sobre el crudo de reacción y caliente la mezcla a reflujo durante 30 min. El crudo de reacción se deja enfriar a temperatura ambiente y se transfiere a un embudo de decantación de 50 ml con 10 ml de agua, separando las dos fases.
Se lava la fase orgánica sucesivamente con HCl 3 M (3 x 10 ml) y agua (10 ml), y se transfiere a un Erlenmeyer. Seguidamente se seca sobre sulfato sódico anhidro. Finalmente, se elimina el disolvente en un rotavapor, y se transfiere el residuo a un aparato de destilación a vacío de tamaño apropiado y se destila a presión reducida usando una bomba de agua (o una bomba que haga un vacío de aproximadamente 15 mm Hg). El destilado así obtenido, se pesa y se calcula el rendimiento.
Propiedades físico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| 2-Acetilciclohexanona | 140.18 | - | 111-112 | 1.078 |
| Anhídrido acético | 102.09 | -73.1 | 139.8 | 1.080 |
| Ciclohexanona | 98.14 | -47 | 155 | 0.947 |
| H2SO4 | 98.08 | 3 | - | 1.80-1.84 |
| HCl | 36.46 | -30 | >100 | 1.200 |
| Na2SO4 | 142.04 | 884 | - | 2.630 |
| Ácido p-Toluenosulfónico | 172.2 | 106-107 | - | 1.240 |
| Pirrolidina | 71.12 | -60 | 87-88 | - |
| Tolueno | 92.14 | -93 | 110.6 | 0.867 |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| 2-Acetilciclohexanona | No peligroso |
| Anhídrido acético |    |
| Ciclohexanona |    |
| H2SO4 |  |
| HCl |   |
| Na2SO4 | No peligroso |
| Ácido p-Toluenosulfónico |   |
| Pirrolidina |    |
| Tolueno |    |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| 2-Acetilciclohexanona | OEKATORRSPXJHE-UHFFFAOYSA-N |
| Anhídrido acético | WFDIJRYMOXRFFG-UHFFFAOYSA-N |
| Ciclohexanona | JHIVVAPYMSGYDF-UHFFFAOYSA-N |
| H2SO4 | QAOWNCQODCNURD-UHFFFAOYSA-N |
| HCl | VEXZGXHMUGYJMC-UHFFFAOYSA-N |
| Na2SO4 | PMZURENOXWZQFD-UHFFFAOYSA-L |
| Ácido p-Toluenosulfónico | JOXIMZWYDAKGHI-UHFFFAOYSA-N |
| Pirrolidina | RWRDLPDLKQPQOW-UHFFFAOYSA-N |
| Tolueno | YXFVVABEGXRONW-UHFFFAOYSA-N |
Volver a la página de prácticas de Síntesis Orgánica Avanzada.

