Tabla de contenidos
Objetivo
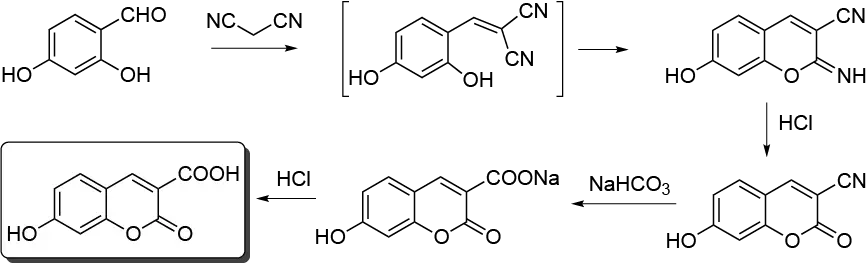
Síntesis de 7-hidroxi-3-carboxicumarina en agua mediante una reacción en tándem (condensación de Knoevenagel y reacción de Pinner).
Antecedentes
La reacción de Knoevenagel es una condensación entre un aldehído o una cetona con un compuesto de hidrógeno activo en presencia de un catalizador básico para producir compuestos α,β-insaturados. Por lo general, el catalizador es una amina débilmente básica, y el compuesto de hidrógeno activo lleva grupos que retiran electrones como:
CO2R, COR, CHO, CN o NO2
La reacción suele realizarse en disolventes orgánicos apróticos como DMF, MeCN o piridina, que desempeñan el doble papel de disolvente y catalizador. La investigación sobre este método de formación carbono-carbono sigue buscando nuevos catalizadores y condiciones de reacción de acuerdo con estrategias de Química Verde como la irradiación por microondas y ultrasonidos, las condiciones sin disolventes, la síntesis en fase sólida o el uso de agua como disolvente barato y respetuoso con el medio ambiente.
En este experimento, la 7-hidroxi-3-carboxicumarina se prepara mediante un proceso consecutivo de un solo paso en agua utilizando materiales de partida 2,4-dihidroxibenzaldehído y malononitrilo. En el primer paso, tiene lugar una condensación de Knoevenagel, para producir un derivado intermedio de imina que se hidroliza in situ para dar el producto final (reacción de Pinner).
El procedimiento pone de manifiesto las ventajas de utilizar agua, con la posibilidad de controlar el pH y aislar el producto de reacción sin utilizar ningún disolvente orgánico. El sistema de anillos cumarínicos está presente en muchos productos naturales con propiedades farmacológicas útiles, por ejemplo, como antitumoral, como agente contra el VIH o con efectos sobre el sistema nervioso central.
Procedimiento experimental
Bajo una campana de humos bien ventilada, se agitan enérgicamente 2,4-dihidroxi-benzaldehído (1,38 g, 10 mmol), malononitrilo (0,80 g, 12,5 mmol) y solución acuosa 0,05 M de NaHCO3 (50 ml) durante 1,5 h a t.r. en un matraz de fondo redondo de 100 ml provisto de imán y refrigerante de reflujo. A continuación se añade HCl concentrado (1,25 ml), se calienta la mezcla heterogénea y se agita durante 1 h a 90 ºC. Tras enfriar la mezcla, se añade solución acuosa 1 M de NaHCO3 (20 ml) y se calienta de nuevo la mezcla durante 2 h a 90 ºC sin dejar de agitar. La sal sódica de la 7-hidroxi-3-carboxicumarina es soluble en agua. Acidificar la solución final, enfriada a temperatura ambiente, agitar con HCl concentrado hasta pH = 2,0, y refrigerar a 0-5 ºC. Separar el precipitado 7-hidroxi-3 carboxicumarina del medio acuoso por filtración a vacío utilizando un embudo Büchner y secar (1,75 g, rendimiento 85 %). La cumarina así obtenida tiene una pureza superior al 98 % y puede purificarse aún más por recristalización de H2O/AcOH 8:2; p.f. = 248-250 ºC.
El proceso puede detenerse tras la condensación de Knoevenagel y la reacción de Pinner (1,5 h) o tras la hidrólisis del derivado imino (2,5 h) para producir 7-hidroxi-3-ciano-2-iminocumarina (p.f. = 250 ºC de DMF/H2O 9:1) y 7-hidroxi-3-cianocumarina (p.f. = 273-275 ºC de H2O/AcOH 9:1), respectivamente, con alto rendimiento y pureza (>95 %) por filtración al vacío de la fase acuosa. Estos pueden ser puntos de parada adecuados para dos o tres sesiones de laboratorio. En este caso, la mezcla acuosa de reacción se almacena a temperatura ambiente y las reacciones posteriores se llevan a cabo al día siguiente.
Propiedades físico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| Ácido acético | 60.05 | 16.2 | 118 | 1.049 |
| HCl | 36.46 | -30 | >100 | 1.200 |
| Malononitrilo | 66.06 | 30-32 | 220 | 1.049 |
| NaHCO3 | 84.01 | 300 | - | 2.160 |
| 2,4-Dihidroxibenzaldehído | 138.12 | 135-137 | 220-228 | - |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| Ácido acético |   |
| HCl |   |
| Malononitrilo |   |
| NaHCO3 | No peligroso |
| 2,4-Dihidroxibenzaldehído |  |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| Ácido acético | QTBSBXVTEAMEQO-UHFFFAOYSA-N |
| HCl | VEXZGXHMUGYJMC-UHFFFAOYSA-N |
| Malononitrilo | CUONGYYJJVDODC-UHFFFAOYSA-N |
| NaHCO3 | UIIMBOGNXHQVGW-UHFFFAOYSA-M |
| 2,4-Dihidroxibenzaldehído | IUNJCFABHJZSKB-UHFFFAOYSA-N |
