Written by José | Last Updated on 2 meses
Objetivo
La síntesis de isopropiliden-α-D-glucofuranosa, se aborda para familiarizar al alumno con algunas de las reacciones más comunes de protección de grupos funcionales en la química de carbohidratos. Esto es, la protección de los grupos hidroxilo.
Índice
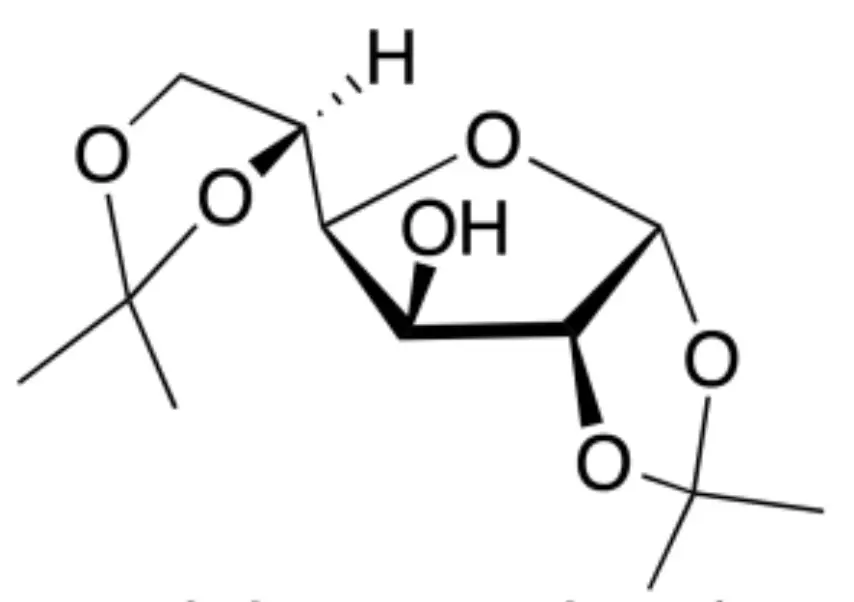 |
| Estructura 3D |
Antecedentes
Los carbohidratos son compuestos que se caracterizan por tener varios grupos hidroxilo que dan reacciones características de alcoholes. El paso clave para la síntesis de carbohidratos es la funcionalización selectiva de los diferentes hidroxilos, con el fin de poder llevar a cabo diferentes reacciones sobre cada uno de ellos.
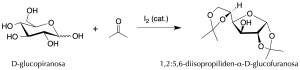
Por ejemplo, la acetona reacciona con dioles para formar acetales. Sin embargo, en la reacción con D-glucosa catalizada por yodo es posible controlar las condiciones para que se formen únicamente los acetales primario y anomérico.
Procedimiento experimental
Para conseguir la síntesis de isopropiliden-α-D-glucofuranosa, se disuelven 1.5 g de yodo y 5 g de glucosa en 250 ml de acetona anhidra. Seguidamente, la mezcla, colocada en un matraz de fondo redondo, se calienta a reflujo durante 2 h. Al cabo de dicho tiempo, se deja enfriar la mezcla a temperatura ambiente.
Al crudo de reacción frío, se añade una disolución acuosa saturada de tiosulfato de sodio hasta conseguir decoloración total. La disolución resultante se concentra parcialmente en el rotavapor hasta obtener una tercera o cuarta parte del volumen de partida.
Se deja enfriar la disolución y se añaden 100 ml de agua y 50 ml de cloroformo. La mezcla resultante se transfiere a un embudo de decantación y se separa la fase orgánica (que se guarda). La fase acuosa se extrae dos veces con 50 ml de cloroformo.
Se juntan los tres extractos orgánicos, se secan con sulfato sódico anhidro, se filtra y el filtrado se trasvasa a un matraz de fondo redondo y se evapora a sequedad en el rotavapor. El sólido blanco que se obtiene es la 1,2:5,6-di-O-isopropiliden-α-D-glucofuranosa.
Propiedades físico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| 1,2,5,6-Di-O-isopropilideno-α-D-glucofuranosa | 260.28 | 109-113 | - | - |
| Acetona | 58.08 | -94 | 56 | 0.791 |
| Cloroformo | 119.38 | -63 | 60.5-61.5 | 1.492 |
| 3-metil-butan-1-ol | 88.15 | -117 | 131-132 | - |
| H2SO4 | 98.08 | 3 | - | 1.80-1.84 |
| Yodo I2 | 253.81 | 113 | 184 | 4.930 |
| 1H-Pirrol | 67.09 | -23 | 131 | 0.967 |
| Na2SO4 | 142.04 | 884 | - | 2.630 |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| 1,2,5,6-Di-O-isopropilideno-α-D-glucofuranosa | No peligroso |
| Acetona |   |
| Cloroformo |   |
| 3-metil-butan-1-ol |   |
| H2SO4 |  |
| Yodo I2 |   |
| 1H-Pirrol |    |
| Na2SO4 | No peligroso |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| 1,2,5,6-Di-O-isopropilideno-α-D-glucofuranosa | KEJGAYKWRDILTF-HOTMZDKISA-N |
| Acetona | CSCPPACGZOOCGX-UHFFFAOYSA-N |
| Cloroformo | HEDRZPFGACZZDS-UHFFFAOYSA-N |
| 3-metil-butan-1-ol | PHTQWCKDNZKARW-UHFFFAOYSA-N |
| H2SO4 | QAOWNCQODCNURD-UHFFFAOYSA-N |
| Yodo I2 | PNDPGZBMCMUPRI-UHFFFAOYSA-N |
| 1H-Pirrol | KAESVJOAVNADME-UHFFFAOYSA-N |
| Na2SO4 | PMZURENOXWZQFD-UHFFFAOYSA-L |
Volver a la página de prácticas de Síntesis Orgánica Avanzada.

