Written by J.A. Dobado | Last Updated on 1 año
Ir a la página con el listado de problemas.
Síntesis Orgánica – soluciones a los problemas
Las soluciones de estos problemas de Síntesis Orgánica no son únicas ni excluyentes, las que se indican son unas de las posibles.
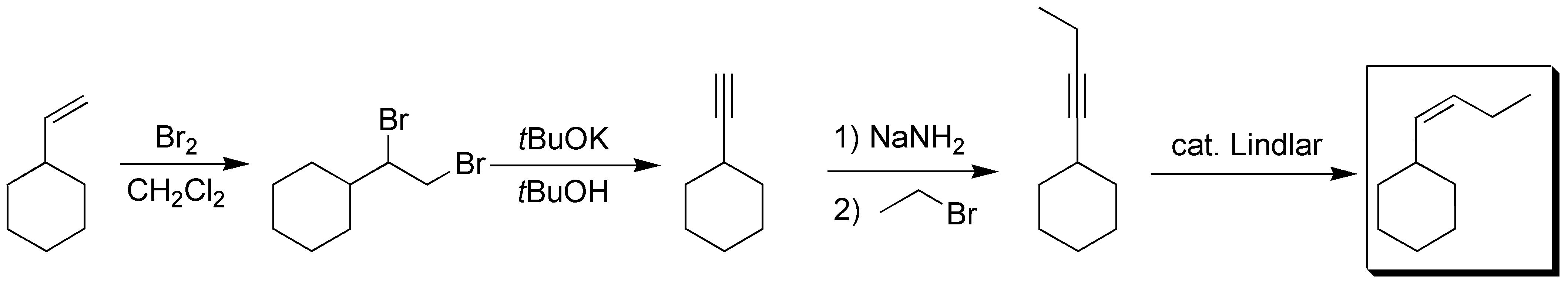
Solución 1:
La clave de esta síntesis está en la elongación de la cadena, para ello la estrategia elegida es la conversión del alqueno en alquino a través del dibromo derivado, transformación en el acetiluro, sustitución nucleofílica de un haloalcano e hidrogenación con catalizador de Lindlar para dar el alqueno con la estereoquímica adecuada:
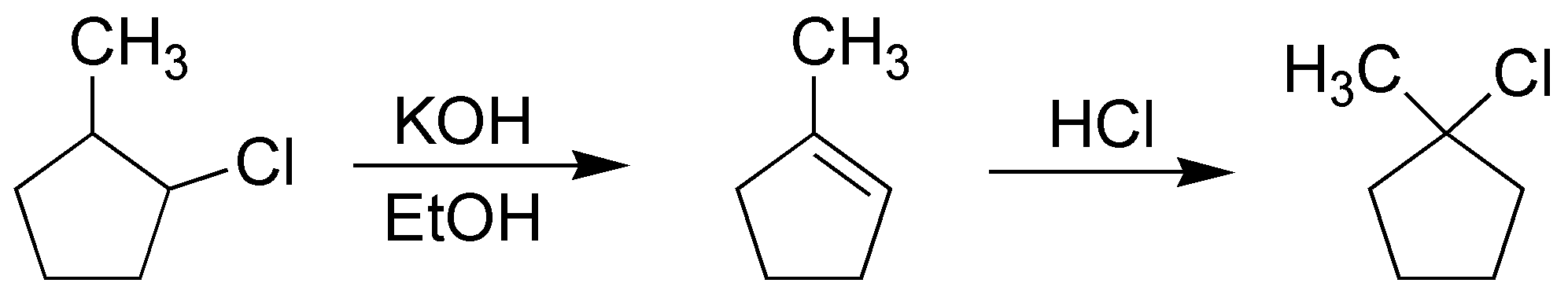
Solución 2:
La manera más rápida y cómoda de convertir el 2-metilclorociclopentano en 1-metilclorociclopentano es a través del alqueno:
Solución 3:
Para poder conseguir que el grupo cetónico se transforme en en alqueno (reacción de Wittig) debemos proteger el grupo aldehído lo que hacemos mediante reacción de acetalación. Una vez protegido, si podemos utilizar la reacción de Wittig y posteriormente desproteger el acetal:
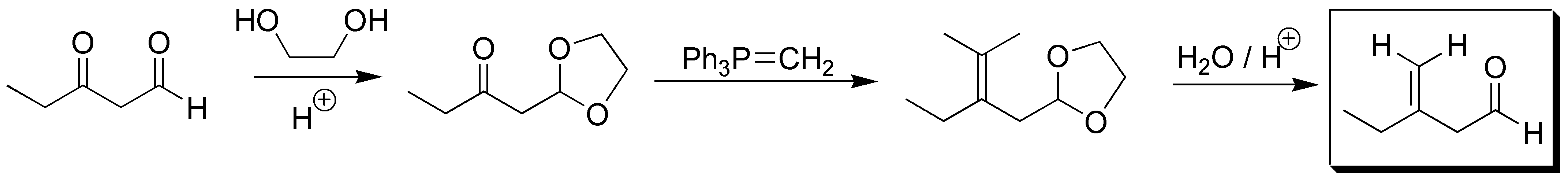
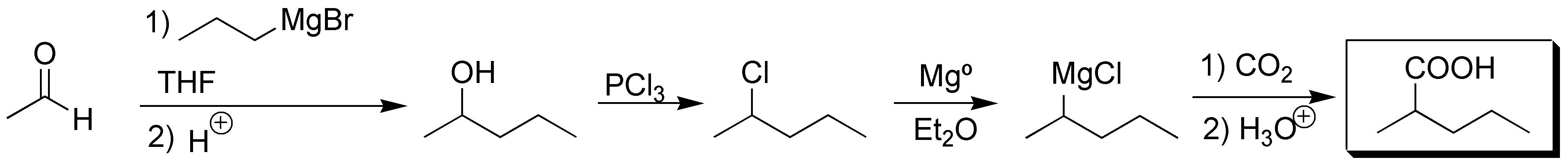
Solución 4:
Primero procedemos a alargar la cadena mediante una reacción de Grignard, convertimos el alcohol obtenido en un nuevo magnesiano, previa conversión en haloalcano. La carboxilación de este produce el correspondiente ácido carboxílico:
Solución 5:
La ozonólisis del producto de partida da el correspondiente dialdehído que por reacción de Wittig con el correspondiente iluro de fósforo obtenemos el producto deseado:
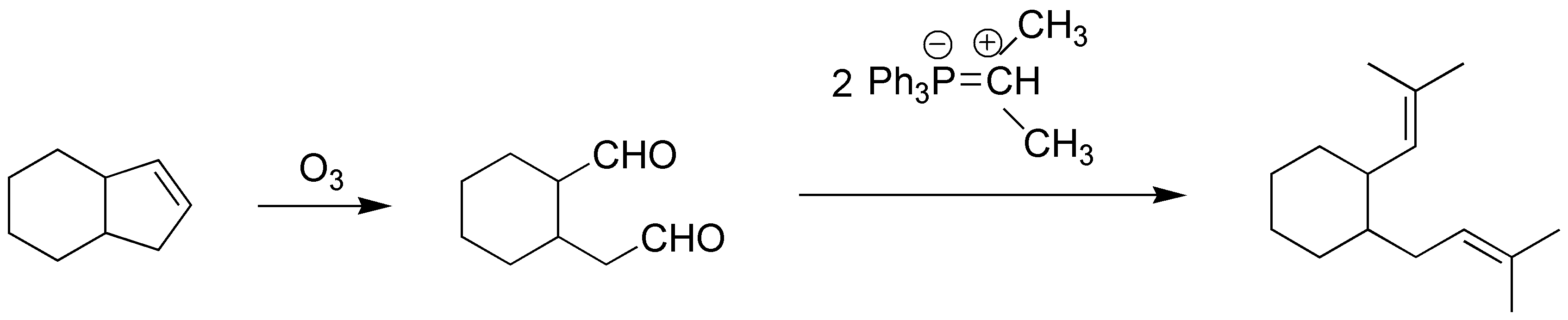
Solución 6:
El 1-propanol se convierte en 2-bromopropano a través del propeno. Este es convertido en un iluro de fósforo por tratamiento con trifenilfosfina y base. La reacción con propanona da el alqueno esperado:
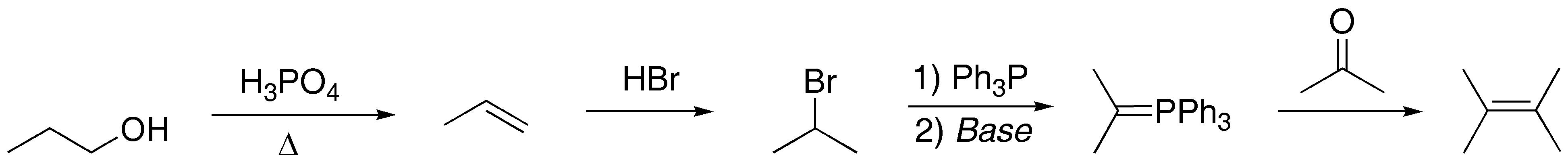
Solución 7:
La oxidación de la cadena alquílica de un derivado aromático conduce al correspondiente ácido carboxílico independientemente de la longitud de la cadena. La reducción del ácido con LiAlH4 produce el correspondiente alcohol.
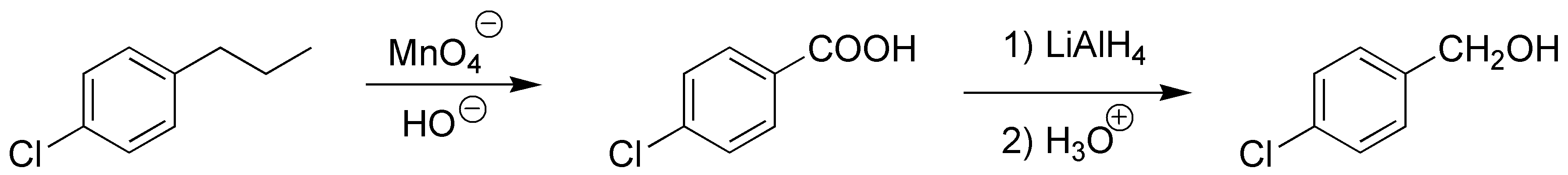
Solución 8:
La conversión de un alqueno en aldehído sin degradación se puede producir fácilmente previa conversión del alqueno en alquino y posterior hidratación anti-Markovnikov de dicho alquino.
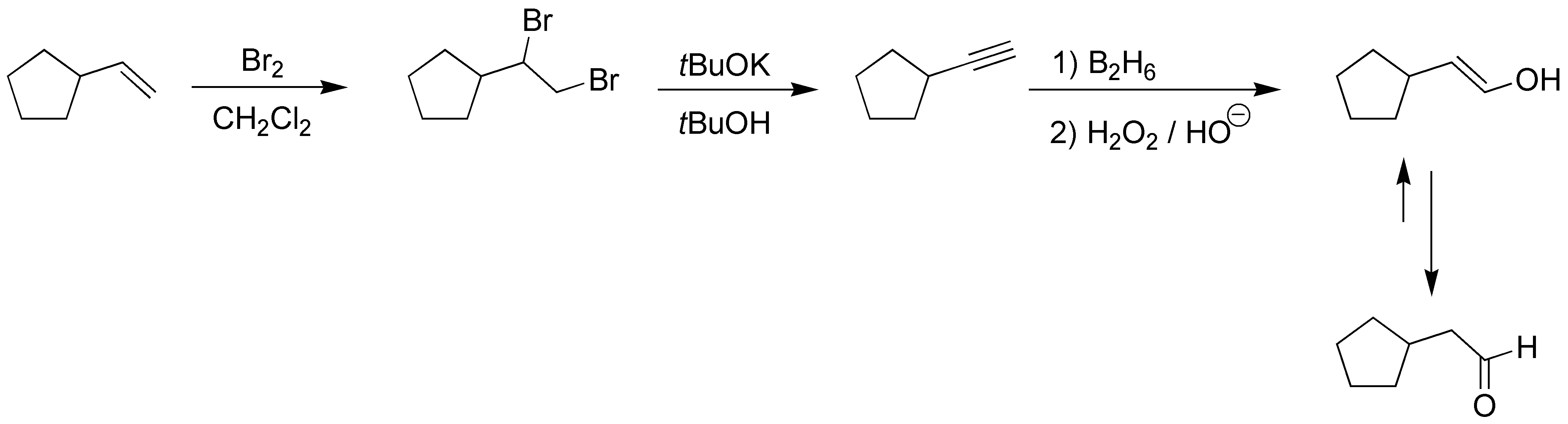
Solución 9:
Para proceder a la elongación de la cadena de la hidroxicetona por el grupo hidroxilo debemos proteger primero el grupo carbonilo mediante un cetal cíclico. Una vez formado este, procedemos a la oxidación del hidroxilo hasta aldehído con PCC en ausencia de agua, y posterior reacción de Wittig con el iluro adecuado da un alqueno. Finalmente desprotegemos el grupo cetal mediante hidrólisis ácida dando la cetona deseada.
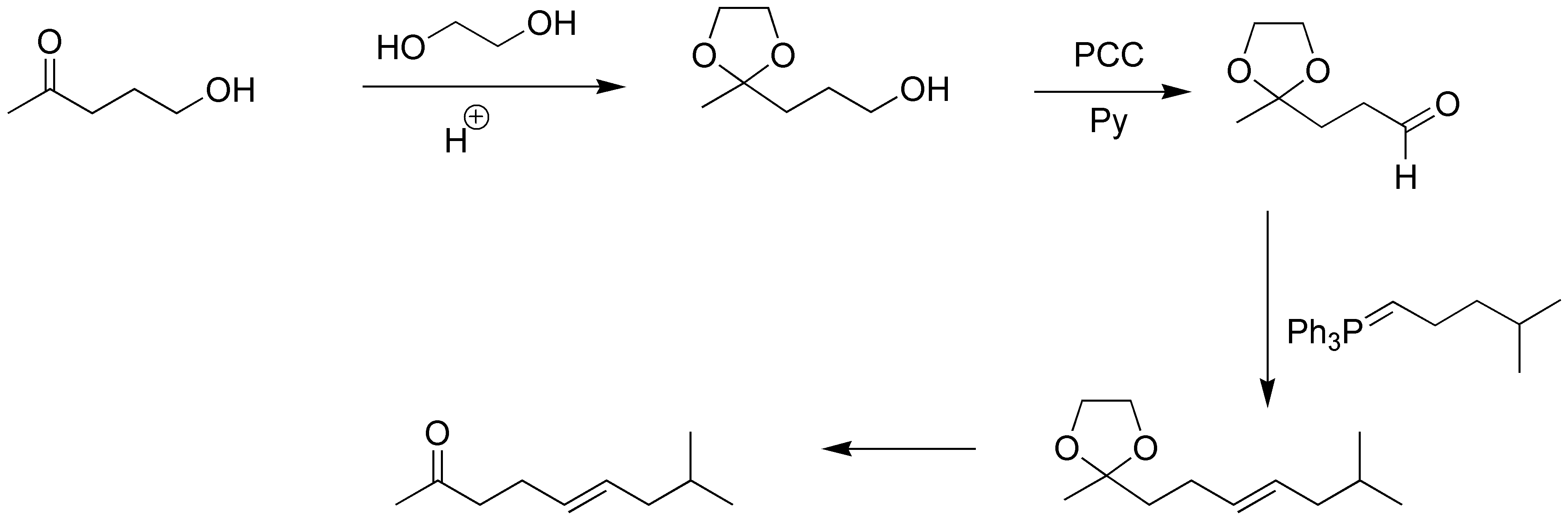
Solución 10:
La construcción de un ciclohexeno a partir de un alqueno sugiere la utilización de la reacción de Diels-Alder con un dieno adecuado: 2-metil-1,3-butadieno. Tras la separación de los dos posibles aductos formados, el mayoritario se trata con un iluro para dar el producto deseado.
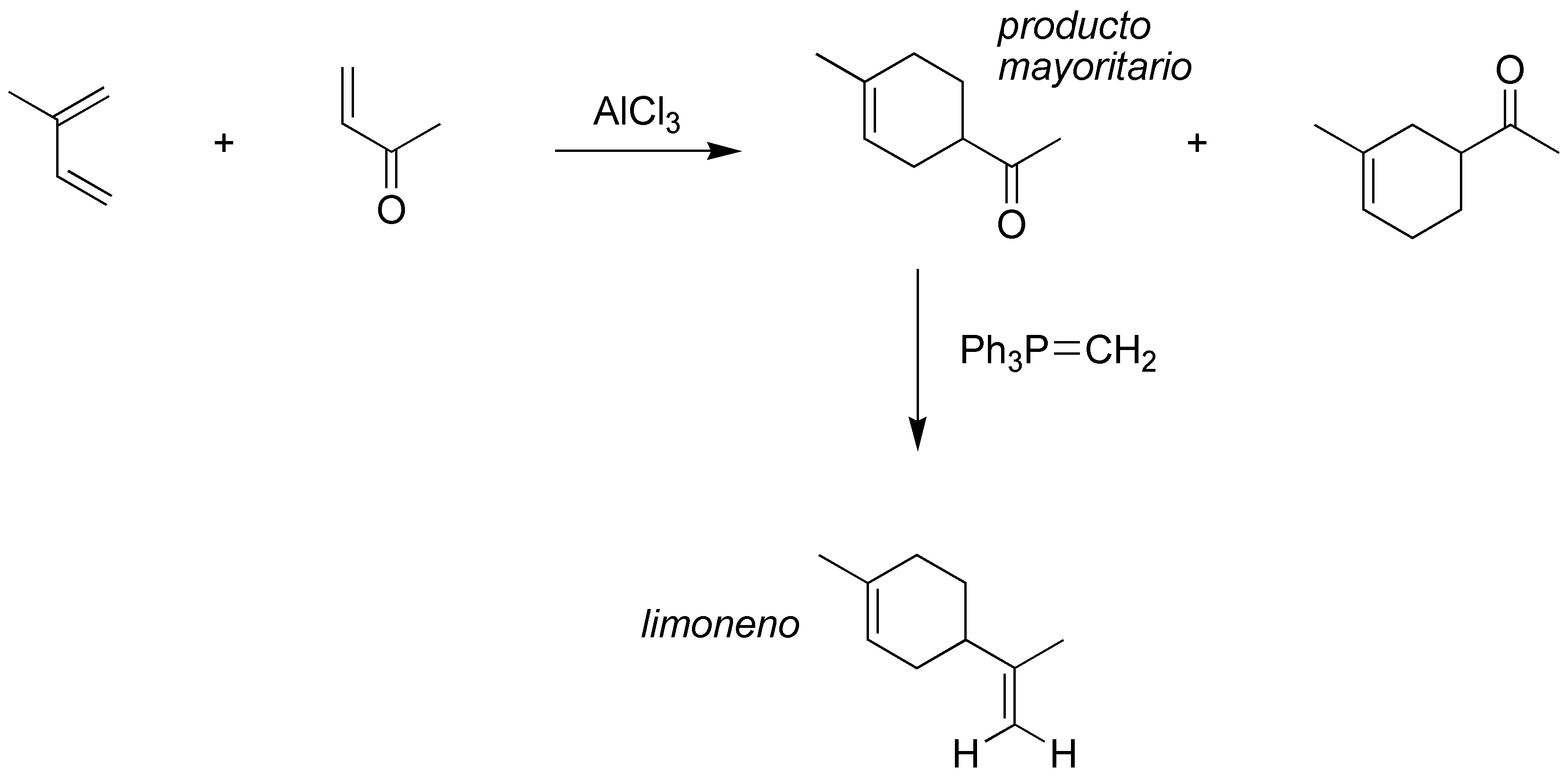
Solución 11:
Suponiendo que el doble enlace del producto final proviene del triple enlace original, debemos alargar la cadena por ambos lados del acetileno tratando el correspondiente acetiluro con un haloalcano adecuado. La hidrogenación con catalizador de Lindlar o con Na / NH3 nos dará los dos isómeros deseados.
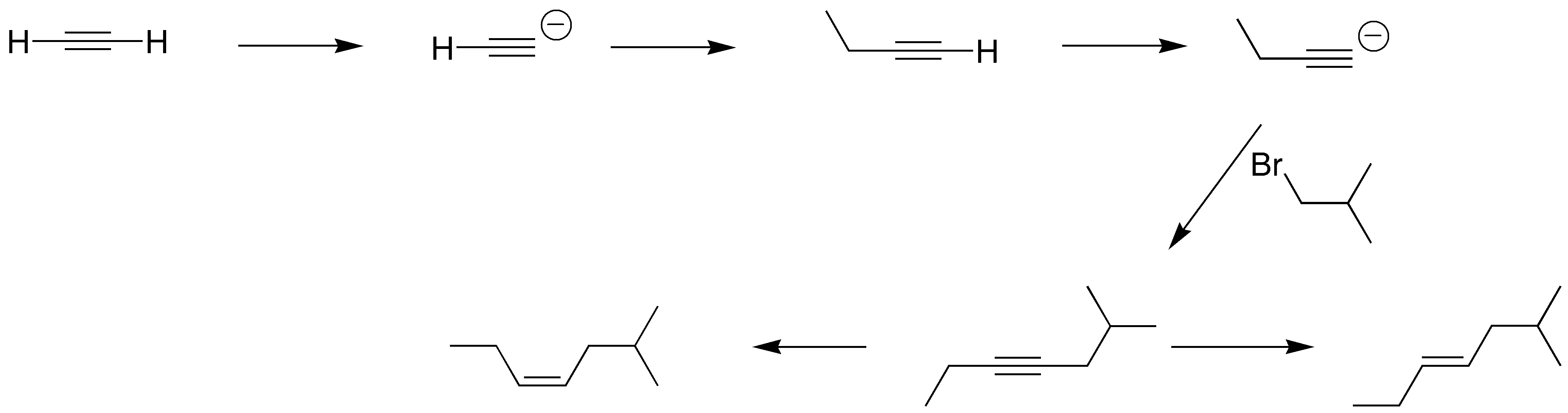
Solución 12:
La conversión del bromuro de bencilo hasta el correspondiente compuesto de Grignard y adición de este a acetaldehído (etanal) daría el correspondiente alcohol secundario. Finalmente, mediante su oxidación se obtiene la cetona esperada.

Solución 13:
Los halobencenos también dan compuestos de Grignard, cuando estos se adicionan a los epóxidos (oxaciclopropanos) forman alcoholes (con el óxido de etileno u oxaciclopropano) alcohol primario. La oxidación del mismo hasta ácido, conversión en cloruro de ácido y tratamiento con amoníaco genera la correspondiente amida.
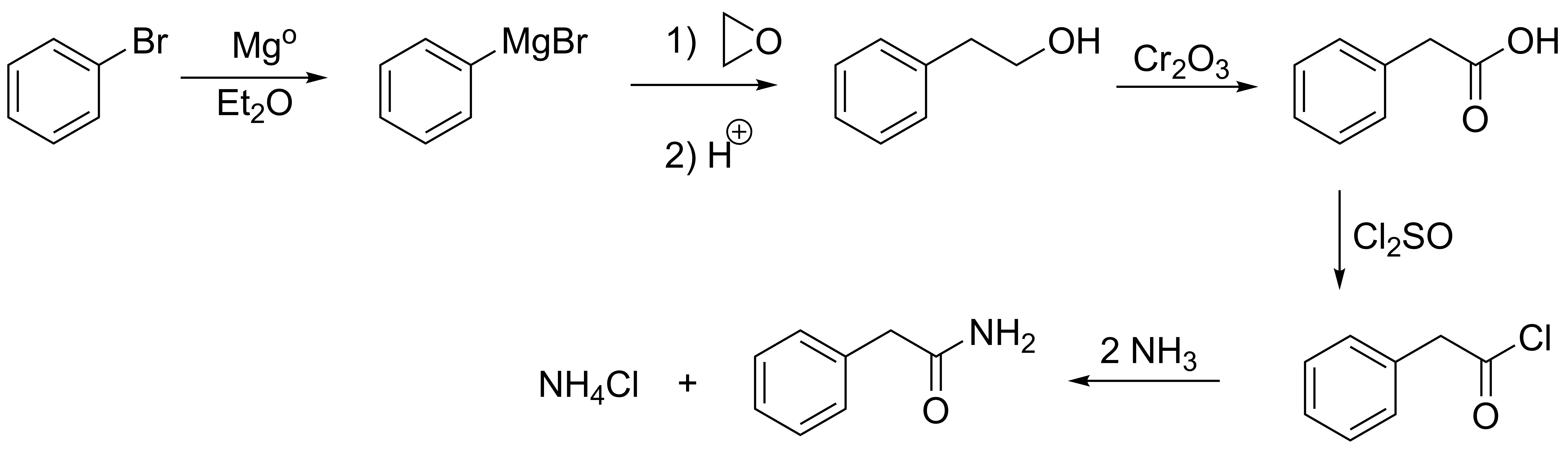
Solución 14:
A) La molécula del ejercicio presenta dos grupos funcionales (doble enlace y grupo carbonilo). Para la transformación A, se necesita reducir el doble enlace del anillo dejando inalterado al grupo carbonilo (reacción quimioselectiva). Una buena opción es tratar el sustrato con hidrógeno y un catalizador como Pd sobre carbón. Para evitar la reducción del grupo carbonilo se deben usar condiciones de reacción suaves, como son una presión de H2 no superior a 1 atm y temperatura ambiente.
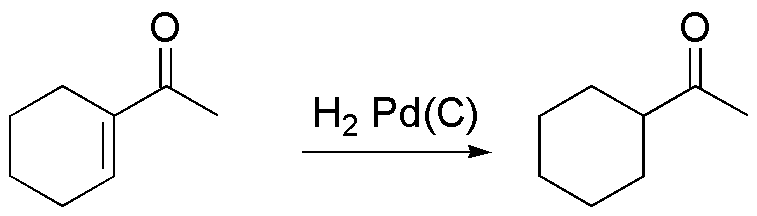
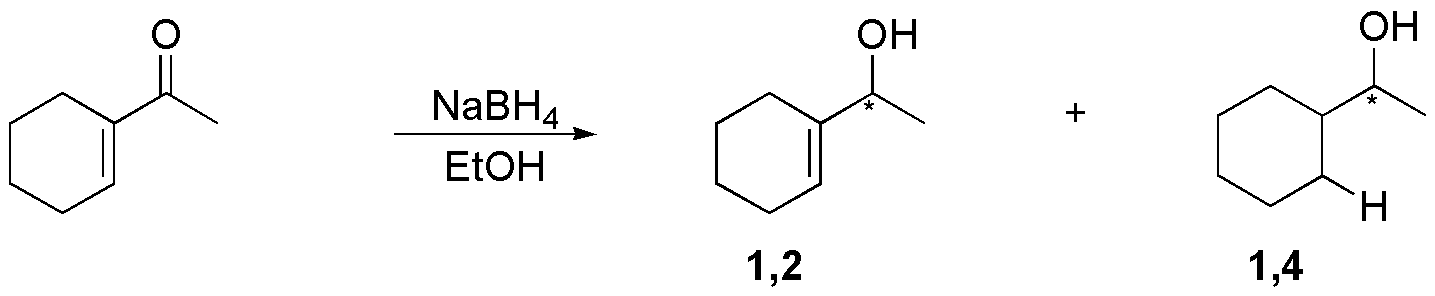
B) La reacción del sustrato con LiAlH4 y posterior acidificación del crudo de la reacción permite reducir sólo el grupo carbonilo en presencia del doble enlace (reacción quimioselectiva). En el caso de utilizar NaBH4, en sistemas conjugados, al producto de reducción del carbonilo suele acompañarle una cierta cantidad de producto de adición 1,4 (reducción de los dos grupos funcionales).
Para que la reacción sea completamente quimioselectiva con respecto al carbonilo, se utiliza una variante para enonas que consiste en la adición de CeCl3 (reacción de Luche).
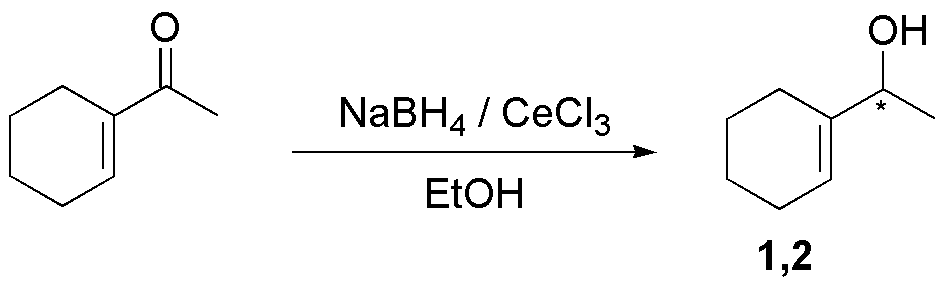
C) La reducción simultánea del doble enlace y el grupo carbonilo se puede realizar mediante hidrogenación, usando un catalizador enérgico como Pt y presión de H2 entre 3 y 5 atm.
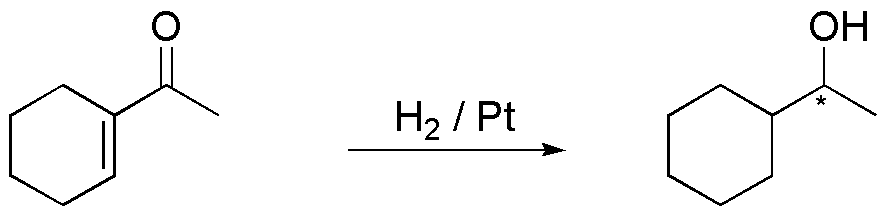
D) La reacción que se describe es una adición conjugada de un grupo metilo. Se requiere un carbono nucleófilo para llevar a cabo esta reacción, como los organometálicos. Sin embargo, no todos los organometálicos resultan útiles para la reacción, ya que los reactivos de Grignard y los derivados de Li producen mayoritariamente el producto de adición 1,2, mientras que los organocuparatos dan mayoritariamente el producto de adición 1,4.
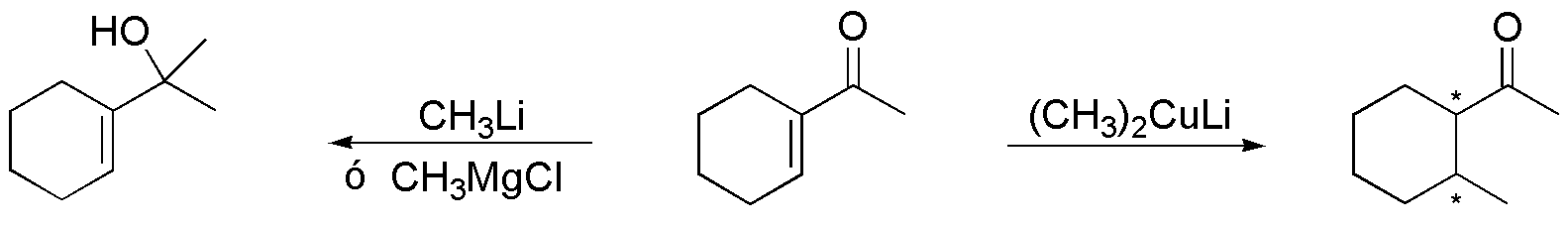
Solución 15:
El bromuro de pentilo con magnesio forma el bromuro de pentilmagnesio, A, el cual reacciona con el óxido de etileno. Debido a que el epóxido es simétrico, se obtiene un único producto de apertura. El producto inicial de la reacción es un alcóxido, que por tratamiento con el ácido acuoso nos dará el correspondiente alcohol, B, con esqueleto carbonado de dos carbonos más que el sustrato de partida. La oxidación con PCC de B (alcohol primario), lleva a la formación de heptanal, C. El heptanal adiciona el bromuro de fenil magnesio, para dar un alcóxido secundario, que en medio ácido acuoso da el alcohol D.
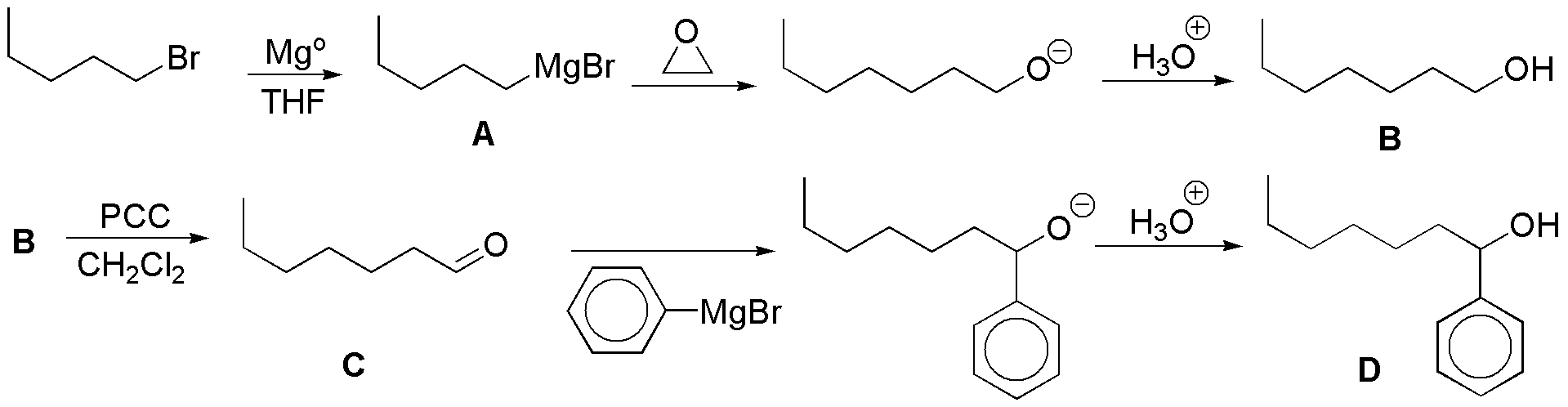
Solución 16
La comparación de las estructuras inicial y final nos dice que debemos introducir dos átomos de carbono, debido a la reactividad del grupo aldehído lo primero será proteger dicho aldehído como acetal y después a través de un magnesiano alargar la cadena con un aldehído dando un 5-hidroxiacetal (E) que tras desacetalación da el hidroxialdehído (F) puede encontrarse en equilibrio con la forma hemiacetálica (K), que con una oxidación suave con bromo en agua daría la correspondiente lactona. Más compleja es la síntesis propuesta en la que procedemos a la oxidación de F al correspondiente cetoácido, reducción selectiva del grupo cetónico y esterificación dando J:
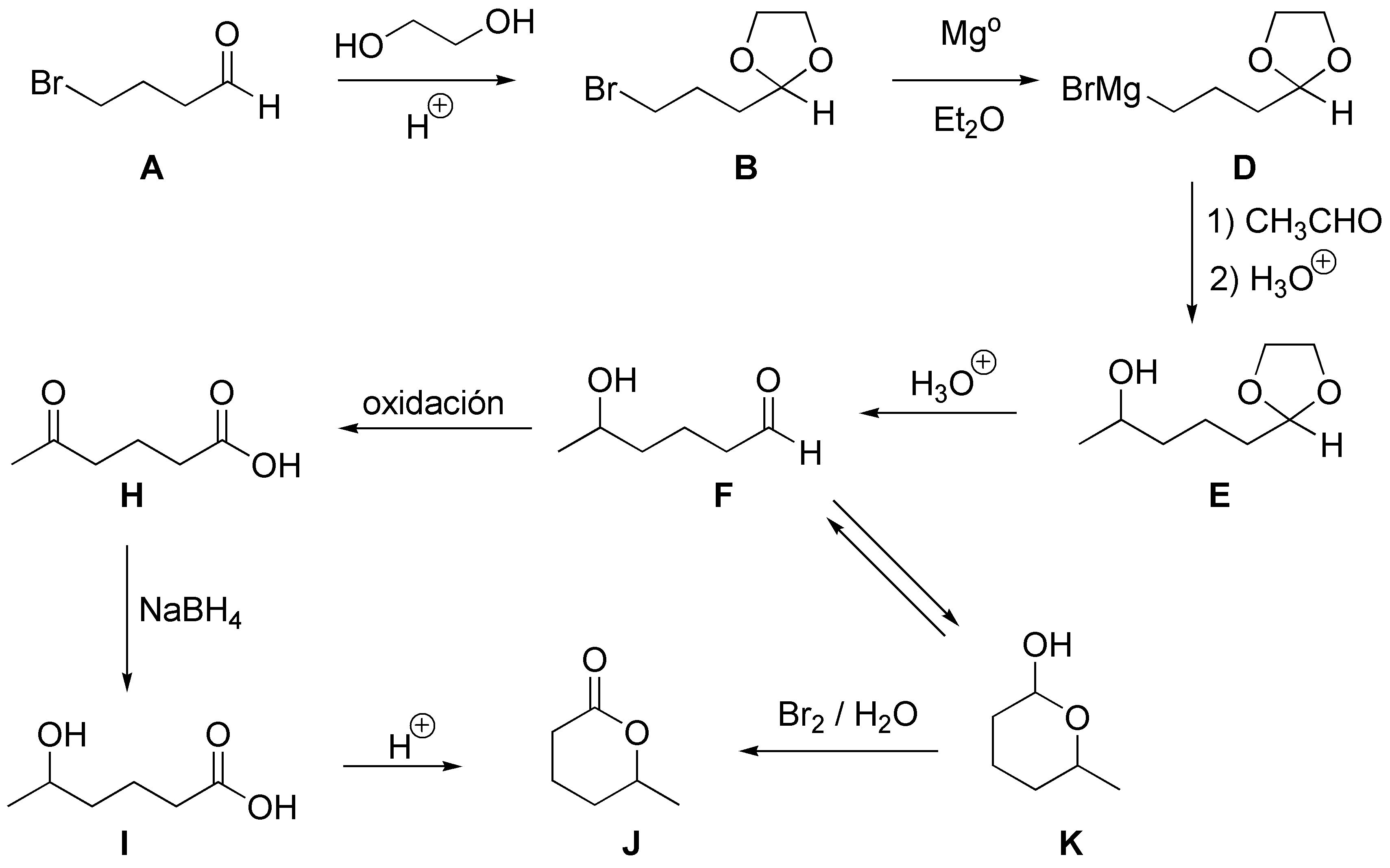
Solución 17:
Convertimos la cetona en el correspondiente cetal y por bromación alílica del alqueno resultante obtenemos el 4-bromo derivado. La formación del magnesiano y carboxilación del mismo nos daría la correspondiente sal del ácido carboxílico. Finalmente, mediante la hidrólisis ácida de la misma obtendríamos el producto deseado.
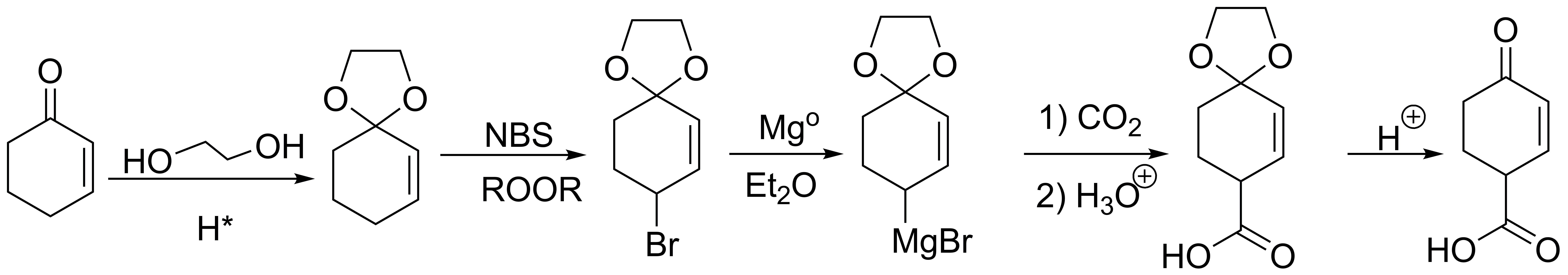
Solución 18:
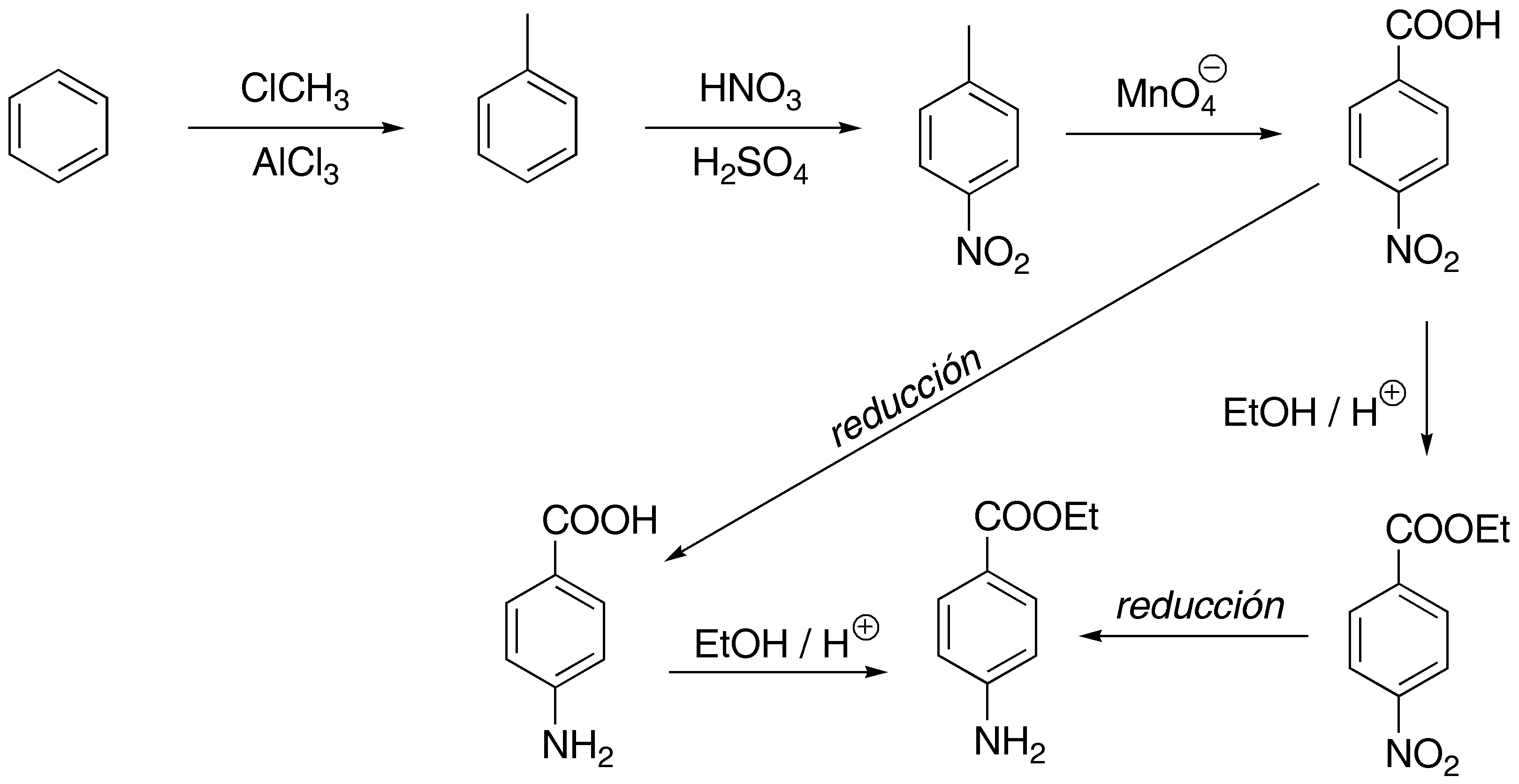
La alquilación y posterior nitración del benceno produce 4-nitrotolueno, cuya oxidación nos da el ácido 4-nitrobenzoíco. A partir de este podemos esterificar con etano y reducir el grupo nitro o bien reducir el grupo nitro y esterificar el ácido. Ambos métodos producen el producto deseado.
Solución 19:
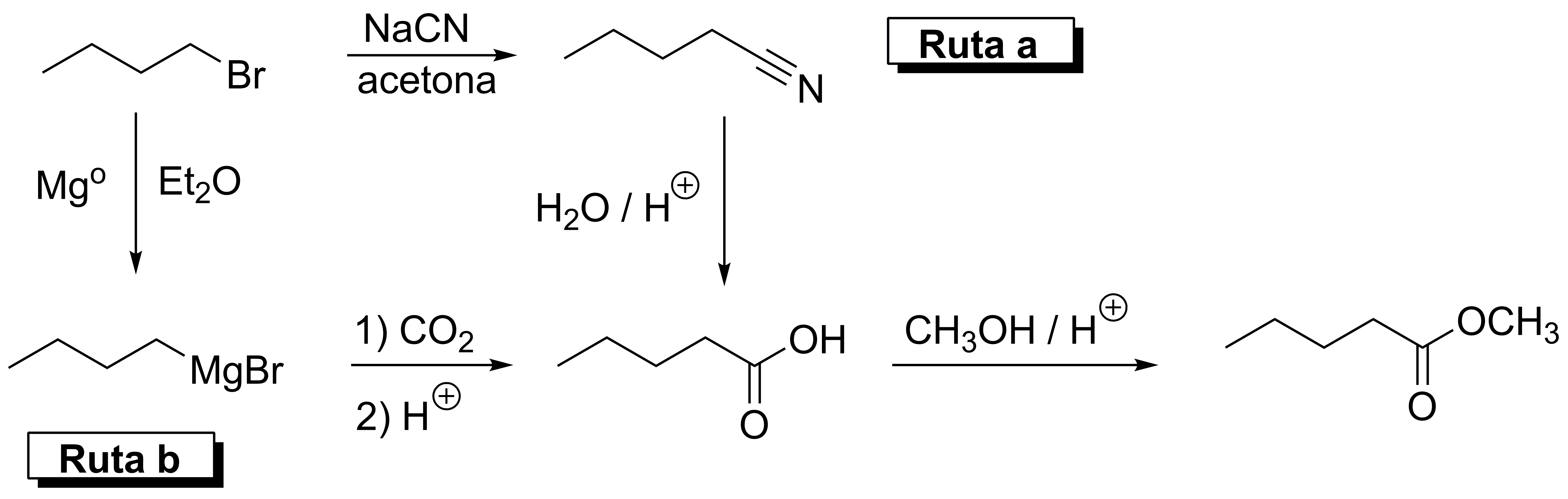
Para la obtención del ácido pentanoíco se nos plantean dos posible rutas: a) Tratamiento con cianuro y posterior hidrólisis del nitrilo formado o b) formación del magnesiano y carboxilación del mismo. La posterior esterificación del mismo nos daría el éster deseado.
Solución 20:
a) Una primera consideración es que puede haber varias soluciones a un mismo problema, ya que la forma de ensamblarfragmentos para obtener una determinada molécula no es única. En este caso, dividimos la molécula en dos zonas diferentes unidas a través del átomo de nitrógeno.
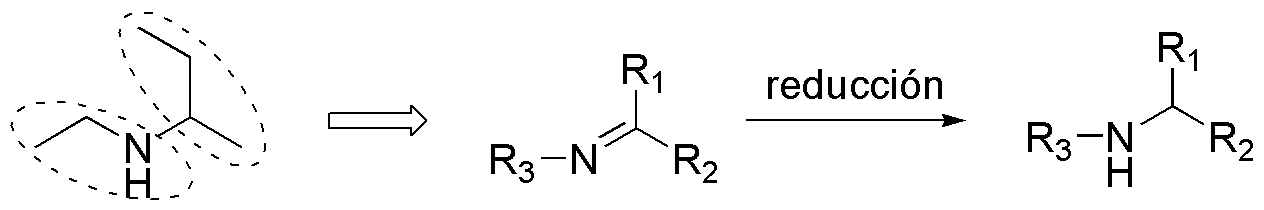
Una buena opción, puede ser preparar una imina, como la de la figura, que al reducirla nos lleva a la formación de la amina secundaria objetivo de la síntesis. Como es sabido, las iminas son el resultado de la reacción entre una amina y un compuesto carbonílico.
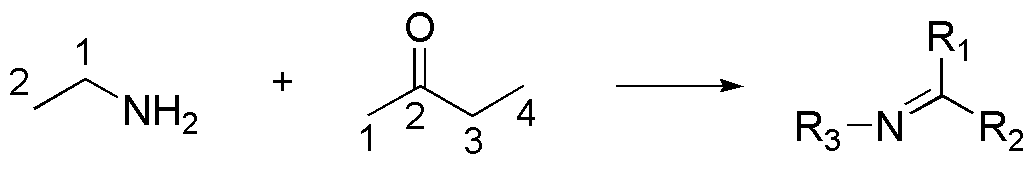
La amina tiene 2 átomos de carbono y la cetona 4. Una posible vía para la preparación de este fragmento sería a partir de los productos iniciales o fuentes de carbono. Esto se podría conseguir a partir de metanol, transformándolo en un derivado halogenado, incrementando la cadena carbonada por desplazamiento con cianuro. La reducción del nitrito nos conduciría a la amina deseada.
![]()
En cuanto a la cetona de cuatro carbonos, se puede sintetizar partir del etanol en varias etapas:
- Convertir el etanol en propanol a través de un magnesiano y formaldehído (en dos pasos).
- Oxidar el alcohol primario para dar propanal.
- Aumentar la cadena carbonada en una unidad con bromuro de metilmagnesio (se prepara a partir de metanol, según el esquema) .
- Oxidar el alcohol secundario hasta cetona.
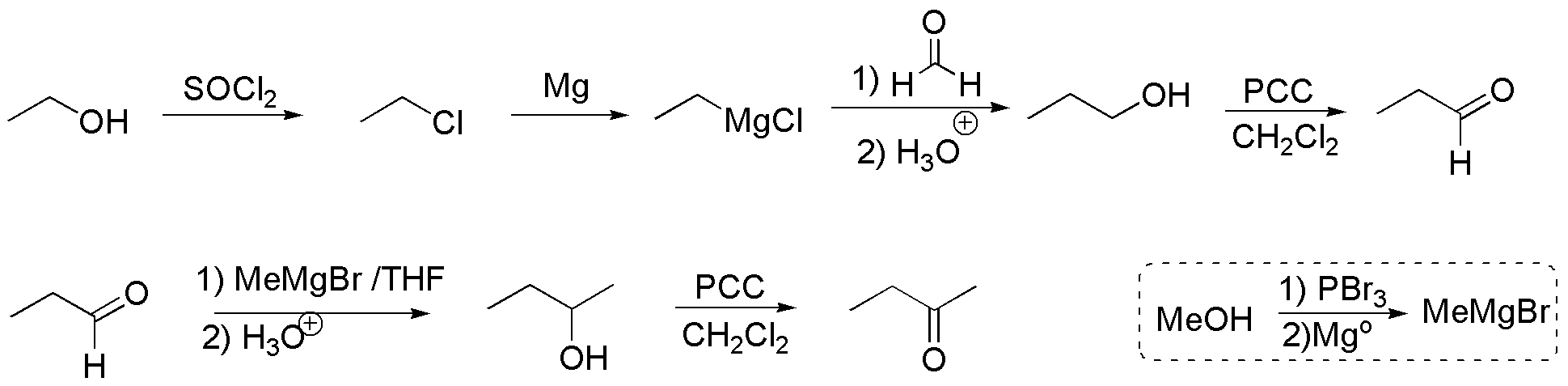
Finalmente, se unen ambos fragmentos, amina y cetona, para dar la imina y posteriormente se reduce, por ejemplo con LiAlH4.

b) Para preparar el sustrato b) se requiere de un esqueleto carbonado lineal de 4 carbonos. Se puede partir de propanol, que se ha preparado a partir de etanol en el apartado anterior. El propanol se convierte en dos etapas en un magnesiano el cual con CO2, que es otra de las fuentes de carbono, forma ácido butanoíco.
El ácido butanoíco se puede transformar en el correspondiente cloruro de acilo, por tratamiento con cloruro de tionilo. Finalmente, el cloruro de acilo reacciona con amoníaco para dar la amida objeto de la síntesis.
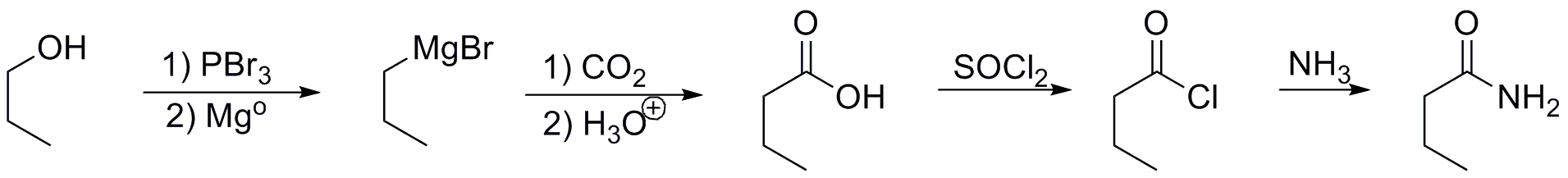
Solución 21:
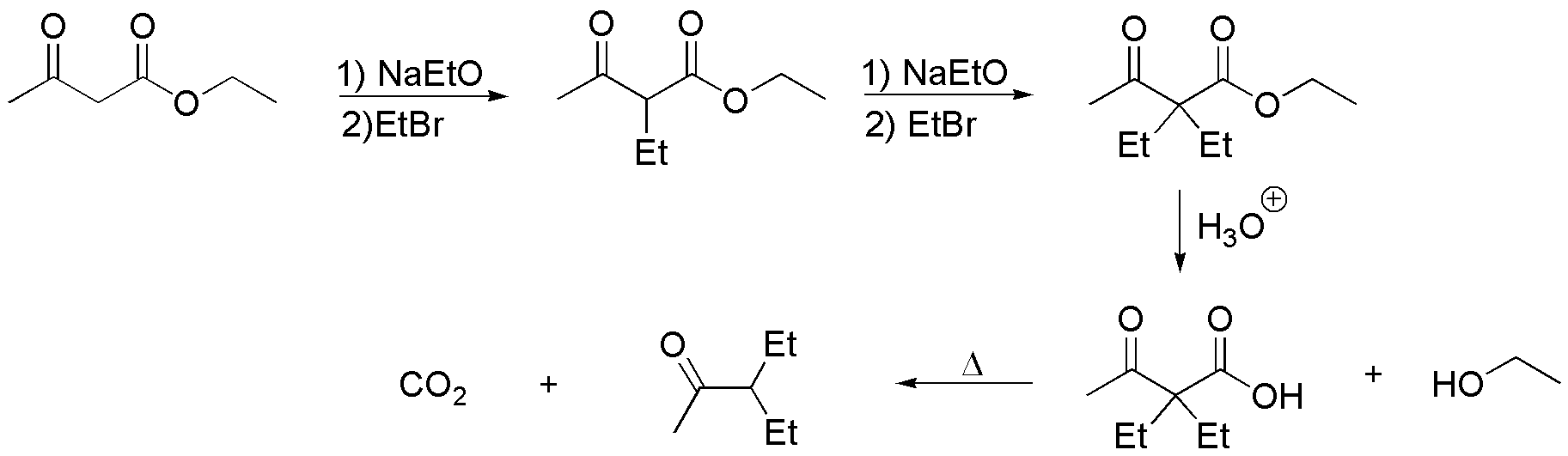
a) La molécula es una metilcetona disustituida en la posición adyacente al grupo carbonilo. El procedimiento más usual para preparar este tipo de compuestos es mediante la síntesis acetilacética, que permite obtener metilcetonas mono- o di-sustituidas en posición 3 de la cadena según la secuencia de reacciones:
- Alquilación del acetoacetato de etilo.
- Hidrólisis del éster.
- Descarboxilación.
de forma que el fragmento que aparece en trazo grueso lo aporta el acetoacetato de etilo mientras que los otros fragmentos provienen de las reacciones de alquilación.
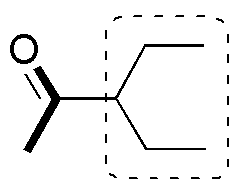
Dado que la única fuente de carbono es el etanol, debemos preparar el acetoacetato de etilo en varias etapas a partir de etanol. La condensación de Claisen es un procedimiento adecuado para obtener el acetoacetato a partir de acetato de etilo.
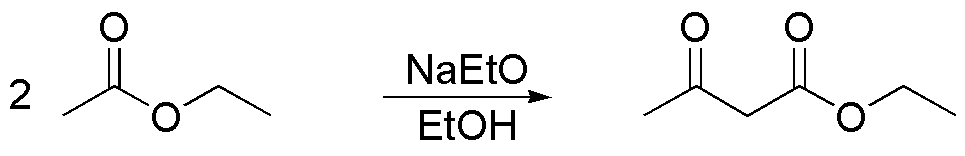
A su vez, el acetato de etilo se obtiene a partir de ácido acético y etanol y el ácido acético se puede preparar por oxidación de etanol.
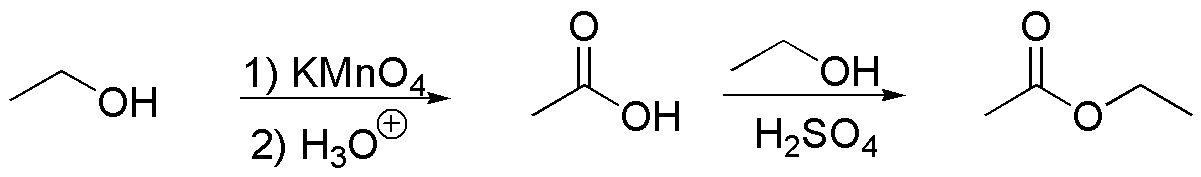
El esquema de la síntesis acetilacética sería el siguiente:
Finalmente, el bromuro de etilo empleado, se puede preparar a partir de etanol por cualquiera de los procedimientos descritos en las conversión de alcoholes en haloalcanos.
![]()
b) En la molécula se puede distinguir un fragmento (acetoacetato de etilo) que puede ensamblarse en la molécula a través de una reacción de formación de enlace C-C al resto de la molécula.
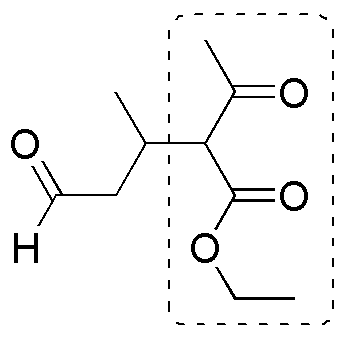
La clave de esta síntesis está en la unión entre este fragmento y el resto de la cadena mediante una adición de Michael del carbanión del acetoacetato de etilo sobre el siguiente aldehído insaturado:
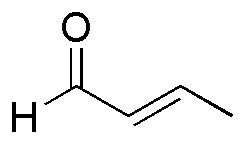
Este aceptor de Michael, se puede preparar a partir de etanol según la siguiente secuencia de reacciones:

La reacción que permite la síntesis del compuesto b) es:
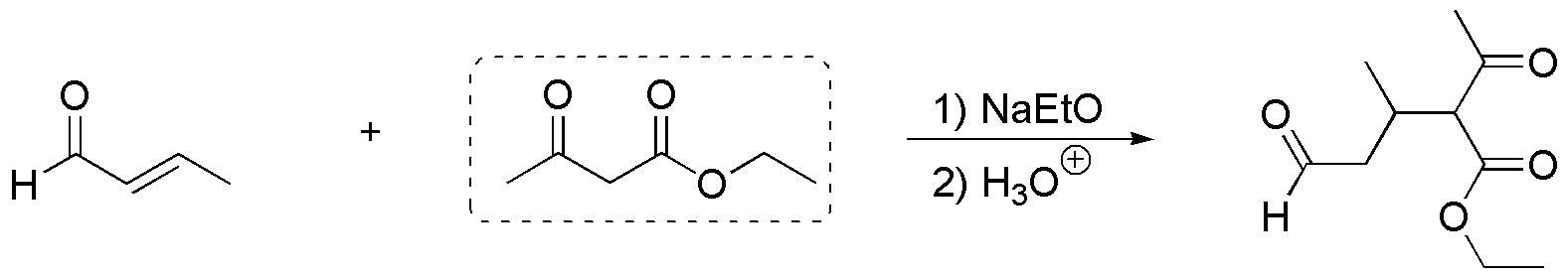
Solución 22:
La primera etapa de la síntesis malónica es, desde el punto de vista del mecanismo de las reacciones, un proceso de tipo SN2, en la que un carbanión estabilizado por resonancia actúa como nucleófilo y desplaza un átomo de halógeno en un haluro de alquilo. Casi siempre se utilizan bromuros, ya que el Br es un buen grupo saliente y sus haluros son relativamente estables y fáciles de manejar.
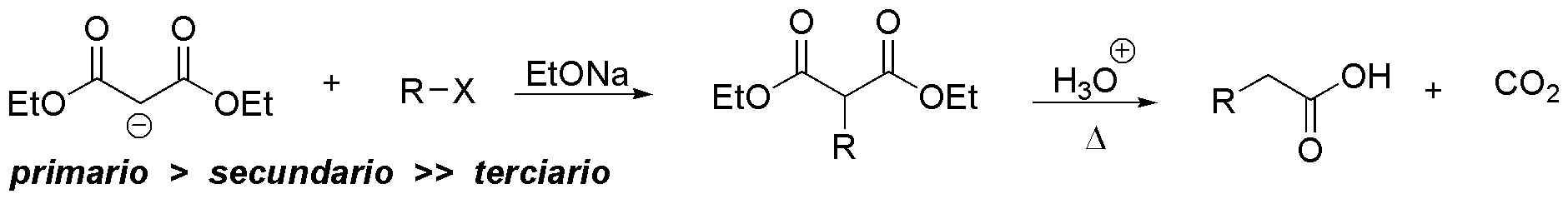
Por tanto, dependiendo de la naturaleza de R, la reacción se dará con mayor o menor facilidad. Los haluros que se necesitan son:

La facilidad con que se da la reacción será: I ≈ III > II
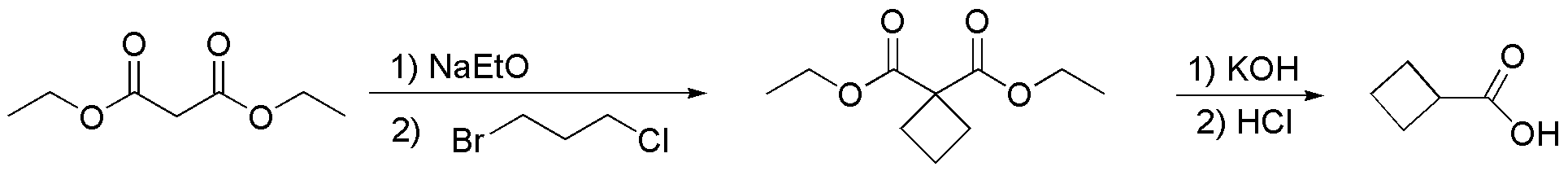
Con IV la reacción no es viable, ya que es un haluro terciario. Para el compuesto V se debe seguir una estrategia diferente, que resulta más efectiva. Consiste en usar un dihaluro, con Br y Cl al extremo de una cadena carbonada, con igual número de carbonos que el ciclo. Dado que el Br es mejor grupo saliente que Cl, se produce, en primer lugar la reacción de sustitución en este punto. Posteriormente, se da la reacción de sustitución intramolecular para dar el ciclo de cuatro miembros. Como en todos los casos, la reacción se completa con una hidrólisis y posterior descarboxilación.
Solución 23:
En primer lugar calculamos el número de insaturaciones: como los alcanos poseen una fórmula molecular CnH2n+2, en esta caso el hexano sería C6H14 la molécula posee un solo doble enlace. Si en la ozonólisis se produce sólo propanal, significa que el doble enlace está sustituido simétricamente, y por tanto es el hex-3-eno:
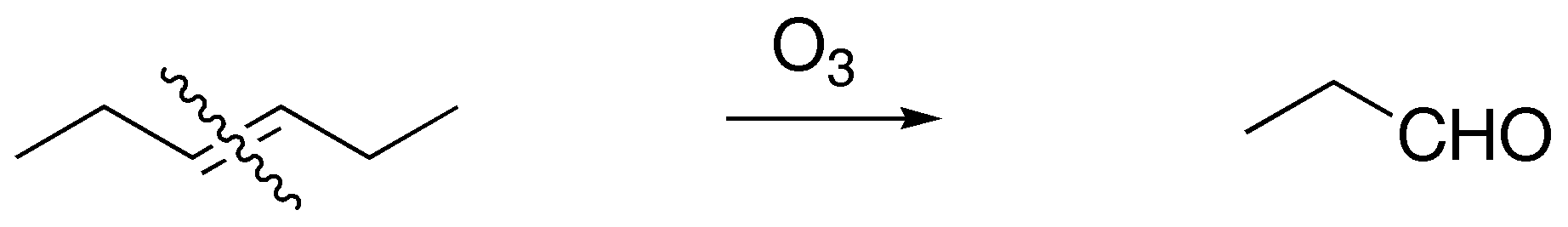
Solución 24:
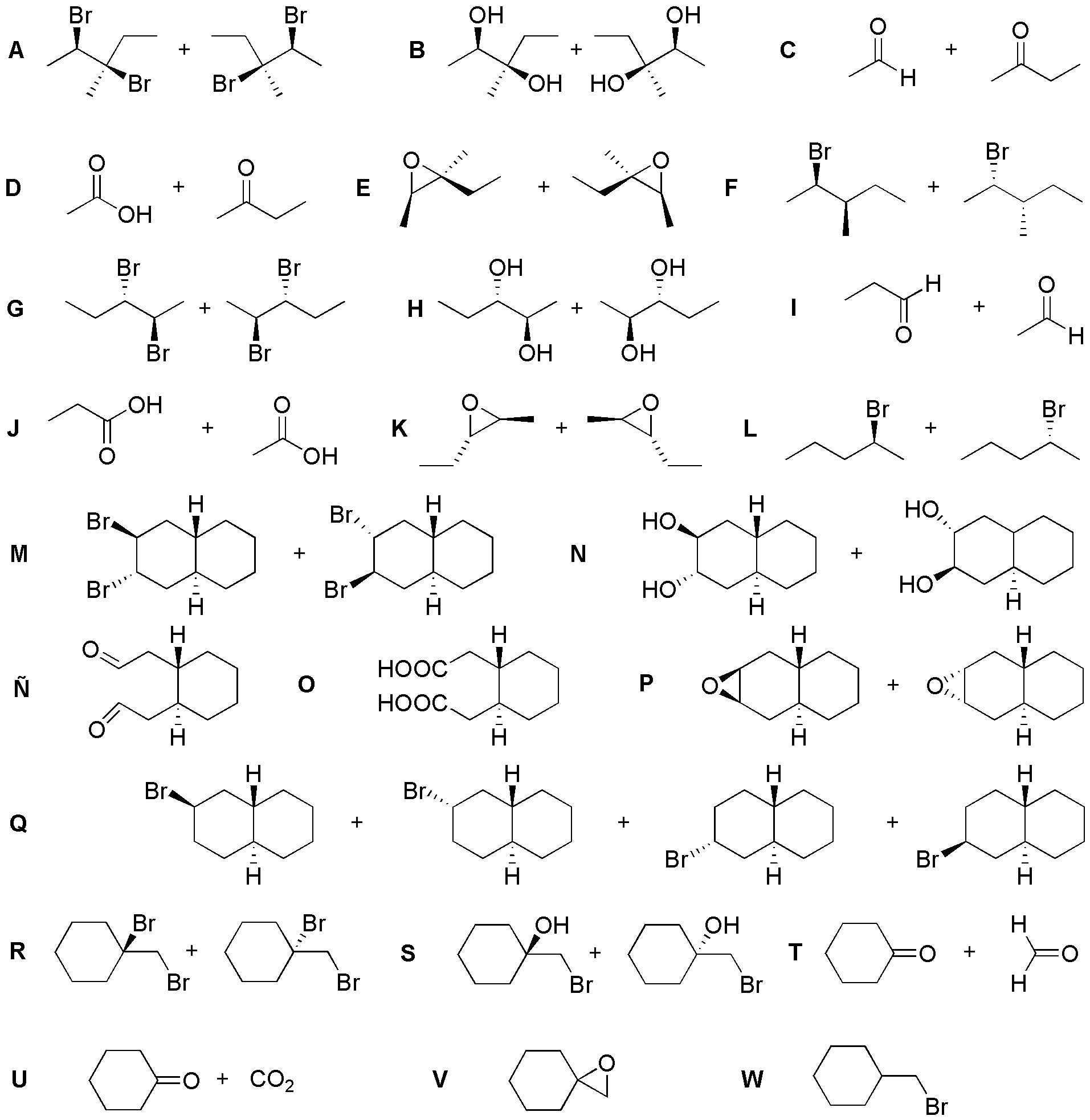
| Br2 / Cl4C | H2O2 / OsO4 (cat.) | Ozonólisis | KMnO4 (caliente) | Perácidos | HBr / peróxidos | |
|---|---|---|---|---|---|---|
 | A | B | C | D | E | F |
| G | H | I | J | K | L | |
 | M | N | Ñ | O | P | Q |
| R | S | T | U | V | W |
La primera columna de la tabla corresponde a la adición de bromo al doble enlace (adición anti) dando el dibromo derivado correspondiente. La segunda columna es una dihidroxilación sin del doble enlace dando el correspondiente glicol. La tercera y cuarta consisten en la rotura oxidativa del doble enlace dando 2 compuestos carbonílicos y/o CO2. La quinta es la epoxidación de dobles enlaces dando los correspondiente oxaciclopropanos (epóxidos) y la última es la adición anti-Markovnikov al doble enlace:
Solución 25:
| PCC /CH2Cl2 | CrO3 / H3O+ | KMnO4 | |
|---|---|---|---|
 | A | B | C |
 | D | E | F |
 | G | H | I |
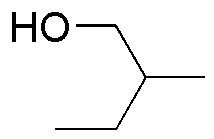
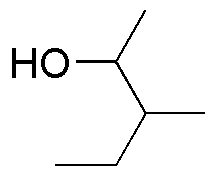
El PCC es un oxidante suave que oxida los alcoholes primarios hasta aldehídos y los secundarios hasta cetonas. El óxido crómico y el permanganato potásico son oxidantes fuertes:
Solución 26:
| LiAlH4 | NaBH4 | B2H6 | DIBAH | LiAlH4 | NaBH4 | B2H6 | DIBAH | ||
|---|---|---|---|---|---|---|---|---|---|
 | A | B | C | D | I | J | K | L | |
| E | F | G | H | 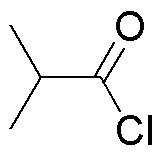 | M | N | Ñ | O |
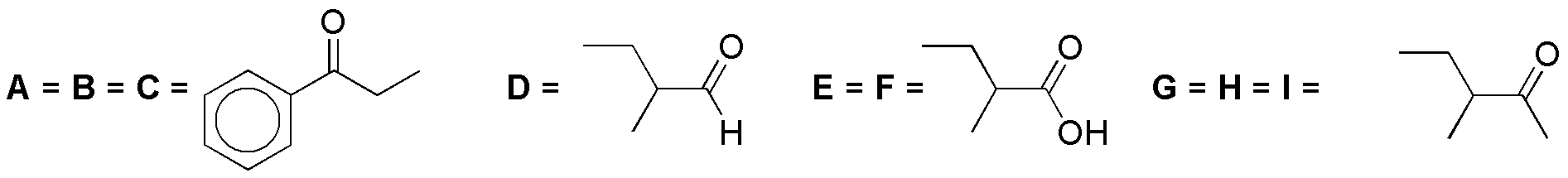
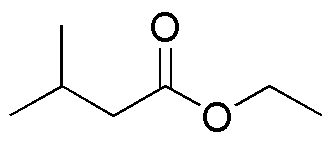
La tabla ilustra el comportamiento de distintos compuestos carbonílicos frente a diferentes reductores.
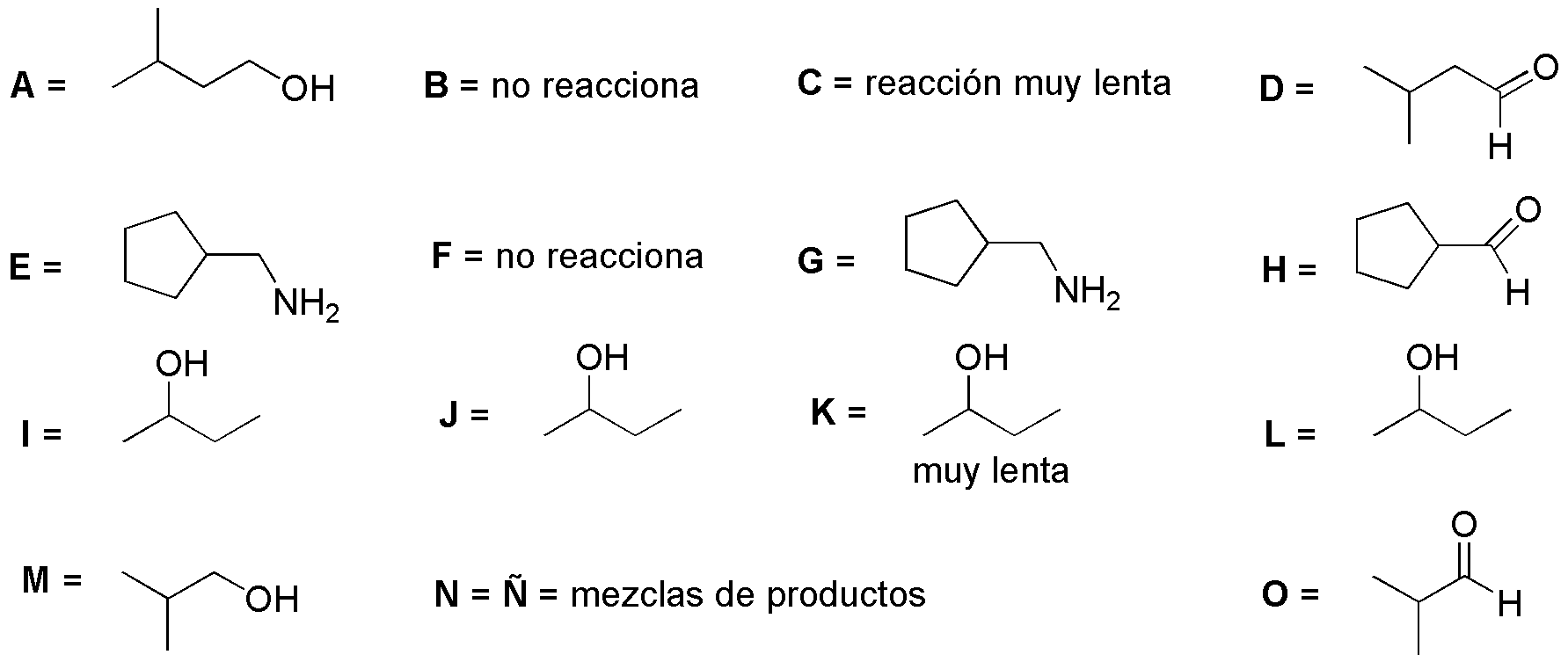
Solución 27:
El siguiente esquema ilustra las principales reacciones de los alquenos y las interconversiones y relaciones existentes entre los productos formados en las reacciones directas de los mismos.
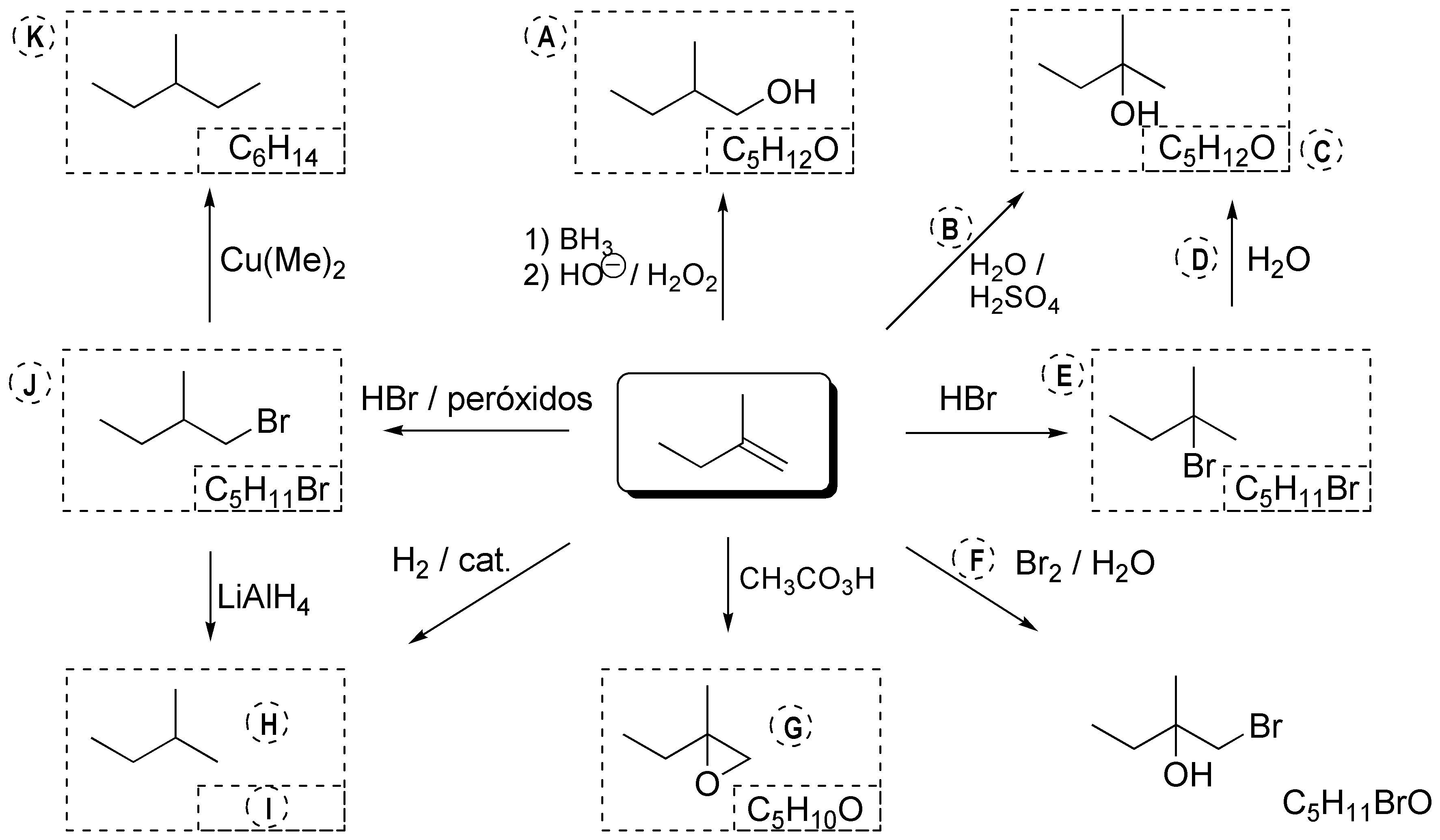
Solución 28:
El siguiente esquema ilustra las principales reacciones de los alquenos y las aplicaciones de los productos formados en las reacciones directas de los mismos:
A = HBr; B = KI / H3PO4; C = 1) KMnO4 / HO–, 2) H3O+; D = Cl2 / CCl4; E = perácido; F = Cl2 / H2O; G = H2O / H2SO4; H = H2 / (cat.); I = (Bu)3SnH; J = diazometano; K = PhLi / THF; L = NaH / THF; M = KtBuO / tBuOH.
Solución 29:
La primera etapa de la síntesis propuesta es una hidratación de alquenos con diferentes regioselectividades anti-Markovnikov. La primera y Markovnikov la segunda. Las segundas etapas corresponden a las diferentes condiciones de oxidación: con PCC hasta un compuesto carbonílico y con dicromato hasta ácido:
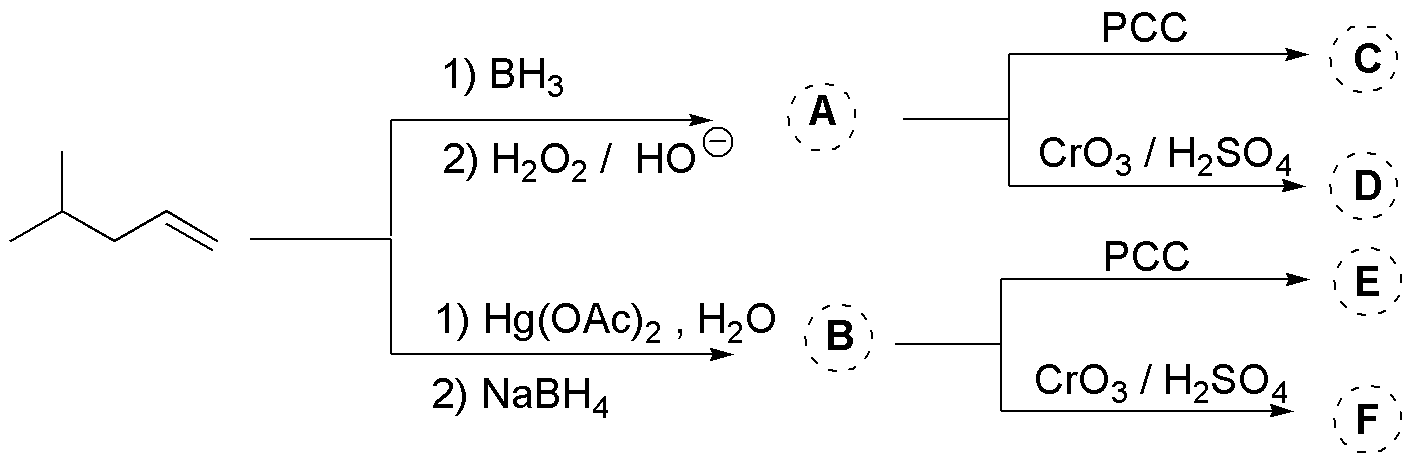
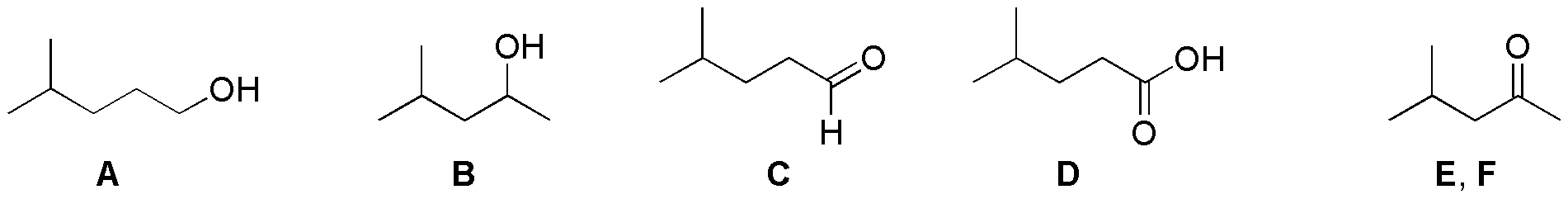
Solución 30:
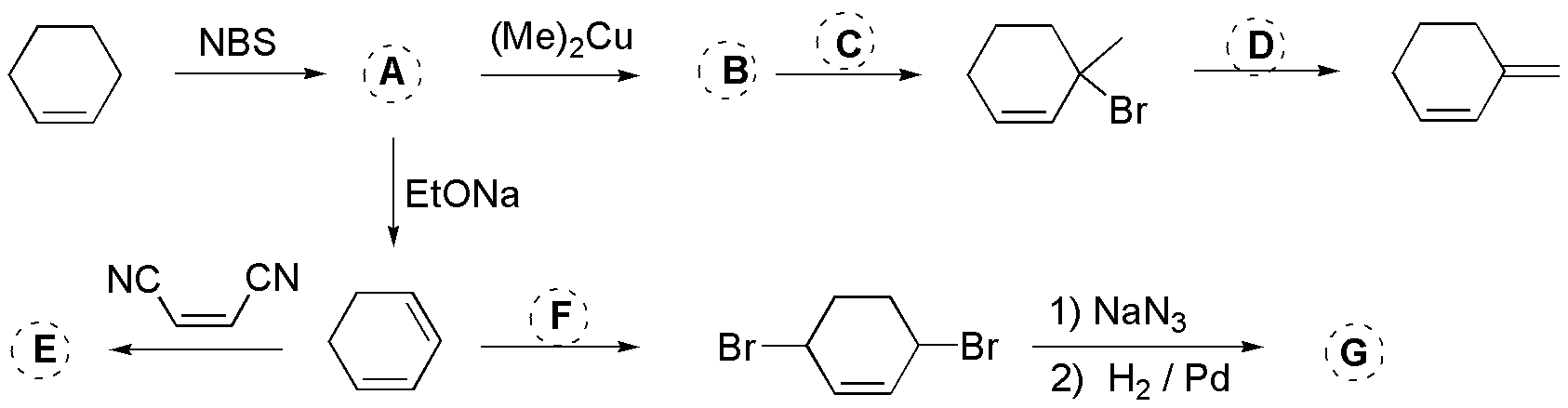
La NBS produce la halogenación alílica de los alquenos (A, 3-bromociclohexeno), el tratamiento de este con una base fuerte producirá un dieno y con un organocuprato el 3-metilciclohexeno, la halogenación radicalaria del cual producirá el 3-bromo-3-metilciclohexeno. Tratando este con una base fuerte e impedida (voluminosa) como el tercbutóxido potásico producirá el dieno indicado. Por su parte el ciclohexadieno puede dar una reacción de Diels-Alder con el etenodinitrilo dando el compuesto bicíclico E o puede adicionar bromo en condiciones termodinámicas (adición 1,4-) para dar el dibromociclohexeno. Este último, tras sufrir una doble sustitución nucleofílica con la azida y posterior reducción de la misma da el diaminderivado G:

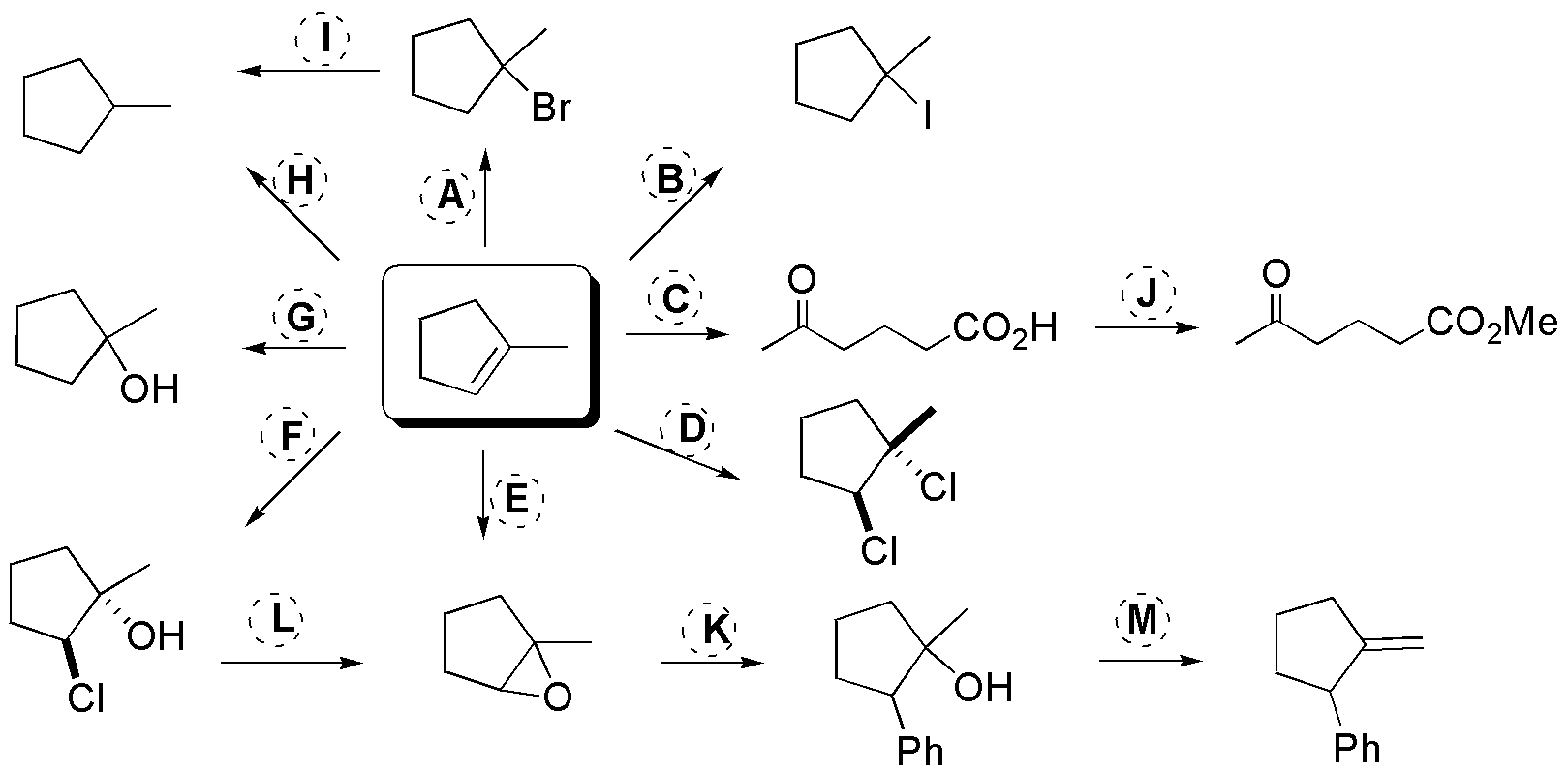
Solución 31:
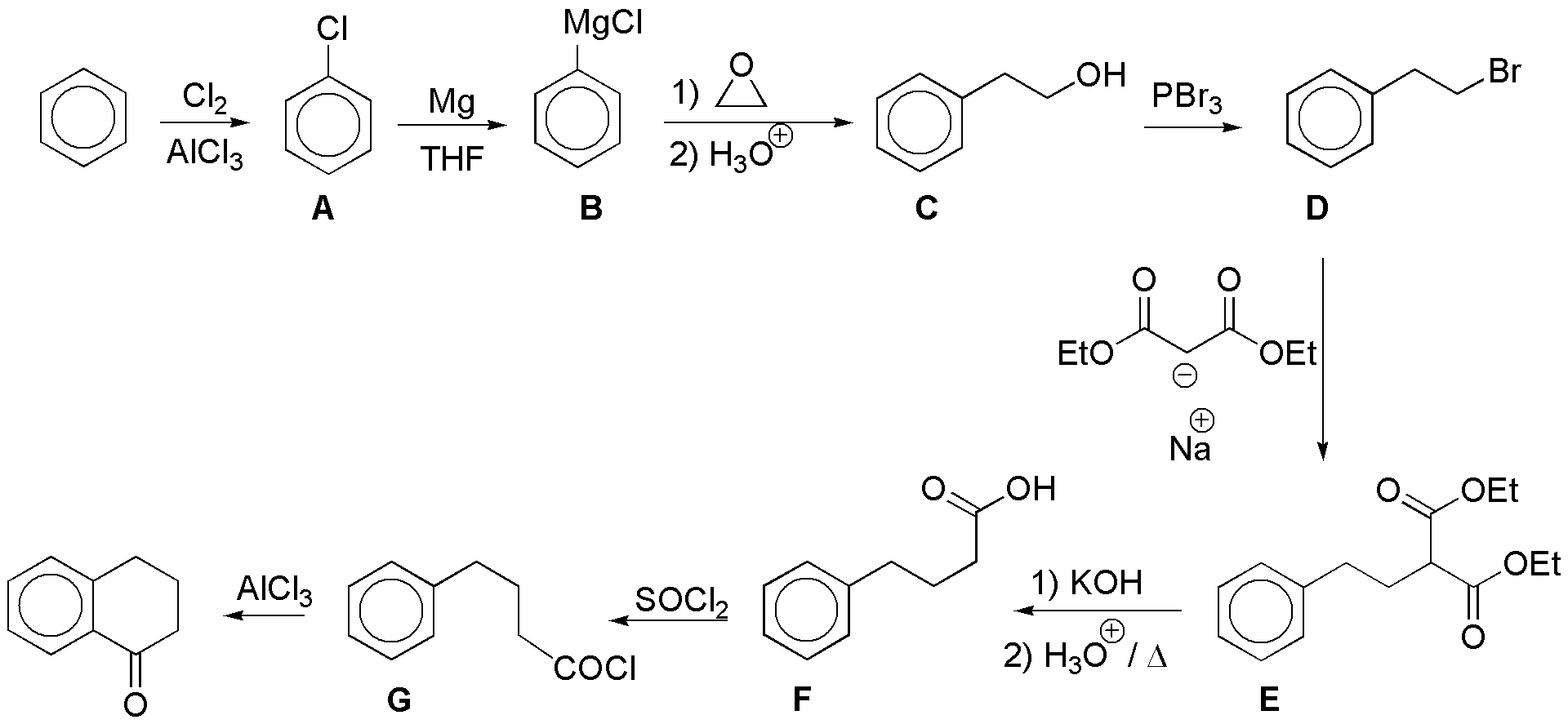
La cloración del benceno produce clorobenceno que se transforma en un magnesiano (B). Este reacciona con oxaciclopropano (óxido de etileno) produciendo el alcohol primario C, que tras transformarse en el bromoderivado D, permite la alquilación del malonato de etilo dando E; este β-diéster es saponificado con descarboxilación por tratamiento con potasa dando el correspondiente ácido carboxílico (F). Para producir la ciclación mediante una acilación de Friedel-Craft necesitamos convertirlo en el correspondiente cloruro de ácido G:
Solución 32:
a) Necesitamos alargar la cadena en un átomo de carbono, para ello lo primero es transformar el bromoalcano en un alqueno, posteriormente tendremos dos alternativas:
Ruta 1: Adición anti-Markovnikov de HBr al alqueno, sustitución con NaCN e hidrólisis del nitrilo obtenido dando el ácido buscado.
Ruta 2: Ozonólisis del alqueno, reacción del aldehído con el iluro de fósforo indicado en el esquema e hidrogenación del doble enlace:
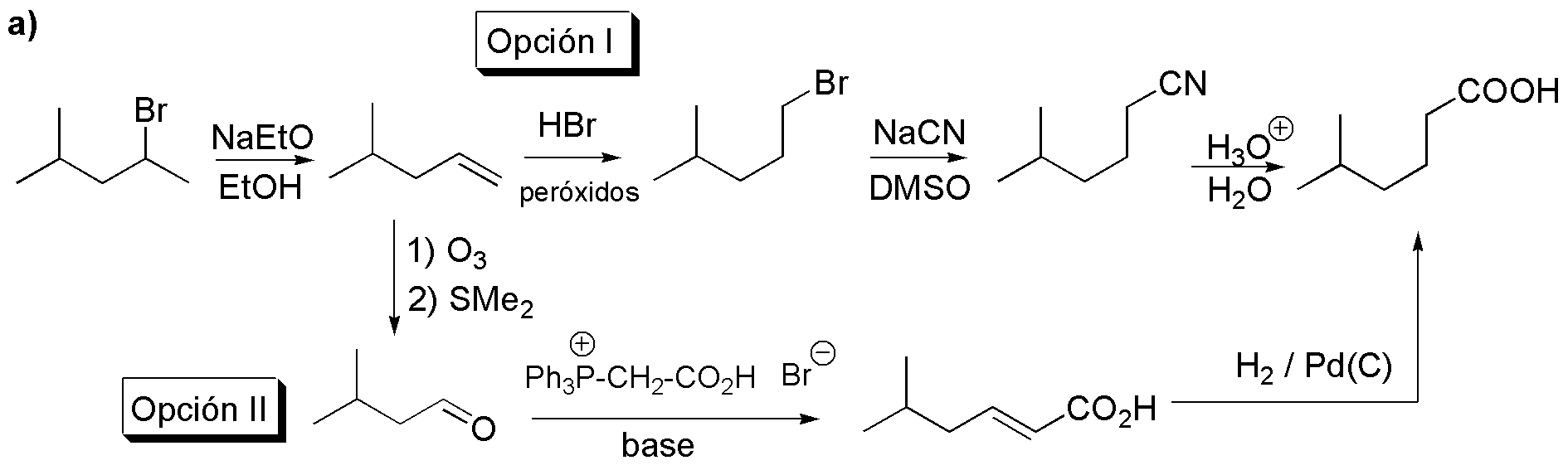
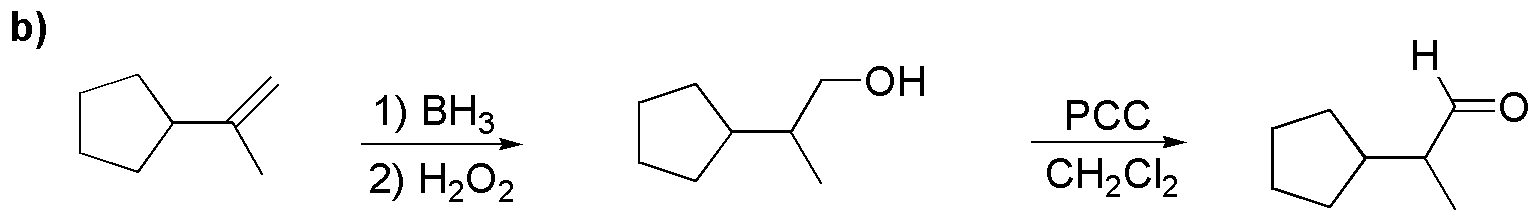
b) La hidratación anti-Markovnikov del alqueno produce un alcohol primario, que con PCC puede ser oxidado al correspondiente aldehído:
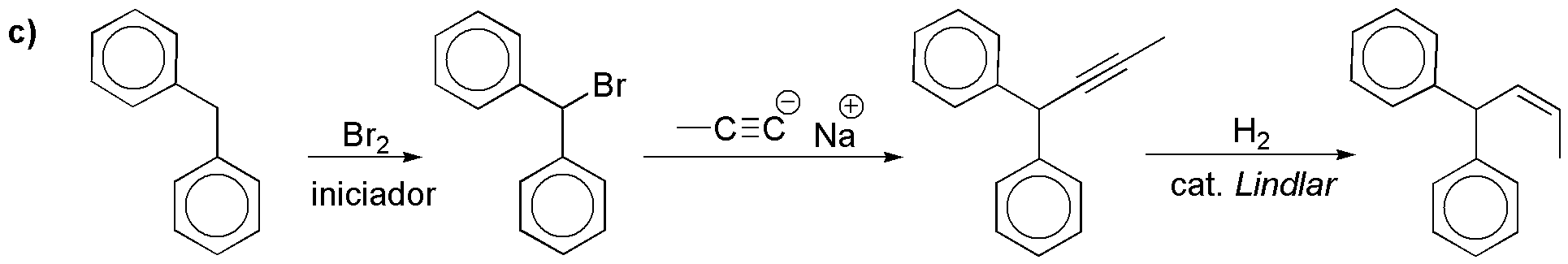
c) Tras una bromación del difenilmetano. Este se hace reaccionar al bromuro con el acetiluro del propino, dando el alquino disustituido. Por hidrogenación con catalizador de Lindlar obtendremos el alqueno correspondiente con la estereoquímica deseada:
d) Necesitamos introducir dos átomos de carbono no consecutivos en la estructura inicial. Para ello, el intermedio básico es la propanona que se obtiene por oxidación del 2-propanol. La alquilación del enolato de la misma conduce a la butanona, que por reacción de Wittig se transforma el alqueno buscado:
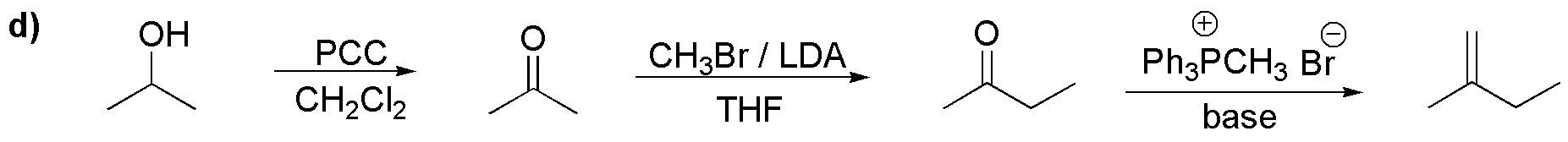
Solución 33:
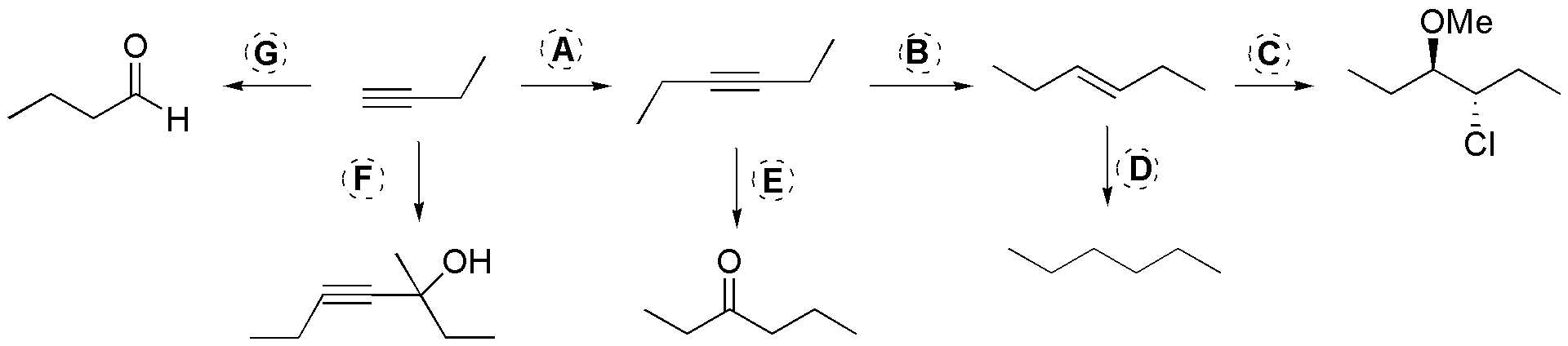
A) Para alargar la cadena de un alquino terminal utilizaremos la secuencia: 1) NaNH2 / THF, 2) EtBr; B) La hidrogenación del alquino para dar estereoisomería trans en el alqueno se produce con: Li / NH3; C) Se trata de introducir Cl y OMe en la molécula para ellos haremos la halogenación con cloro en metanol; D) Se tratará de una hidrogenación de alqueno por lo que utilizaremos: H2 /Pd(C); E) La conversión alquino-cetona se logra mediante la hidratación del alquino (el intermedio será un enol), como este es simétrico no se formarán mezclas de cetonas, una posible solución será: H2O / H3PO4; F) Los acetiluros pueden adicionarse nucleofílicamente a las cetonas para producir alquinil alcoholes, por tanto procederemos:1) NaNH2, 2) 2-butanona; G) La conversión alquino-aldehído se logra fácilmente mediante la hidratación anti-Markovnikov del propino, por lo que la secuencia usada será: 1) BH3, 2) H2O2 / HO–.
Solución 34:
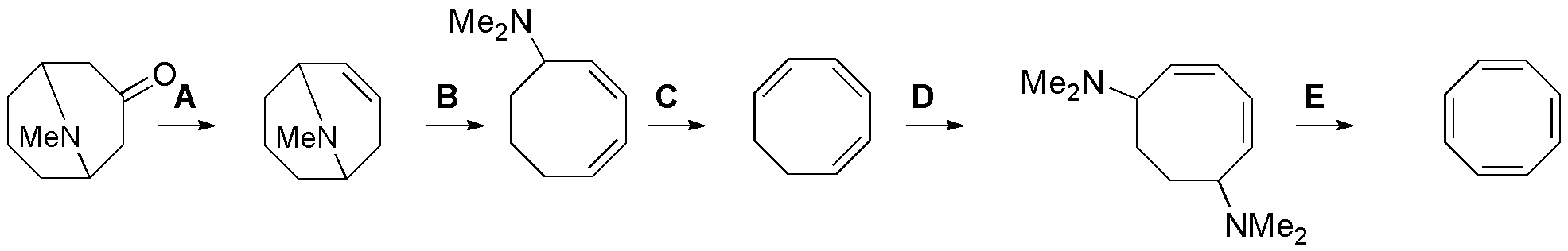
A) Consistirá en una reducción de la cetona y posterior deshidratación del alcohol, por tanto: 1) NaBH4 , 2) H2O / H2SO4; B = C= E) Estas tres etapas consisten en eliminaciones de Hofmann por lo que la secuencia usada es: MeI, Ag2O / calor; D) Como no es posible adicionar las aminas a los dobles enlace debemos parar por el dibromo derivado y posterior sustitución de los mismos, por tanto la secuencia usada será: 1) Br2 / CCl4, 2) Me2NH.
Solución 35:
La formación de ciclohexenos sustituidos nos lleva a utilizar la reacción de Diels-Alder como etapa clave de la síntesis. Para ello debemos convertir el producto inicial en un dieno sustituido lo que logramos a través de la halogenación bencílica y posterior eliminación del dibromo derivado:
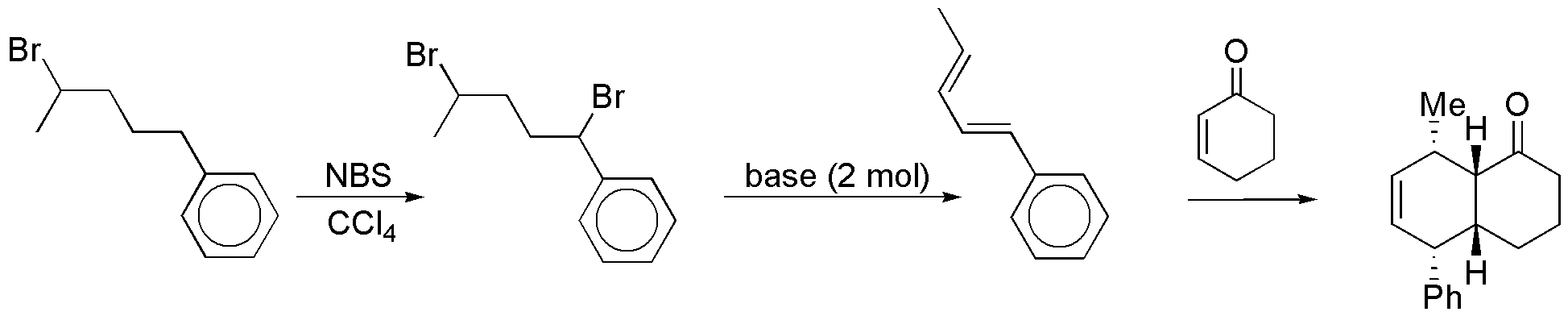
Solución 36:
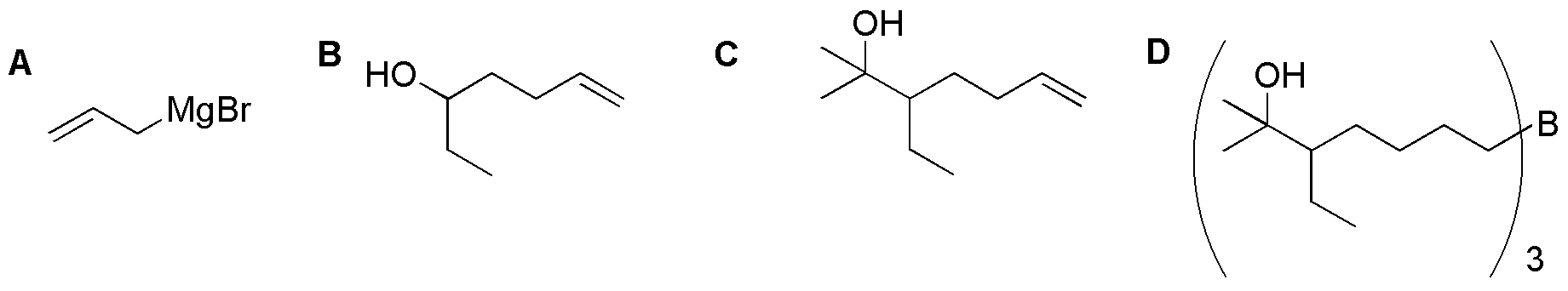
A) Es un magnesiano que pude adicionarse a los epóxidos nucleofílicamente sobre el carbono menos impedido dando un alcohol (B). La transformación del mismo en bromuro y posteriormente en magnesiano y adición del mismo a la propanona nos dará el alcohol insaturado C. La hidratación anti-Markovnikov de C nos dará el producto deseado a través del borano D:
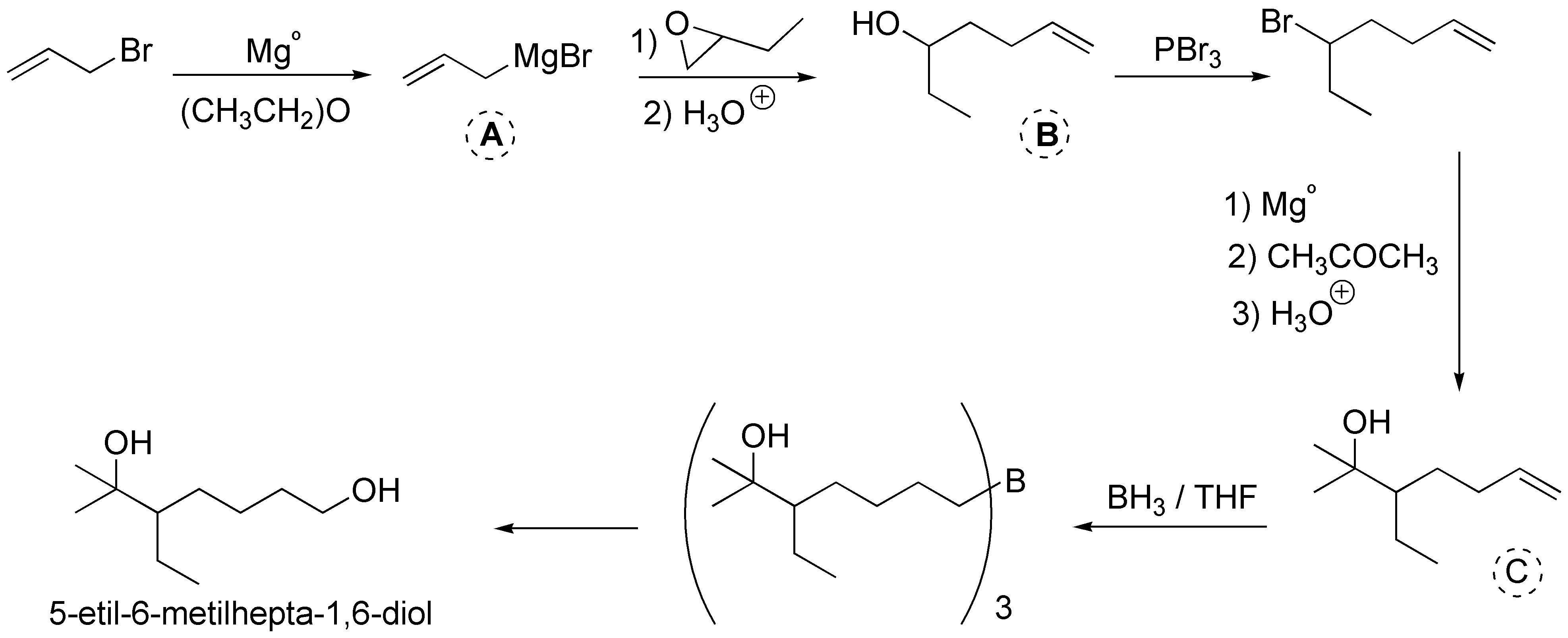
Solución 37:
La clave de la síntesis propuesta está en mantener el grupo cetónico en 6 durante toda la secuencia sintética. Para lo cual, el procedimiento más útil es formar el cetal cíclico. El resto de las reacciones consistirán en la reducción del éster a alcohol con hidruro y la esterificación del alcohol con cloruro de benzoilo. Para finalizar con la hidrólisis del cetal:
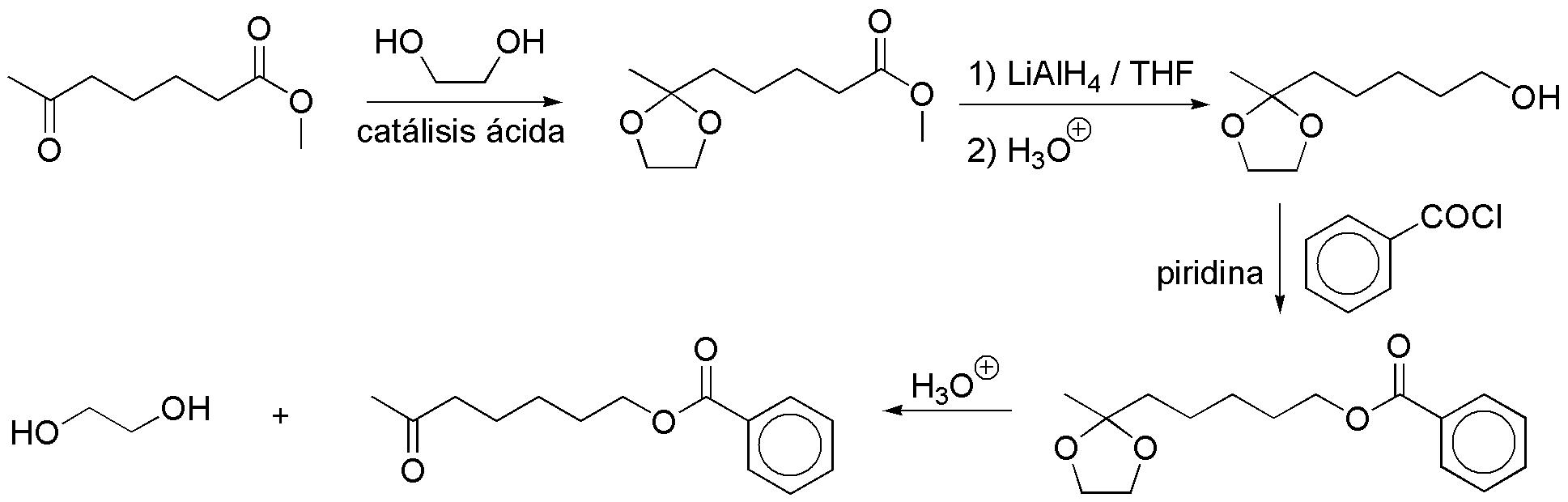
Solución 38:
El compuesto A será el ácido bromoacético como resultado de una reacción de Hell-Volhard-Zelinsky. El tratamiento de este con NaCN dara el ácido cianacético B. La reacción de B con ácido mineral en etanol producirá tanto la hidrólisis del nitrilo como la esterificación del diácido resultado de tal hidrólisis, luego C será el malonato de etilo (dietilpropanodioato de dietilo). Si C se trata con base y un haluro de alquilo se producirá la alquilación del malonato D. La hidrólisis de este conduciría a un β-diácido que sufre descarboxilación dando el ácido 3-fenilpropanoíco (E):
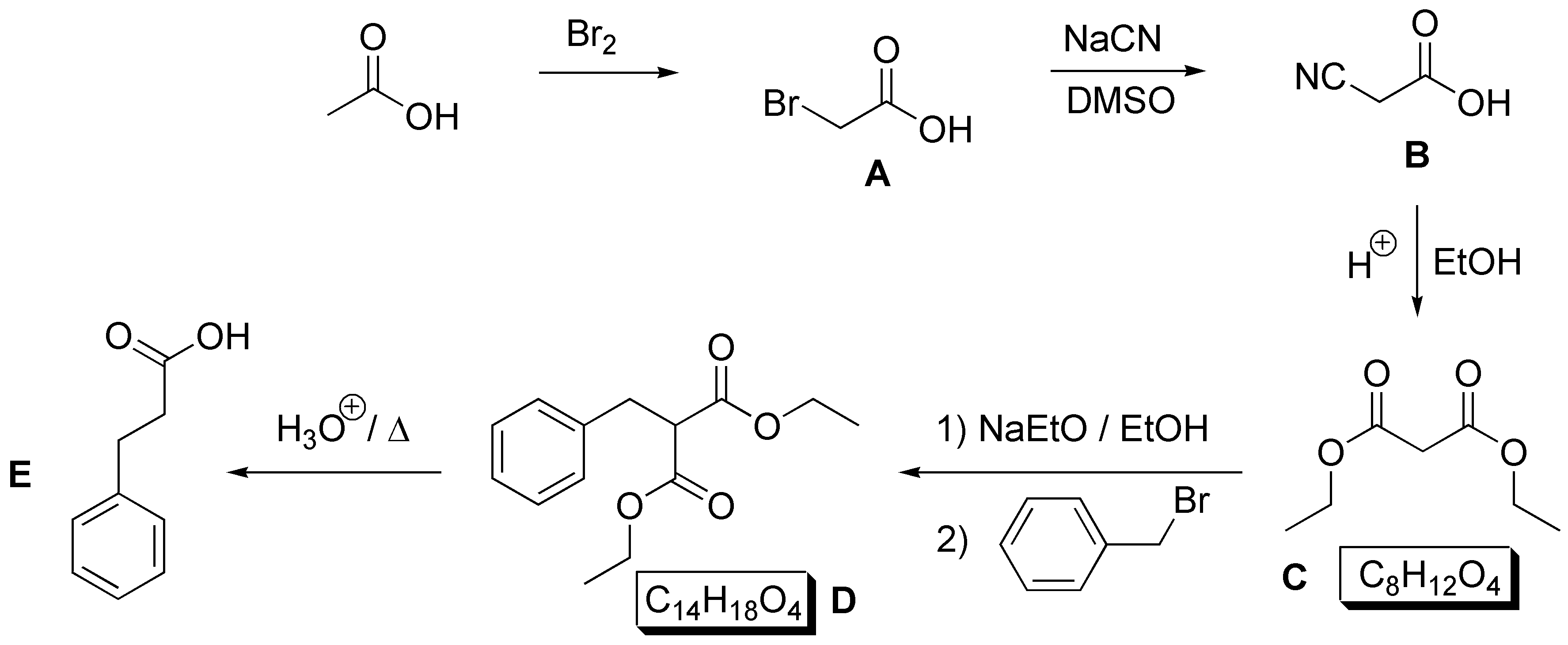
Solución 39:
La estructura de B será la del epóxido del ciclohexeno. Dicho epóxido es abierto nucleofílicamente por un organocuprato dando el trans-2-metilciclohexanol como una mezcla de enantiómeros. Para adivinar C debemos tener en cuenta que la hidratación de un alqueno con regioselectividad anti-Markovnikov lo forma, por lo que C debe ser el 1-metilciclohexeno:
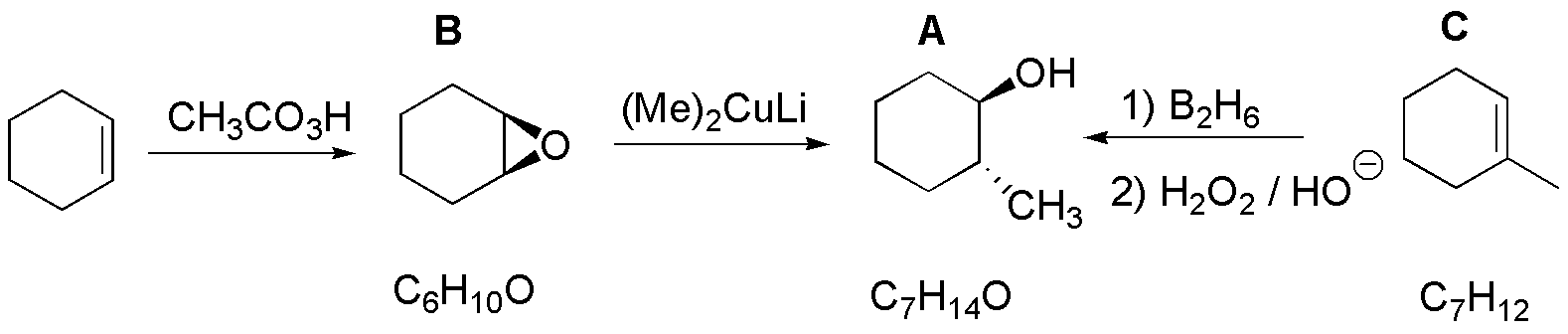
Solución 40:
A se trata del magnesiano del bromobenceno, este reacciona con CO2 dando el ácido benzoíco (B), cuya esterificación produce el benzoato de metilo (C). Cuando un éster se trata con un magnesiano, se transforma en un alcohol terciario en este caso el trifenilcarbinol (trifenilmetanol) D:
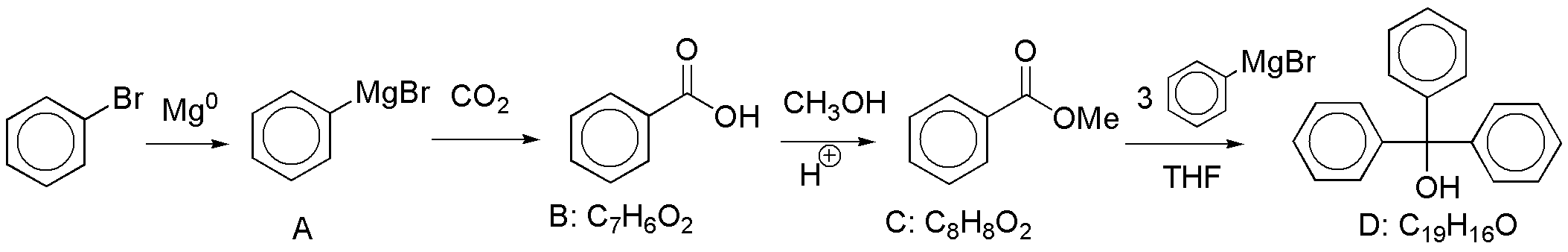
Solución 41:
La finalidad de este problema es tratar de discriminar alcoholes primarios de secundarios según su reactividad. Cuando el 2,5-hexanodiol se trata con un cloruro de tercbutildimetilsililo se protege como sililéter sólo el primario, lo que permite la oxidación del alcohol secundario a cetona, la posterior desprotección del sililéter con fluoruro de tetrabutilamonio nos da el alcohol buscado:
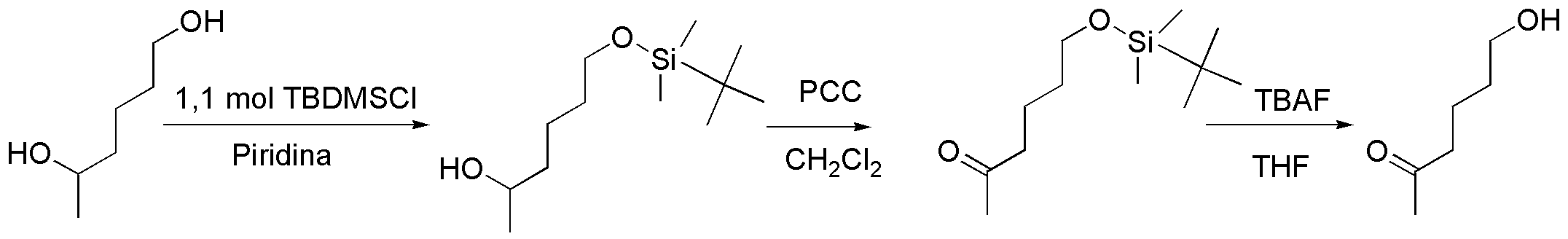
Solución 42:
Cuando un alqueno se trata con ácido mineral acuoso produce la hidratación del mismo. Posteriormente, A se trata del ciclopentanol, cuya oxidación dara la ciclopentanona B, al tratar esta con un peroxiácido se producirá la oxidación de Baeyer-Villiger dando la correspondiente lactona C.
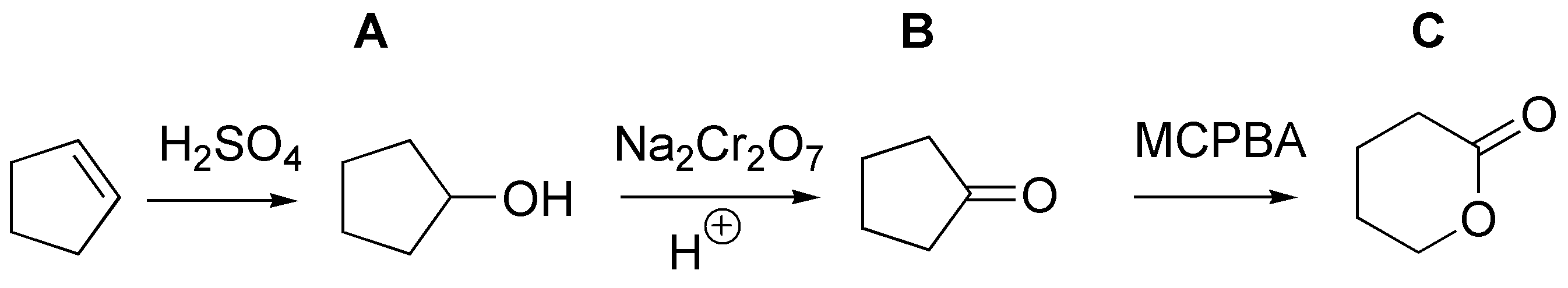
Solución 43:
a) La alquilación del compuesto metilén activo, acetilacetato de etilo (3-oxobutirato de etilo), con bromuro de propilo da el correspondiente cetoéster. Por saponificación y calentamiento en medio ácido sufre descarboxilación dando la 2-hexanona.
b) Se trata de una β-dicetona cíclica. Por tanto, el paso crítico de la síntesis será la formación de un producto cíclico por condensación: reacción de formación de anillos de Robinson o similar, por lo que necesitaremos una cetona insaturada y un compuesto enolizable. La condensación aldólica de la propanona (acetona) produce 4-metil-3-en-pentan-2-ona, que puede sufrir una adición tipo Michael del enolato del malonato de dietilo y posteriormente sufre una condensación aldólica dando la ciclohexano diona indicada en el esquema. La saponificación de dicho producto y posterior acidificación produce la descarboxilación del cetoácido resultante dando el producto deseado.
c) La adición tipo Michael del enolato de la acetofenona (metilfenilcetona) sobre la 3-metilbut-3-en-2-ona produce directamente el producto deseado.
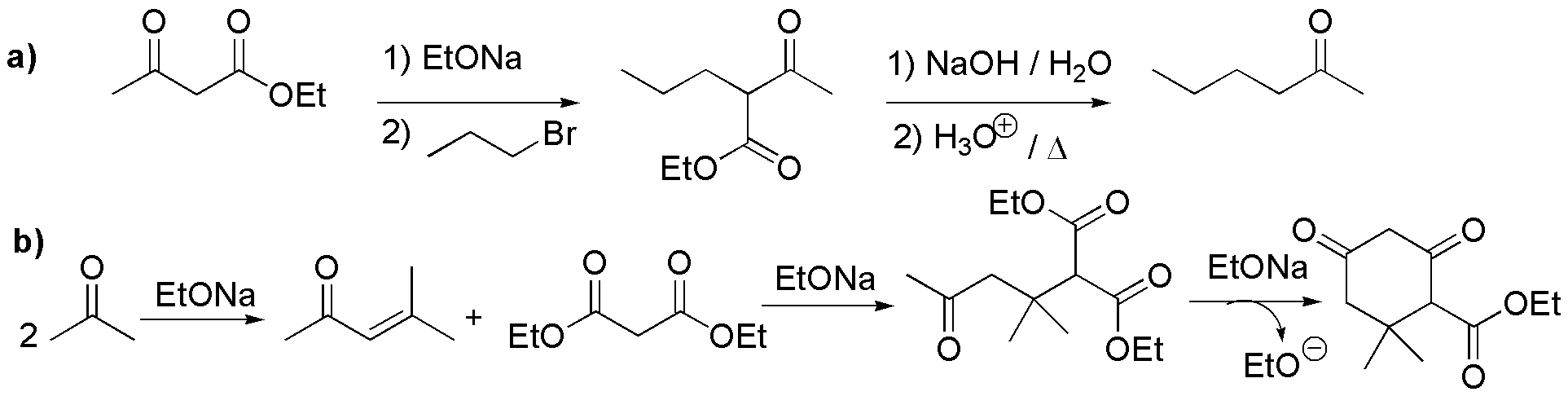
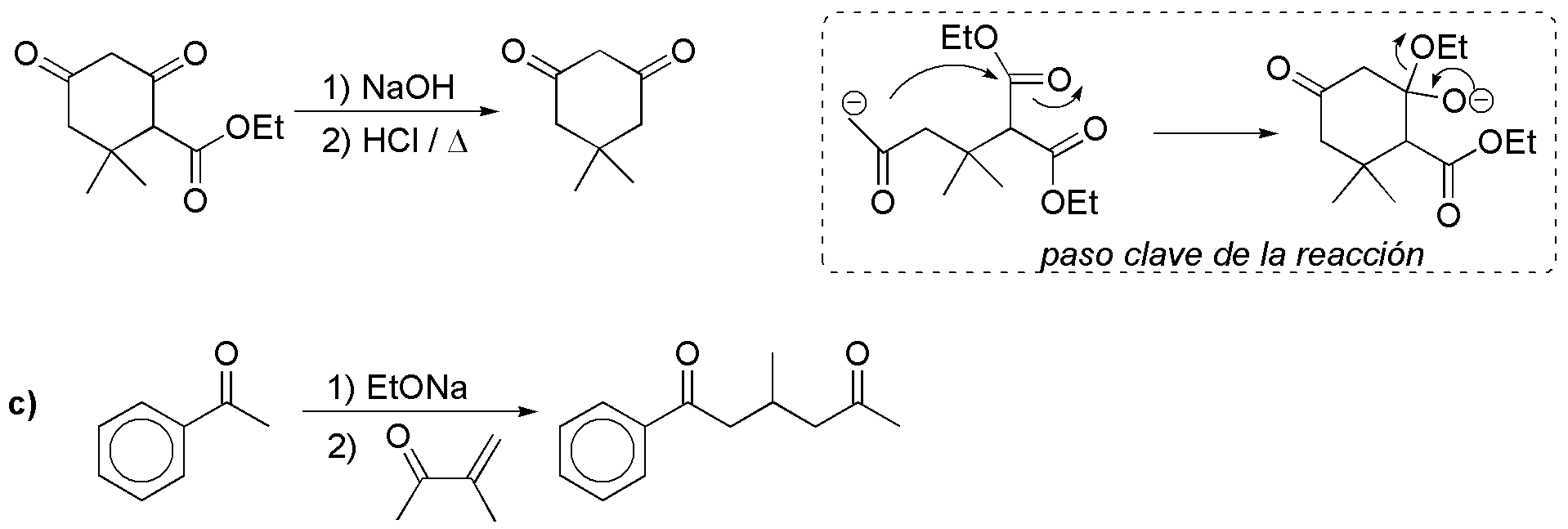
Solución 44:
La síntesis indicada comienza con la formación del correspondiente magnesiano A, que atacará nucleofílicamente al óxido de etileno produciendo el alcohol B que se transforma en el cloroalcano C. Cuando este reacciona con un acetiluro del alquino D, se produce el alquino indicado. La hidrogenación con catalizador de Lindlar da el correspondiente Z-alqueno E, cuya epoxidación nos genera la disparlura, como una mezcla de enantiómeros.
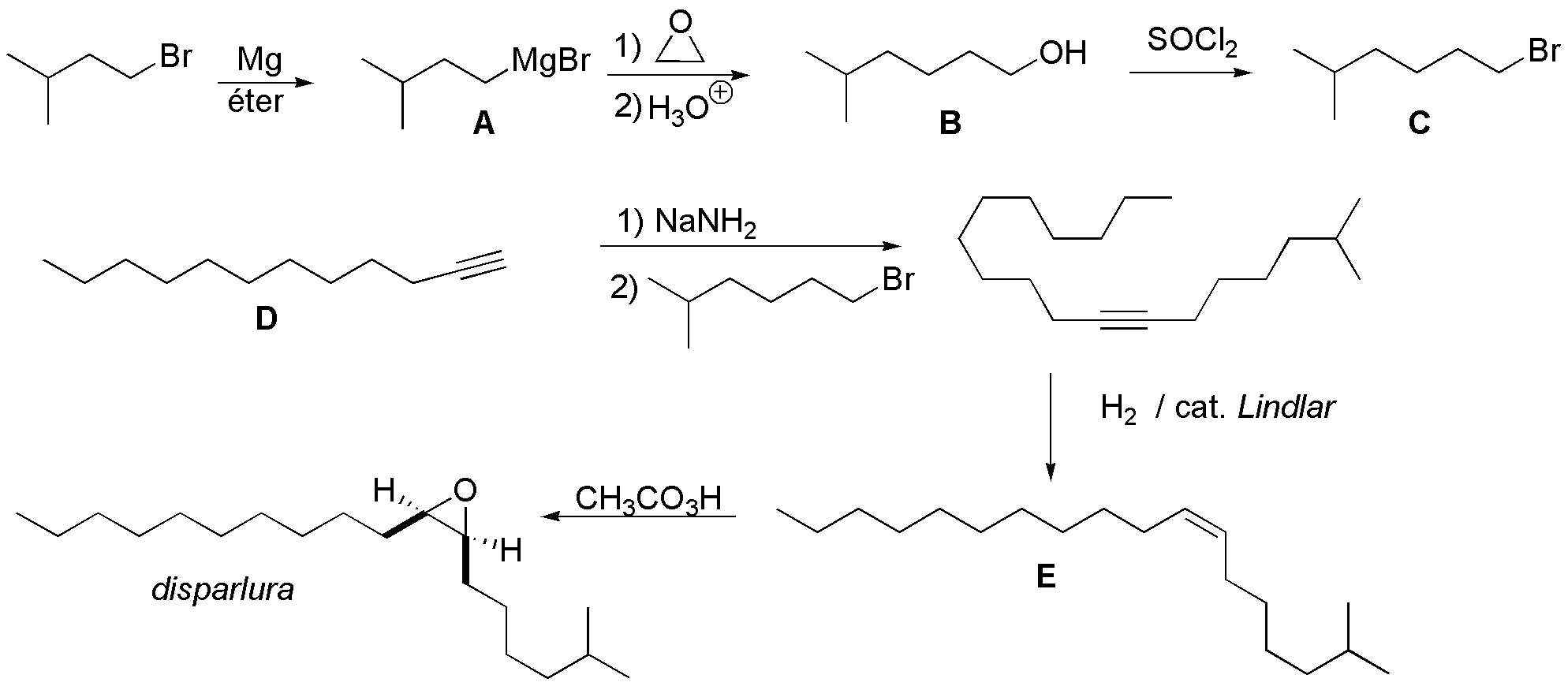
Solución 45:
a) la ciclohexanona puede convertirse fácilmente en el magnesiano del clorociclohexano tal y como se indica en el esquema. La adición de dicho magnesiano a la ciclohexanona producirá un alcohol que deshidrata dando el producto deseado, ya que es el alqueno más estable (más sustituido).
b) Se debe producir una doble alquilación en el carbono &alfa; con respecto al carbonilo. Aprovechamos la distinta capacidad como grupo saliente de los iones bromuro y cloruro, y mediante el tratamiento con LDA (litio diisopropilamiduro) obtendremos el producto deseado.
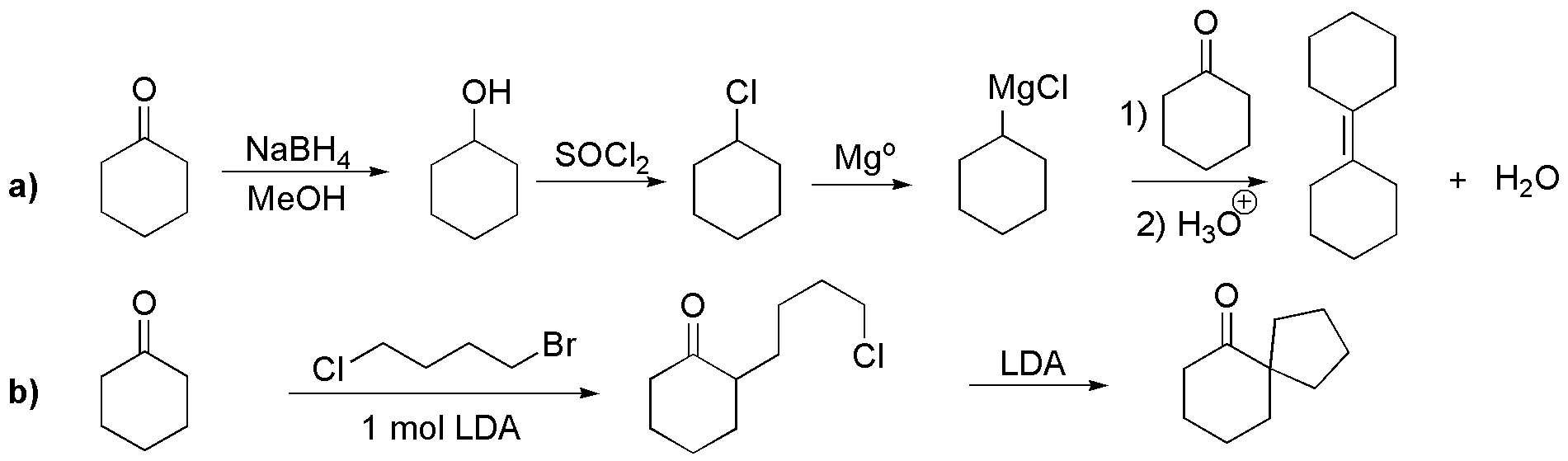
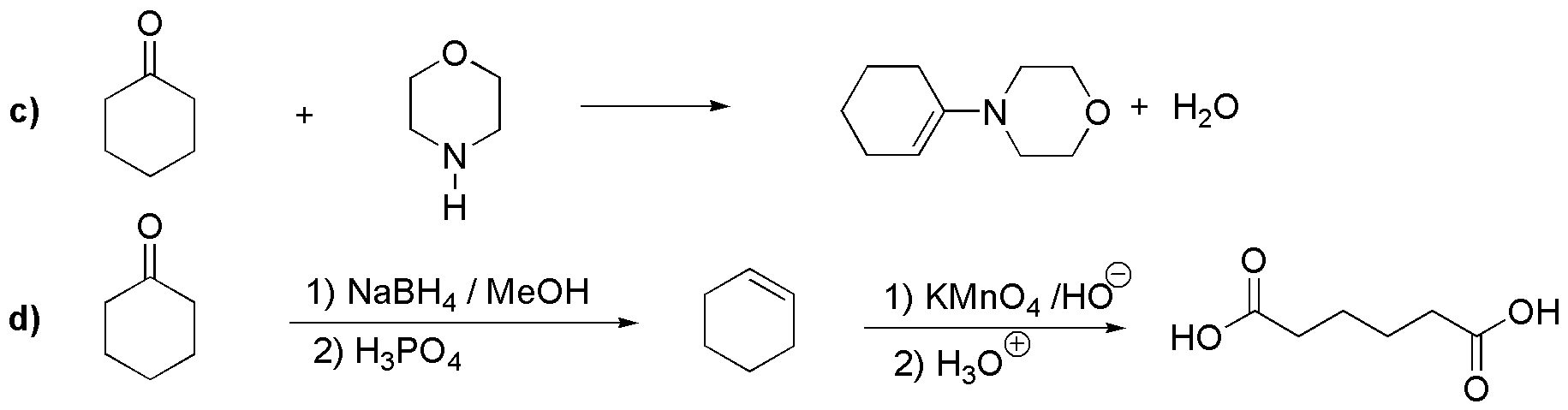
c) Se trata de una enamina como resultado de la reacción de la ciclohexanona con la morfolina (una amina secundaria).
d) La ciclohexanona puede convertirse en ciclohexeno mediante una secuencia reducción-deshidratación. La oxidación con ozono, o con permanganato en medio ácido, nos da el ácido hexanodioíco.
Solución 46:
La síntesis propuesta consistirá en una reducción del nitrilo con LiAlH4 a la correspondiente amina primaria que sometemos a una dialquilación con bromopropano. Existe el riesgo de peralquilación.
Solución 47:
a) Al tratarse de un producto acíclico simétrico rompemos el ciclopenteno con ozono dándonos el pentanodial y este lo sometemos a una doble reacción de Wittig con el iluro de fósforo indicado dando el dieno deseado.
b) Procedemos a la formación de ciclopentanodieno a partir del ciclopenteno por halogenación alílica y posterior deshidrohalogenación. La reacción de Diels-Alder de este con ácido maleíco (ácido (Z)-butenodioíco) da el diácido bicíclico indicado, cuya dihidroxilación y posterior oxidación con ácido peryódico produciría un análogo a la reacción de ozonólisis del doble enlace. La reducción total del producto obtenido con LiAlH4 daría el correspondiente tetrol.
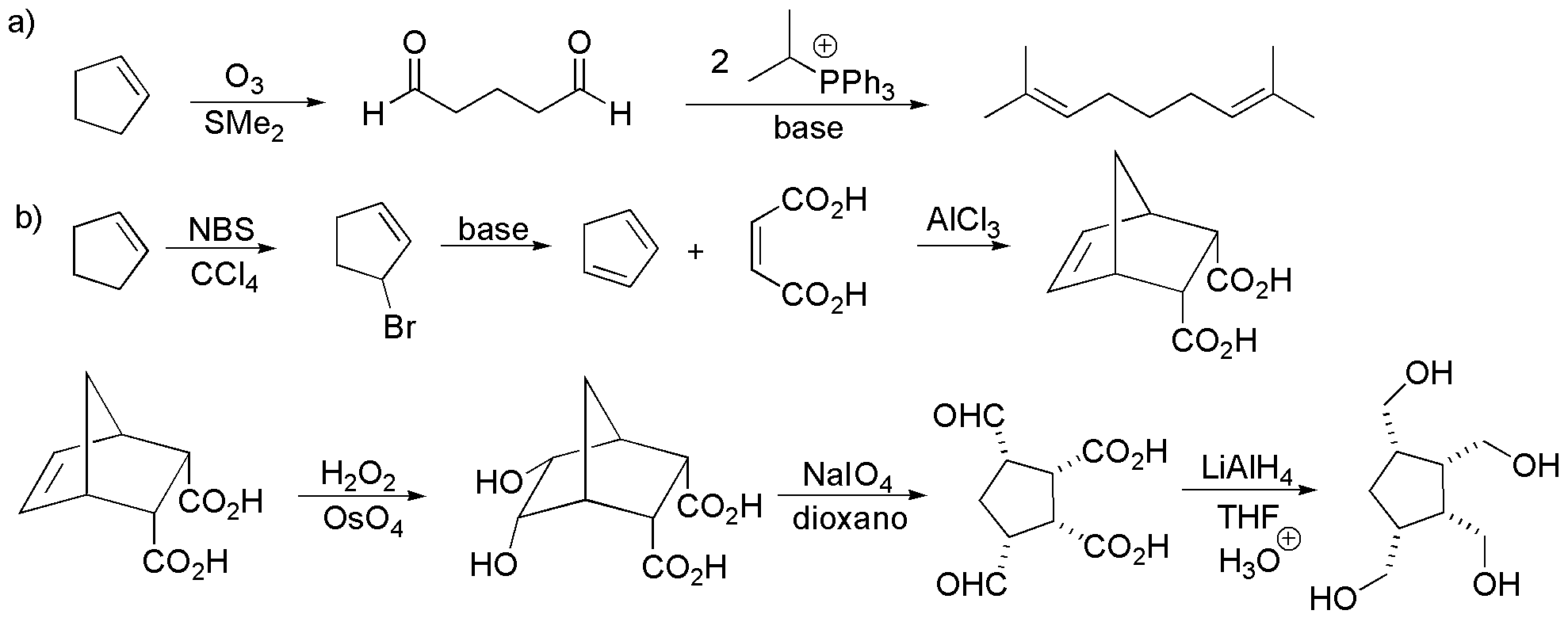
Solución 48:
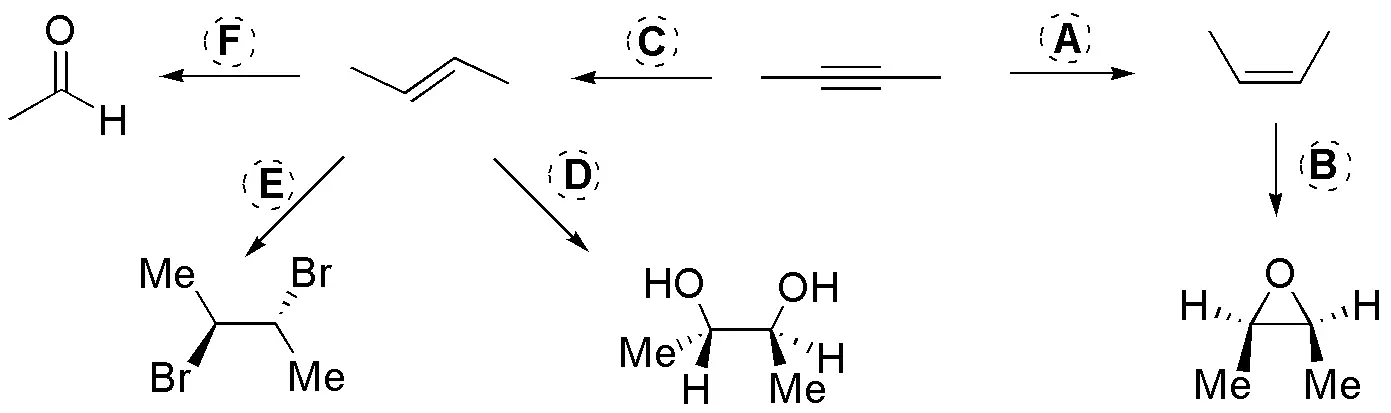
A: Debe tratarse de H2 / cat. Lindlar, para producir el Z-alqueno; B: Al tratarse de un epóxido el producto resultante debe tratarse de un perácido, por ejemplo el ácido peracético; C: Para producir el E-alqueno sería una hidrogenación con Na / NH3(l); D: Como se forma un diol sin lo obtendríamos con OsO4 / H2O2; E: El dibromado se obtendría por bromación del alqueno, luego es: Br2/Cl4C; F: Como el producto es acetaldehído la forma más fácil sería por ozonólisis: O3 y SMe2.
