Written by J.A. Dobado | Last Updated on 1 año
¿Qué son las aminas?
Las aminas son compuestos que presentan, el grupo funcional -NH2.
Índice
Se suelen clasificar según el número de átomos de hidrógeno del amoníaco (NH3) que se sustituye por otros grupos en: primarias (un solo sustituyente), secundarias (dos), terciarias (tres) y cuaternarias (cuatro sustituyentes y se le añade una carga positiva).
Propiedades ácido-base
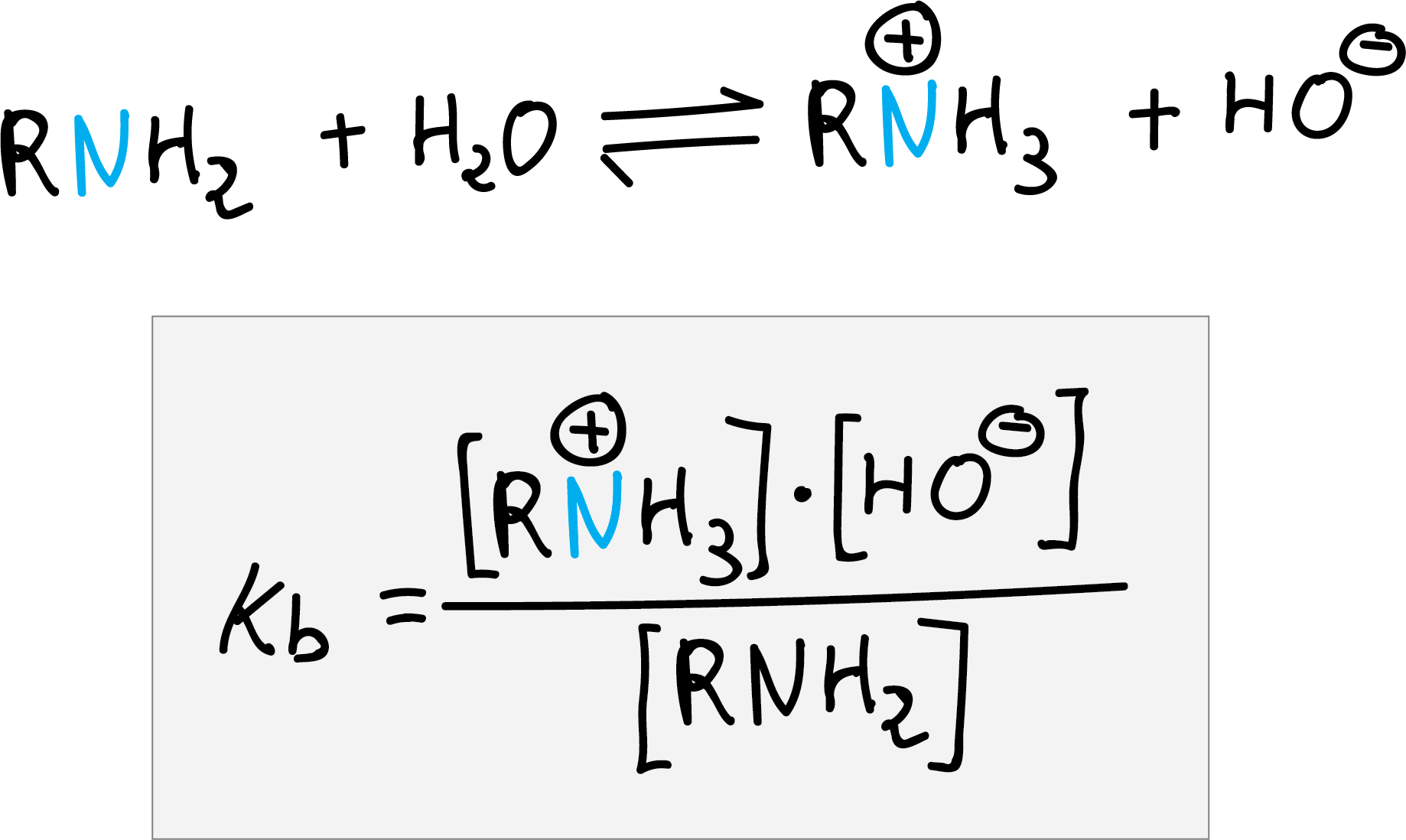
Las aminas son más básicas que el agua pero menos que el ión hidróxido, la constante de equilibrio para la reacción con agua se llama constante de basicidad (Kb).
Los valores de Kb para aminas alifáticas están comprendidos en un rango entre 0,001 y 0,0001 (Véase Apéndice C).
Las aminas aromáticas suelen ser menos básicas que las aminas alifáticas. Los valores de pKa o pKb del ácido o base conjugada se obtienen de la siguiente relación: pKa + pKb = 14.
Además, con bases mucho más fuertes como los alcóxidos, se comportan como ácidos perdiendo un protón para dar el correspondiente amiduro.
![]()
Formulación
Siga el enlace para un resumen de las reglas de formulación y nomenclatura de aminas.
Reacciones
La reactividad de aminas se suelen estudiar separandolas en dos grupos: por un lado las reacciones de aminas alifáticas y por otro las aminas aromáticas (arilaminas).
Listado de ejercicios resueltos de aminas
Siga el enlace para ver un listado de problemas resueltos sobre propiedades y reactividad de las aminas.
Análisis de aminas
La mayoría de las aminas sencillas se reconocen fácilmente por su solubilidad en ácidos minerales diluidos. Las aminas solubles en agua pueden determinarse por su reacción básica mediante el tornasol u otros indicadores.
Las aminas primarias, tanto alifáticas como aromáticas, presentan, en el espectro de IR, un doblete débil aunque reconocible en la región de 3500 a 3300 cm-1 y una fuerte absorción en la región de 1640 a 1560 cm-1.
Las aminas secundarias presentan una banda aislada en la región de 3450 a 3310 cm-1. Las aminas terciarias no presentan absorciones características de utilidad.
Ensayo con ión cúprico
Procedimiento: Se añaden 10 mg o una gota pequeña del compuesto sobre 0.5 ml de una disolución al 10 % de sulfato cúprico.
La aparición de una coloración o un precipitado azul o azul-verdoso es indicativo de la presencia de una amina.
Ensayo de Hinsberg
Suspender la sospechada amina en una disolución de NaOH. Al añadir cloruro de bencenosulfonilo:
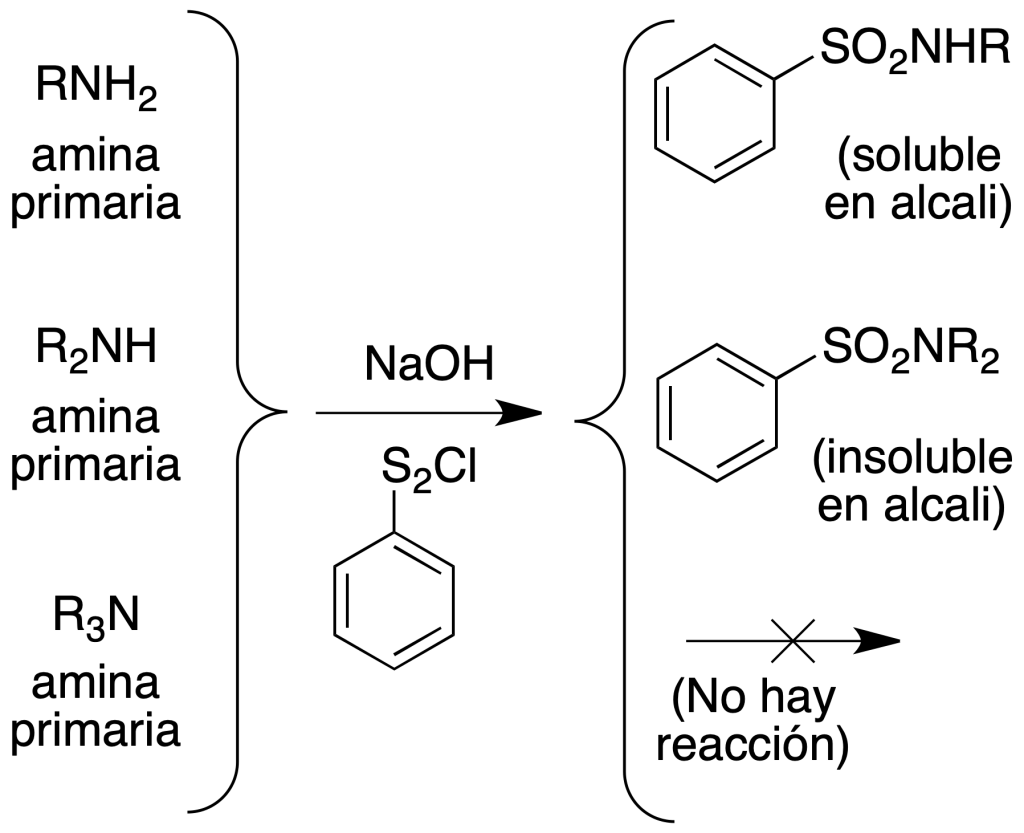
- Las aminas primarias forman sulfonamidas que permanecen disueltas en la disolución fuertemente alcalina. Al acidular, precipita la sulfonamida sólida blanca.
- Las aminas secundarias forman sulfonamidas que no quedan en la disolución sino que precipitan directamente como sólidos blancos a partir de la mezcla reaccionante alcalina, insolubles en agua, álcalis y ácidos diluidos.
- Las aminas terciarias no reaccionan, permanecen sin disolver y se disuelven al acidular.
Procedimiento: En un tubo de ensayo se colocan 0.1 ml o 100 mg de la amina, 200 mg de cloruro de p-toluensulfonilo y 5 ml de disolución de NaOH al 10 %. Se tapa el tubo y se agita durante 5 min.
Quitar el tapón y calentar 1 min. Si no se produce reacción la sustancia es una amina terciaria, probablemente. Si aparece un precipitado diluimos con 5 ml de agua y agitamos.
Si no se disuelve probablemente es una amina secundaria. Si se disuelve, acidificar con HCl diluído. Si aparece nuevamente el precipitado se tratará de una amina primaria.
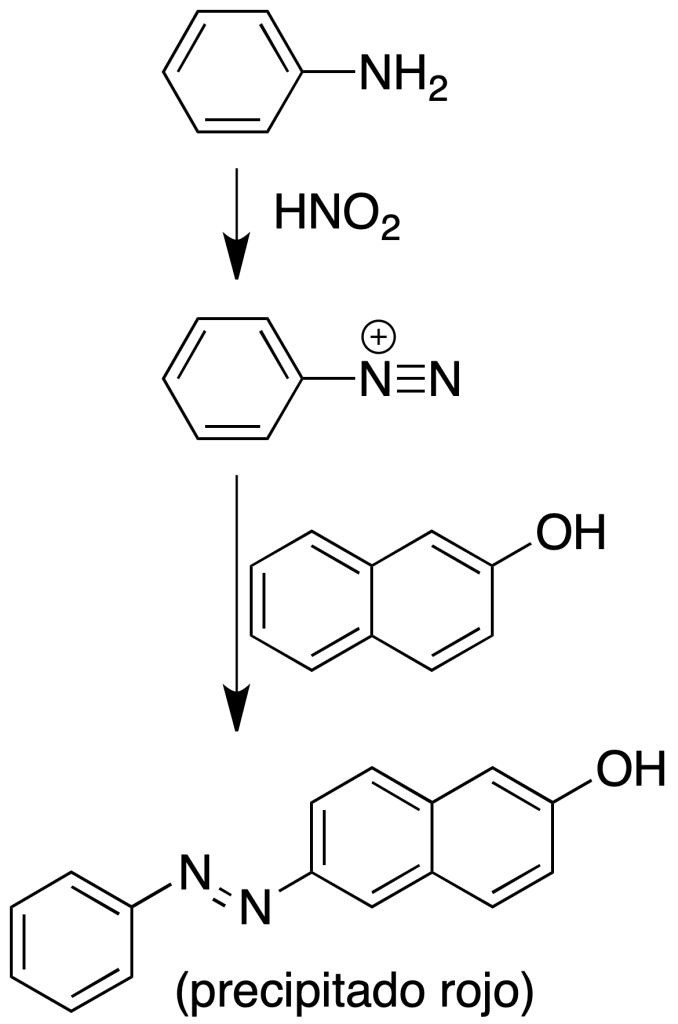
Ensayo con ácido nitroso (ensayo con β-naftol) para aminas aromáticas
Procedimiento: Disolver 100 mg de amina en 3 ml de HCl 2 N (o 5 %) y enfriarlo en un baño de hielo. Añadir 1 ml de solución al 10 % de nitrito sódico en agua.
Si se produce el desprendimiento de nitrógeno es indicativo de amina primaria alifática. Si al calentar suavemente se produce el desprendimiento de nitrógeno es indicativo de amina primaria.
Si se trata de una amina primaria aromática se puede atrapar la sal de diazonio con una solución de 100 mg de β-naftol en 2 ml de NaOH al 10 %. Añadida gota a gota sobre la solución anteriormente indicada da un precipitado rojo del colorante azoico correspondiente. El colorante puede ser también naranja.
Si en el tratamiento con nitrito se forma un compuesto amarillo insoluble (aceite o solido) se trata de una amina secundaria.
Si no se observa reacción se trata de una amina terciaria alifática.
Si se tratase de una amina terciaria aromática se puede formar el derivado p-nitrosado (si la posición esta libre) reconocible por ser un compuesto amarillo, soluble en agua y que por acción de los álcalis da un precipitado verdoso.
Formación de aminas
Las aminas se pueden caracterizar mediante las siguientes reacciones:
Formación de sulfonamidas
Procedimiento: Se refluye durante 5-10 min una mezcla de 150 mg de cloruro de sulfonilo (benceno o p-toluensulfonilo) y 200 mg de la amina en 4 ml de benceno seco. La mezcla se deja enfriar. Se elimina por filtración el clorhidrato de la amina que precipita. Del filtrado se evapora el benceno para obtener la sulfonamida cruda, la que podemos recristalizar de EtOH.
Formación de benzamidas
Procedimiento: Se suspenden aproximadamente 150 mg de la amina en 1 ml de NaOH al 10 % y se añaden gota a gota 0.5 ml de cloruro de benzoilo mientras se agita vigorosamente y se enfría.
Después de unos 10 min se neutraliza cuidadosamente hasta pH = 8. Se filtra la benzamida, se lava con agua y se recristaliza de EtOH/H2O.
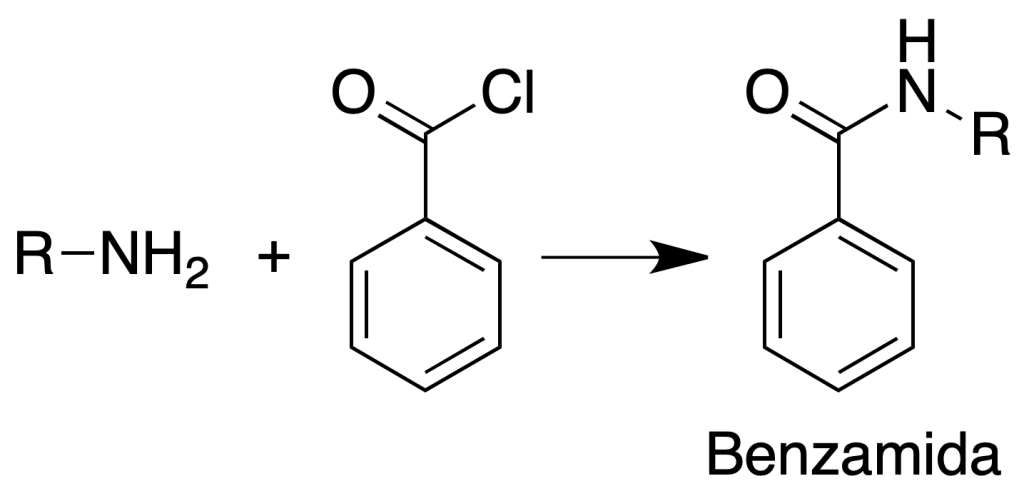
Un método alternativo consiste en el calentamiento de la amina y al cloruro de benzoilo disueltos en 2 ml de piridina a reflujo durante 30 min. Se vierte sobre agua helada y el derivado se recoge por filtración.
Formación de acetamidas
Procedimiento: Disolver unos 200 mg de amina insoluble en agua en 10 ml de HCl al 5 %. Añadir NaOH al 5 % con una bureta hasta incipiente turbidez.
Eliminar la turbidez con unas gotas de HCl al 5 %. Añadir un poco de hielo y 1 ml de anhídrido acético.
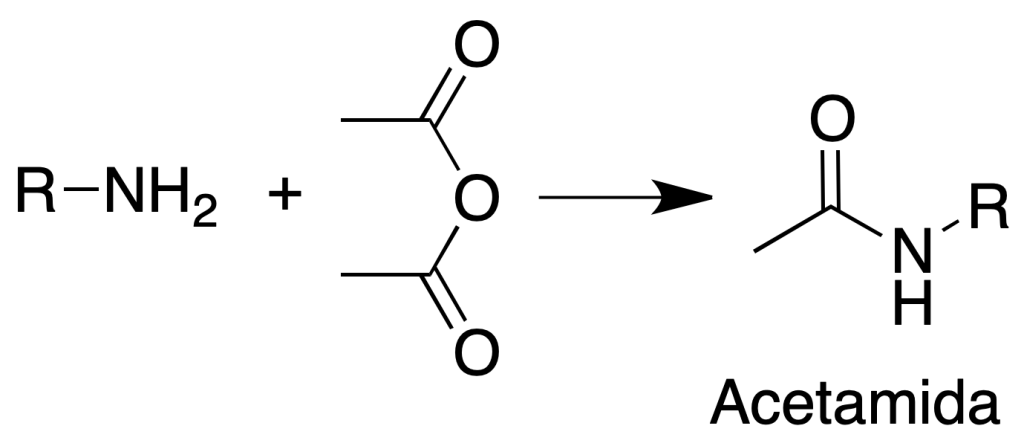
Agitar la mezcla y añadir 1 g de acetato sódico hidratado disuelto en 2 ml de agua.
Enfriar en un baño de agua helada y filtrar el sólido. Se recristaliza de EtOH/H2O.
Formación de picratos
Se utilizan principalmente como derivados de aminas terciarias.
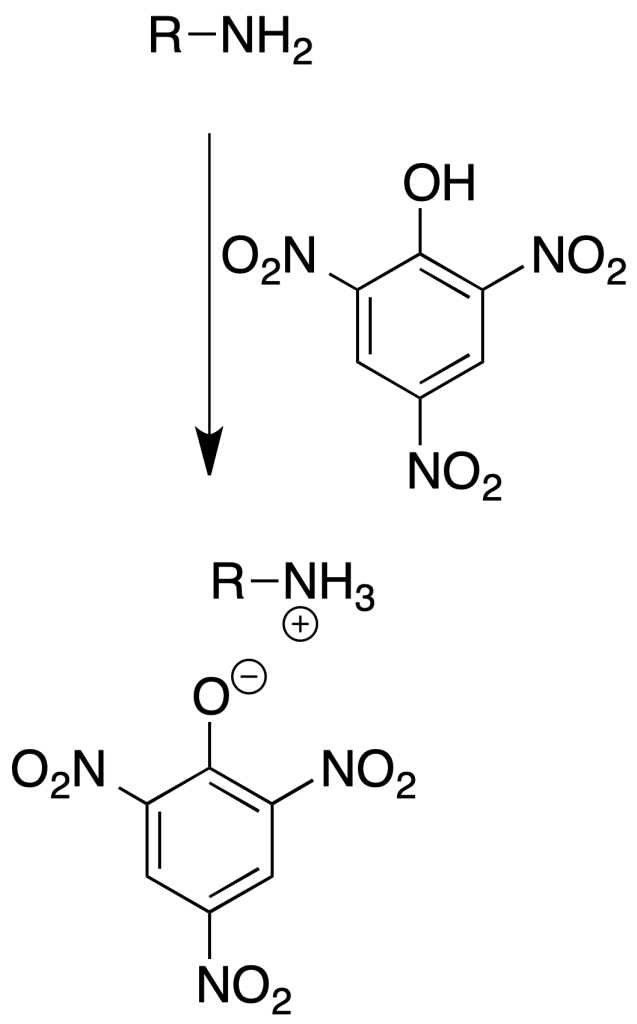
Procedimiento: Disolver unos 100 mg de amina en 5 ml de EtOH. Añadir 5 ml de disolución saturada de ácido pícrico en EtOH.
Calentar la disolución hasta que hierva y dejar enfriar lentamente. Los cristales amarillos formados pueden recristalizarse de MeOH o EtOH.
