Written by J.A. Dobado | Last Updated on 5 meses
¿Qué son los azoles?
Los azoles son compuestos orgánicos cíclicos de cinco miembros que presentan uno o más átomos en el anillo distintos del carbono, siendo como mínimo uno de los heteroátomos nitrógeno. Este es el grupo de heterociclos aromáticos más grande y diverso. Se derivan del furano, tiofeno y pirrol, por reemplazo de uno o más grupos CH por nitrógenos con hibridación sp2.
Índice
La variación en el número y posiciones de los átomos de nitrógeno es lo que da lugar a la gran diversidad estructural de este grupo de heterociclos. Los nombres preferidos para estos heterociclos terminan en azol y, por lo que se denominan azoles.
Cuando la sustitución de un CH por un nitrógeno se efectúa en la posición C3 las estructuras (oxazol, tiazol e imidazol) quedarían de la siguiente forma.

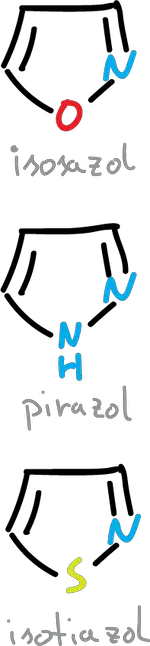
Si se realiza la sustitución de nitrógeno en la posición C2 nos quedan las siguientes estructuras (isoxazol, isotiazol y pirazol).
Los triazoles y tetrazoles, con 3 y 4 átomos de nitrógeno, respectivamente, se nombran de manera sistemática (véase nomenclarura).
La presencia de los átomos de nitrógeno adicionales en los anillos tienen efectos relevantes sobre las propiedades de estos compuestos.
Estos átomos de nitrógeno contienen pares de electrones sin compartir en el plano de los anillos, que no participan en el sistema π. Por tanto, permiten que los azoles se comporten como bases y tengan cierto grado de carácter nucleófilo.
El imidazol es una base fuerte, pero los otros azoles són bases débiles.
En términos generales, la basicidad desciende, conforme aumenta el número de átomos de nitrógeno debido al efecto inductivo y electrón-atrayente de los mismos. Los que contienen oxígeno son los ménos básicos debido al efecto inductivo del oxígeno.
Estos heterociclos se consideran como híbridos de resonancia de diversas estructuras contribuyentes:
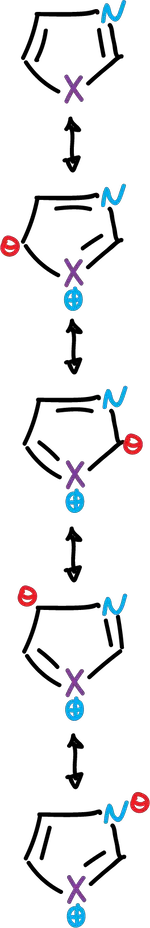
Cada estructura no contribuye por igual al híbrido de resonancia. Entonces, los átomos de carbono de los azoles no son equivalentes en términos de densidad electrónica π, y este efecto se refleja en su comportamiento químico.
Otro efecto importante de la movilidad protónica es que los diazoles, triazoles y tetrazoles N-insaturados existen en formas tautoméricas interrelacionadas por transferencia intramolecular de protón.
Normalmente, esta transferencia es demasiado rápida para permitir el aislamiento de las estructuras individuales, como se ilustra en los ejemplos para el pirazol e imidazol.
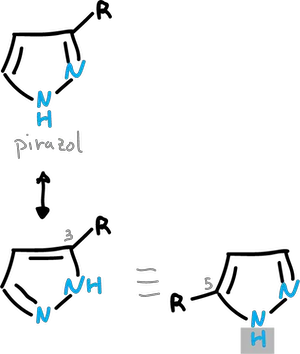
Debido a esta rápida transferencia de protones, no existe por separado un pirazol sustituido en C3 y otro en C5.
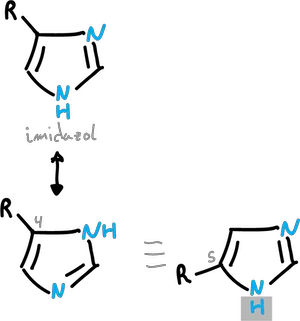
Igualmente, los imidazoles sustituidos en C4 y C5 se interconvierten con demasiada rapidez para permitir su aislamiento individual.
Sin embargo, los tautómeros pueden existir en disolución con predominio de una forma particular.
Por ejemplo, en el caso del nitro imidazol donde el equilibrio se desplaza hacia el derivado en C4.
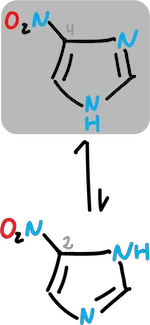
Imidazoles
Pirazoles, triazoles y tetrazoles
Benzodiazoles y benzotriazoles
Existen tres sistemas heterocíclicos anulares que corresponden a diazoles o triazoles benzofusionados: indazol, benzimidazol y benzotriazol.
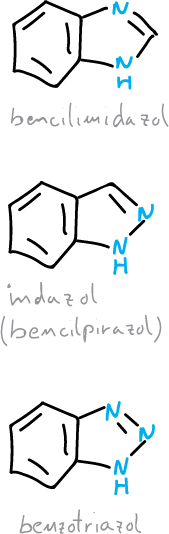
El benzimidazol forma parte de la estructura de la vitamina B12, también existen diversos benzimidazoles que se usan como fármacos.
Varios imidazoles y benzotriazoles se emplean como agentes de brillo óptico y como estabilizadores de plasticos ante la luz.
El benzotriazol es el ácido más fuerte de los tres heterociclos (pKa = 8.2) y el benzimidazol es la base más fuerte. Así, el catión benzimidazolio presenta un pKa de 5.5.
Síntesis
Por reacciones de ciclación a partir de bencenos 1,2-sustituidos de tipo apropiado. Por ejemplo, la benceno 1,2-diamina con derivados de ácidos carboxílicos.
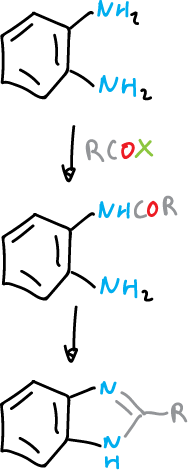
Los benzotriazoles se obtienen a partir del mismo tipo de reactivos por diazotación y ciclación de sal de diazonio.
Por otro lado, los imidazoles, analogamente diazotando una anilina que tenga un sustituyente ortocarbonado.
Reacción de sustitución electrófila
Es posible llevar a cabo nitraciones, halogenaciones y otras reacciones similares.
El benzimidazol y el imidazol son atacados preferentemente en la posición C5 y el benzotriazol en C4.
Ataque nucleófilo
Los benzimidazoles en su posición C2 se pueden ser atacados por nucleófilos. Los alcóxidos, aminas, tioles y otros nucleófilos desplazan al cloruro de la posición C2 del benzimidazol.
Su reactividad frente a nucleófilos es inferior a la de los benzoxazoles y benzotiazoles correspondientes.
La alquilación del imidazol y el benzotriazol conduce, normalmente, a mezclas de derivados sustituidos en las posiciones N1 y N2, en una proporción que depende del agente alquilante.
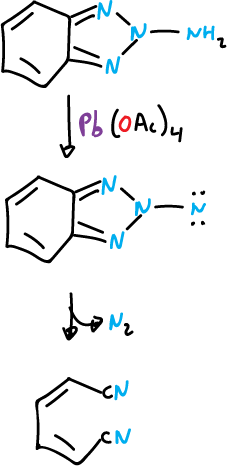
El 1- y 2-amino benzotriazol se oxidan con rapidez con acetato de plomo (IV), Pb(OAc)4, y en ambos casos se abre el sistema anular.
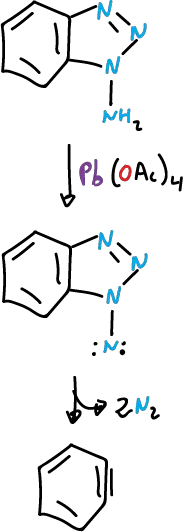
El modo de apertura de los anillos es distinto.
Los benzotriazoles sustituidos en la posición N1, al igual de los 1,2,3-triazoles monocíclicos, pueden perder nitrógeno por termólisis (Δ) o fotólisis (hν).
En el caso de los arilbenzotriazoles, los intermedios generados por eliminación del nitrógeno pueden ciclarse de nuevo en a posición orto-, del sustituyente arilo, la que lleva a la formación de un derivado del carbazol.
Reacción de Graebe-Ullman
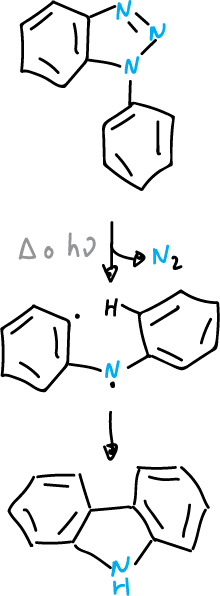
Esta reacción se ha utilizado en la síntesis de alcaloides.
Oxazoles y tiazoles
Isoxazoles, isotiazoles y sus benzoderivados
Oxadiazoles y tiadiazoles
Betainas y compuestos mesoiónicos
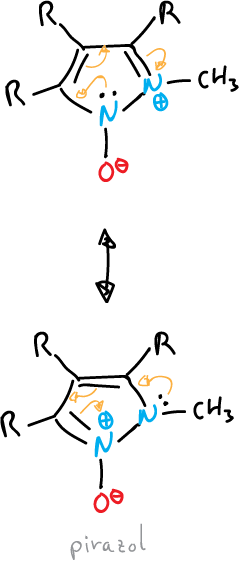
Algunos heterocilos de 5 miembros, totalmente insaturados, no se pueden representar mediante estructuras de enlace de valencia sin utilizar cargas.
Se representan con estructuras dipolares, es decir son betainas.
Contienen una disposición cíclica de 5 orbitales p que se pueden representar con un contenido de seis electrones π y un sexto orbital p, exocíclico que contiene dos electrones π.
Se pueden dividir en dos grupos generales:
- Óxidos o imidas: el átomo exocíclico está unido al sistema por un heteroátomo, como en el casos del tiazol.
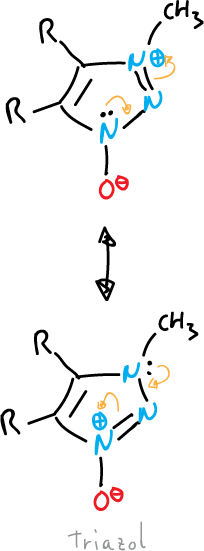
o también, el del pirazol que se muestra a continuación:
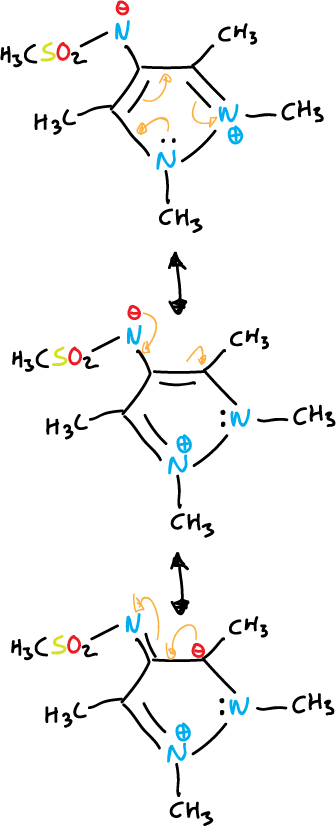
- Compuestos mesoiónicos: el átomo exocíclico está unido a través del carbono.
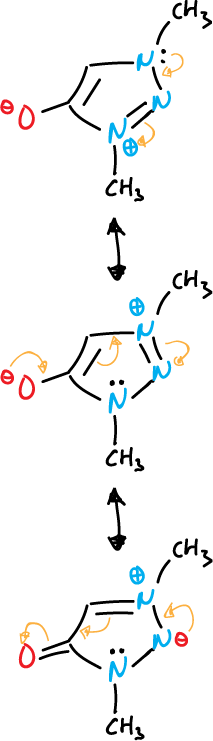
otro ejemplo con diazoles se indica a continuación.